过敏性紫癜动物实验模型的对比分析及建模思路探讨
段凤阳徐闪闪丁 樱*郭 婷宋纯东张 霞
(1.河南中医药大学第一附属医院,郑州 450000;2.河南中医药大学儿科医学院,郑州 450000)
过敏性紫癜(Henoch-Schönlein purpura,HSP)是儿童时期常见的血管炎,紫癜性肾炎(HSPN)是过敏性紫癜最严重的并发症,是儿童时期最常见的继发性肾小球疾病,具有患病率逐渐升高,病程迁延,部分患儿可进展为慢性肾衰竭等特点,现代医学治疗尚无统一方案[1-4]。 目前关于HSP 或HSPN的报道多以临床研究为主,鉴于医学伦理等直接人体实验的局限性,有关本病病因探索,病机阐述,疗效评价及新药研发等方面受到极大限制,故构建HSP 动物实验模型意义重大。 通过查阅国内外文献,笔者发现当前有关本病动物实验模型存在文献报道少、构建方法各异且存在学术争鸣等特点,下面将从国内外建立HSP 动物模型的制备思路、理论依据、造模方法及优缺点等方面进行归纳分析,探讨HSP 动物实验模型的建构思路,以供相关科研人员参考。
1 参照IgA 肾病实验动物模型法建立的HSP 实验动物模型
HSP 又称IgA 相关性血管炎,HSPN 和IgA 肾病病理上均表现为肾小球系膜区以IgA 为主的免疫球蛋白沉积和系膜增生[5]。 Reamy 等[6]认为二者本质上是同一种疾病的全身系统受累或单独肾受累的不同表现形式。 国内韩冰虹等[7]参照IgA 肾病动物实验模型法探讨了HSP 动物实验模型的构建,即选用20 只KM 小鼠口服麦胶蛋白+尾静脉注射印度墨水稀释液。 实验前3 周模型组小鼠尾静脉注射印度墨水,剂量为4 mg/100 g,每周1 次,共3 周,后予含麦胶蛋白的酸化饮用水灌胃,剂量为每只0.5 mL,隔日1 次,持续至14 周末,最后予尾静脉注射麦胶蛋白液体,每天1 次,每只0.2 mL,连续3 d。该模型建成后有3 例小鼠出现了皮肤紫癜表现,皮肤和肾组织形态学变化与人类HSP 基本一致。 沈银红等[8]、杨云等[9]等通过此种造模方法发现实验小鼠24 h 尿蛋白定量、血清循环免疫复合物(circulating immune complex,CIC)水平、血清炎症指标、肾组织氧化应激水平均出现了明显改变;苗丰等[10]通过此种造模方法发现,模型组小鼠血清尿素氮、肌酐、晚期氧化蛋白产物及CIC 水平明显升高,肾病理显示系膜区可见大量CIC 沉积,基质大量增加,基底膜增厚。 最近的基础研究表明,HSP 的发病机制与细胞免疫失衡有关,主要表现为与Th17 细胞相关的RORγt 高表达和Treg 细胞相关的Foxp3表达显著降低[11-12]。 贵琳等[13]在研究TLR4 单克隆抗体对HSP 小鼠的保护作用的实验中,通过qRTPCR 技术发现,此种造模方式除肾损伤与HSP 相似外,RORγt 与Foxp3 在皮肤及肾的表达与HSP 相同。 尽管如此,此种造模方式以印度墨水封闭网状内皮系统,导致内皮系统功能障碍,然后持续给予抗原刺激免疫系统,促进IgA 的产生及沉积,从而获得与HSPN 相似的病理细胞因子学改变,但HSP 特征性皮疹的出现率却偏低。
2013 年黄华等[14]借鉴IgA 肾病造模方法,采用牛清白蛋白(BSA)+脂多糖(LPS)+四氯化碳(CCl4)进行HSPN 造模,实验动物为KM 雌性小鼠,首先予10%免疫原BSA 1200 mg/kg 灌胃,隔日1 次,持续6 周;后予蓖麻油0.5 mL+CCl40.1 mL 皮下注射,每周1 次,持续6 周;再以0.9%氯化钠溶液配制0.025% LPS 每只小鼠尾静脉注射0.05 mg,在第3、5 周注射,每周1 次。 造模结束后有10 只模型组小鼠死亡,尿蛋白阳性率为90%。此种造模方式以血尿、蛋白尿检查均阳性作为造模成功标志,但应用药物种类多,操作复杂,动物死亡率高。
近年来,随着中医中药治疗HSP 的发展,中西医结合构造HSP 动物模型的研究逐渐深入。 其造模思路主要是在IgA 肾病实验动物模型法的基础上侧重发挥中医思想,首先以中医热性药物灌胃造就动物血热的偏颇体质模型,然后参照应用麦胶蛋白作为饮食抗原复感外邪,加以印度墨水封闭网状内皮系统(RES)的经典IgA 肾病造模方法,建立HSP实验动物模型,在造模前中后期分别对实验动物进行一般状况、血尿免疫检测及皮肤肾病理改变观察监测。 张奕星等[15]参考了黄华等关于HSPN 动物模型的研制思路,综合模拟中医瘀热证与IgA 肾病动物模型,对紫癜性肾炎实验动物模型进行了中医病证结合的深入探索,首先运用BSA 联合LPS 及CCl4方法造就IgA 肾病SD 大鼠模型,即于室温30℃下以蒸馏水配制10%免疫原BSA,隔天灌胃持续8 周(400 mg/kg),皮下注射蓖麻油0.3 mL+ CCl40.1 mL,每周1 次,共9 周,于6、8、10、12 周每只小鼠尾静脉注射0.025% LPS 0.2 mL,并于第9 周开始隔天灌服10 mg/kg 的25%干姜水复合中医瘀热型动物模型。 结束后模型组6 只大鼠出现了肉眼血尿,2 只出现皮肤瘀斑,尿蛋白及红细胞计数升高,肾病理符合HSPN 变化,并以此模型探讨了丹芍颗粒Ⅲ对HSPN 大鼠血尿蛋白尿和肾组织部分蛋白的影响[16]。 这种方式创新了HSP 动物实验模型的造模方法,为中医药治疗HSP 的机理研究提供了思路。
上述HSP 动物实验模型的构建理论依据来源于现代医学认为IgA 肾病和HSPN 的病理表现相似,HSPN 可理解为伴有皮肤紫癜等肾外表现的IgA肾病。 故造模成功后多偏重于肾损伤的同质性,对于皮损症状出现的关注度偏低。 麦角蛋白联合印度墨水法存在造模时间长,血尿出现率低、皮肤紫癜出现例数少等不足,牛清白蛋白+脂多糖+四氯化碳法虽造模时间短,但造模药物多,操作复杂,费用及动物死亡率高,存在造模药物诱发动物模型脏器损伤的风险。 尽管如此,在此种造模思路的影响下,亦出现了运用中医证型联合IgA 肾病动物实验模型的病证结合模型,推动了中医中药对HSP 的研究。
2 依据Ⅲ型超敏反应原理构建HSP 动物实验模型
目前世界公认的过敏性紫癜的发病诱因主要归结于感染原和过敏原,由过敏原介导的Ⅲ型过敏反应,又称免疫复合物型过敏反应[17-18]。 潘仕红等[19]采用卵清蛋白(OVA)作为抗原,诱导并激发Ⅲ型变态反应,构建了HSP 大鼠模型,具体操作如下:取10 只SD 大鼠适应性喂养1 周,然后给予10 mg/kg OVA 乳化溶液干预,包括OVA 溶液(20 mg/mL)和弗氏完全佐剂以1 ∶1 混合,腹腔注射,每周1 次,共3 周。 3 周后再予10 mg/mL OVA 生理盐水溶液尾静脉注射,同时给予0.3% OVA 生理盐水溶液皮内注射,分5 个注射点,每个点0.2 mL。此种造模方式80% SD 大鼠的腹部和尾部出现散在皮肤紫癜,血清炎症因子明显升高,肾病理显示系膜细胞及基质增生,免疫荧光IgA 免疫复合物颗粒状沉积(+++)。 李彦红等[20-21]根据HSP 发病病因与过敏及机体自身的遗传因素有关等因素,通过构建兔过敏性体质,再依据Ⅲ型超敏反应原理构建了HSP 兔模型,其建模方法分为3 部分:先构建过敏体质,即以荜拨、干姜、胡椒水1 ∶1 ∶1 混合口服给药3 周,记录动物活动量、体温、日饮水量及血常规;再连续抗原刺激致敏,即腹腔注射含卵圆蛋白与弗氏完全佐剂1 ∶1 混合乳化溶液(每只1 mL),每周1 次,连续3 周;然后抗原冲击激发过敏反应,即耳缘静脉注射卵圆蛋白生理盐水(10 mg/mL)0.5 mL,背部剪毛,皮内注射0.3% 卵圆蛋白生理盐水共1 mL,分5 点,每点0.2 mL。 抗原激发24 h 后测动物模型血尿等一般情况,2 周后解剖,取皮肤、肾等做病理及IgA、C3 免疫荧光检测。 造模结束后发现,此种造模法模型组动物皮肤瘀斑出现率明显提高,血液中IgA 明显升高,补体C3 降低,皮肤及肾病理改变符合HSPN 表现,经与HSP 患儿的血液学和免疫学特征比较,发现该HSP 模型可以模拟儿童HSP 特征[22-24]。 候兆玉等[25]运用此种造模方式发现并证实,模型组家兔血清IgA 含量明显升高,与临床HSPN 患者相关血清学检测具有一致性。
采用Ⅲ型超敏反应原理HSP 实验动物模型,具有造模时间短,操作简单,能很好地模拟HSP 皮肤瘀斑等优点,有助于研究HSP 组织炎症和损伤相关的分子机制。 但模型组动物皮肤瘀斑仅出现在局部注射部位,与HSP 自发性皮肤瘀斑不同,对过敏反应和上游免疫机制的研究有限等不足。
3 针对HSP 动物实验模型的学术争鸣
尽管HSP 动物实验模型的构建研究已经持续了数十年,且实验物种由小鼠,丰富至大鼠、兔等,但是现有模型是否真正的代表HSP,并满足临床研究需要,国内外专家意见并不一致。 部分学者认为HSP 是一种以IgA 为主的免疫复合物介导的白细胞破裂性血管炎,主要累及皮肤、胃肠道、关节及肾,上述动物实验模型仅检测了皮肤或肾的IgA 或C3沉积,对于其他免疫球蛋白IgG、IgM 是否沉积或是否以IgA 沉积为主关注不足;另外现有动物模型的皮损改变是局部刺激引起,并非HSP 自发性出现,且大多数实验动物物种不表达IgA 受体FcαR1,这就忽略了中性粒细胞通过FcαR1 激活的影响[26-27]。因此,这些模型是否具有HSP 发病机制的代表性尚不清楚。 对此,Li 等[28]提出了不同意见,由于HSP的主要特征是IgA 免疫复合物的沉积,C3 是该病的主要病理因素,所以实验主要是基于IgA 沉积和C3检测,此结果与国外文献报道一致[29-30],且其在实验初期检测了IgG 及IgM 水平,但仅存在部分模型和少数对照组中;其次,临床中HSP 自发性皮肤紫癜一定程度上属于血管过敏反应的外在表现,IgA和FcαR1 之间的相互作用可能在IgA 血管炎(IgAV)的发病机制中发挥作用,但也可能属于一种新的发病机制,与探讨IgA 免疫复合物通过激活补体途径引起HSP 的免疫机制并不冲突。
4 HSP 动物实验模型的现状述评及思路探讨
4.1 HSP 动物实验模型的现状及不足
目前国内外关于HSP 动物实验模型的探索主要发生于2000 年以后,且以国内学者为主[31]。 就造模方法而言,主要分为基于借鉴IgA 肾病模型的麦胶蛋白+印度墨水法、牛清白蛋白+脂多糖+四氯化碳法、卵清蛋白+和弗氏完全佐剂法和参照中医血热理论的“病证结合”模型;就实验动物而言,主要包括麦胶蛋白联合印度墨水的昆明雌性小鼠,清白蛋白+脂多糖+四氯化碳SD 雄性大鼠以及卵蛋白法选择大耳白兔或SD 雄性大鼠,中西医结合的“病证结合”模型多选择SD 雄性大鼠和大耳白兔;就造模时间而言,多在3~15 周不等;就造模观察指标而言,主要涵盖皮损、血、尿等实验室检查、HSP 细胞因子检测以及皮肤和肾病理形态及免疫复合物沉积。 现就造模时间、造模方法、优缺点梳理如下。详见表1。
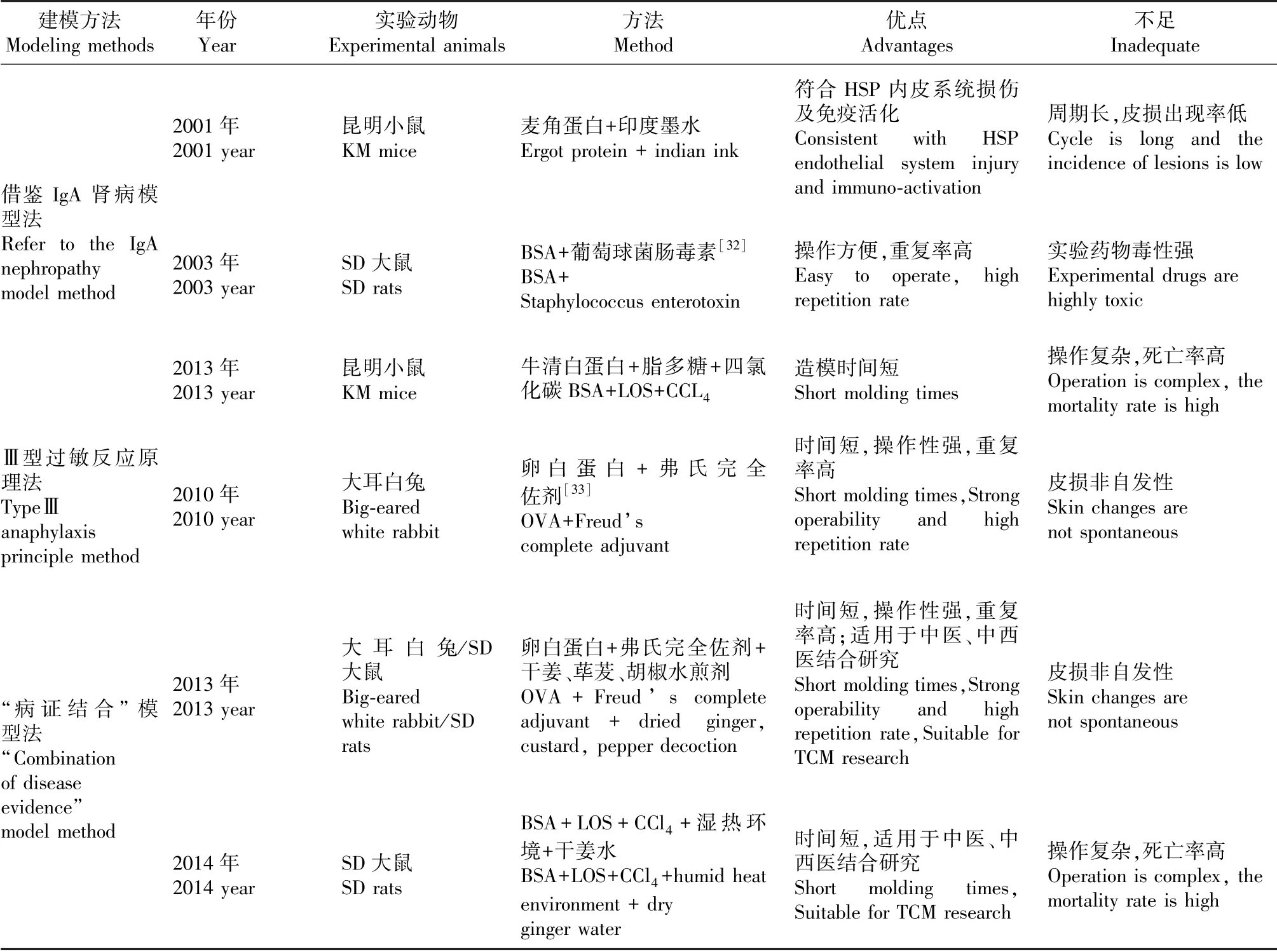
表1 HSP 动物实验模型构建情况归纳表Table 1 Summary table of HSP animal experiment model construction
无论是参照IgA 肾病实验动物模型法,还是依据Ⅲ型超敏反应原理构建法,虽然最终获得了不同程度的皮肤改变及肾损伤,并经历了从单纯复制IgA 肾病病理状态到逐步丰富和发展到遵循HSP 发生发展规律,病症结合的模拟人类HSPN 临床表现及病理特点的过程。 但就目前HSP 动物实验模型的构建而言,仍然存在以下问题:第一,充分参照IgA 肾病模型的造模方法不仅难以实现皮肤紫癜的肾外表现,而且HSPN 和IgA 肾病毕竟存在发病年龄和预后的差异[34],因此该造模法难以完全模拟HSPN 疾病发展变化;第二,采用Ⅲ型超敏反应原理下构建模型,虽然更接近与HSP 的临床及病理特征,但是难以全面解释HSP 的发病机制及免疫损伤机制[35]。
4.2 HSP 动物实验模型的构建思路与展望
结合文献复习,笔者认为HSP 动物实验模型的建立须具备以下两个原则:一是高度的相似性原则,即紫癜性肾炎动物实验模型不能单纯追寻皮肤或肾病理改变的相似性,更应复合其自身发病规律,即不仅仅包含皮肤紫癜,更应侧重于本病发病原因、机体免疫学变化等因素,因此李彦红等[23]依据Ⅲ型超敏反应原理构建的HSP 动物实验模型与临床的契合度更高;二是稳定的可重复性原则,任何经典模型的建立都要经历千万次实验的重复,而基于重复实验的稳定性是我们更好的研究该病的发病机理和研发治疗新药的重要保证。 基于以上问题,笔者认为在目前国内外尚缺乏成熟的HSP 实验动物模型的情况下,对于HSP(尤其是HSPN)的研究,通过细胞培养体外实验交互验证的方式探索HSP 动物实验模型可能是提高HSP 动物实验模型成熟性的方法之一。
任何一种动物模型的构建都是一项艰巨和复杂的工作,它需要伴随着科学技术的发展,不断地探索创新和完善。 HSP 病因复杂,发病机制尚未明确,单纯皮损及肾病理的改变并不能完全反映其发病本质。未来的研究不仅需要更大的动物队列样本进一步阐明病因,更需要集中在相关免疫学指标及细胞因子水平、基因及遗传水平等方面进行深入探讨。

