开心散对双侧海马CA1 区注射Aβ1-42 致AD 大鼠的治疗作用及机制研究
裴海鸾马贝贝王婷婷李瑞吉刘金辉于尚玥娄天宇左泽平田时秋李依林王晨晓田颖颖田 骄赵新月刘 闯郭玉东王 晶*王志斌*
(1.北京中医药大学中药学院,北京 102488;2.北京同仁堂研究院,北京 100071;3.北京市药品检验研究院,北京 102200)
阿尔茨海默病(Alzheimer’s disease,AD)是一种起病隐匿并进行性发展的神经系统退行性疾病,该病多发于65 岁以上的老年人,病者在患病后7~10 年内即不可避免地走向死亡[1-2]。 AD 患者临床表现为长时间的认知功能衰退、情节记忆与身体机能持续恶化、精神行为和睡眠-觉醒周期混乱,伴随明显的语言系统缺陷、情绪波动异常以及严重的生活能力丧失。 AD 典型的病理特征为β-淀粉样蛋白(amyloid beta-protein,Aβ)的积聚与沉积[3]、tau 蛋白过度磷酸化形成的神经原纤维缠结(neurofibrillary tangles,NFTs)[4]、慢性神经炎症[5]以及显著的突触损伤与神经元丢失[6]。 全球现今约有4400 万人罹患AD,随着社会人口老龄化的加剧与AD 病症患者趋于年轻化,预计在2050 年AD病人数量将增至1 亿。 疾病的迅速发展在毁坏个人健康与家庭安定的同时,也为社会工作与全球经济带来沉重负担。
开心散记载于唐代药王孙思邈所著的《备急千金要方·卷十四·小肠腑》中,主治“好忘”,由人参、远志、石菖蒲及茯苓四味中药组成。 开心散复方中人参大补元气,安神益智;远志祛痰开窍,解郁宁心,二者共用可除邪气,养心血,散痰涎,利九窍,补脏腑之精亏,使耳目聪明,强志不忘。 茯苓利水渗湿,健脾宁心;石菖蒲开窍豁痰、化湿、醒神益智,两药配伍可化血积,治痹痛,定心气,去痰阻,理五脏经络之气乱、湿浊,使精神通透,心脑畅明。 由此全方共奏益气养心、补虚、化痰、除湿利窍及安神益智之功,这与AD“脏腑亏损,髓海空虚,瘀血、痰浊阻塞经络脑窍”的病因病机格外契合,因此常被用于临床治疗“善忘”病症。
近年来,国内学者对开心散靶向痴呆的药理学研究愈发关注,但多集中于网络药理学预测[7]、效应物质发掘[8]及单一信号通路如氧化应激[9]、神经炎症[10]、脑内神经再生[11]的验证,关于开心散经典药理活性的多环节考察仍为罕见。 因此,本研究拟采用双侧海马CA1 区注射Aβ1-42造模损伤SD 大鼠为研究对象,并参照AD 发生发展的相关学术论点设立检测因素与靶标,对开心散复方抗痴呆的药理活性进行较为全面地考证与筛查,以期为经典古方的进一步开发及深层次的通路挖掘提供数据支撑。
1 材料和方法
1.1 实验动物
SPF 级体重为(260~300)g 的SD 大鼠,雌雄各半,70 只,由北京维通利华实验动物技术有限公司提供[SCXK(京)2016-0011],动物饲养在北京市药品检验研究院[SYXK(京)2020-0041],本研究由北京市药品检验所实验动物伦理委员会审查通过,并按实验动物使用的3R 原则给予人道的关怀。
1.2 主要试剂与仪器
石杉碱甲片(河南太龙药业股份有限公司,批号:190304);开心散浸膏粉(由上海绿谷生命园医药有限公司提供,批号:190301)。
Aβ1-42(BIOSS, 货 号: bs-0107P); 二 甲 亚 砜(DMSO) (国药集团化学试剂有限公司,批号:20180404);甲苯胺蓝染液(货号:G1032)、苏木精-伊 红 染 液( 货 号: G1003)、 GSK-3β ( 货 号:GB11099)、Tau(货号:GB11178)、β-actin(货号:GB12001)及BAX(货号:GB11690)购自武汉赛维尔生物科技有限公司;BCL-2(Affinity,货号:BF9103)。乙酰胆碱(ACh)试剂盒(货号:CEA912Ge)、乙酰胆碱转移酶(ChAT)试剂盒(货号:SEB929Ra)、乙酰胆碱酯酶(AChE)试剂盒(货号:SEB447Ra)、淀粉样前体蛋白(APP)试剂盒(货号:SEB020Ra)、Aβ1-40酶联免疫吸附试剂盒(货号:CEA864Ra)、Aβ1-42酶联免疫吸附试剂盒(货号:CEA946Ra)、肿瘤坏死因子-α(TNF-α)检测试剂盒(货号:SEA133Ra)、白介素-6(IL-6)检测试剂盒(货号:SEA079Ra)及白介素-1β(IL-1β)检测试剂盒(货号:SEA563Ra)均由武汉云克隆科技股份有限公司提供。
Morris 水迷宫(中国医学科学院药物研究所制,型号:DMS-2);脑立体定位仪(北京众实迪创科技发展有限责任公司,型号:ZS-FD/S);KDS Legato130微量注射泵(美国KD scientific 公司);微型手持式颅钻(深圳市瑞沃德生命科技有限公司,型号:78001);高速组织研磨仪(Servicebio,型号:KZ-Ⅱ);酶标检测仪(BioTeK,型号:Epoch)。
1.3 实验方法
1.3.1 AD 大鼠的模型制备
(1)Aβ1-42寡聚体的孵育
将1 mg 的β-淀粉样蛋白1-42 片段(Aβ1-42)溶于44 μL 的二甲亚砜(DMSO)中,再缓慢加入PBS溶液(456 μL),边加边轻摇混匀,定容到所需浓度(2 μg/μL)。 封口膜封好后,将溶液放入37℃恒温培养箱中孵育7 d,使其聚集老化。
(2)动物术前筛选
将大鼠适应性喂养7 d 后进行筛选,经Morris水迷宫实验判别其空间学习记忆能力,淘汰游泳行为过于迟钝的大鼠,将筛选出的正常大鼠随机分为3 组:空白组10 只,假手术组10 只,其余归入造模组。
(3)手术过程
大鼠麻醉后,将其置于脑立体定位仪上进行固定;定位手术区,局部备皮,酒精消毒;剪开大鼠头部皮肤,切口沿中线分布,长度约15 mm,将颅骨表面粘膜拨开固定,使颅骨充分暴露;参照《大鼠脑立体定位图谱》[12],确定前囟位点并标记,钻孔位点定位于前囟后方3.6 mm,旁开2 mm,以1.0 mm 钻头钻孔;注射点定位于大鼠海马CA1 区,即自钻孔位垂直颅骨表面向内进针约4.3 mm;恒速垂直注射,双侧各注射Aβ1-42寡聚体5 μL,以1 μL/min 的速度持续注射5 min,注射后留针5 min,再缓慢撤针,以确保溶液充分弥散;操作结束后,用牙科水泥封闭钻孔,以青霉素粉涂于切口处以防感染,随后缝合切口,碘伏擦拭消毒;将大鼠置于电热毯上等候苏醒,使其平稳度过术后虚弱期。 假手术组大鼠参照上述操作注射等量的生理盐水。 术后恢复3~7 d。
(4)痴呆大鼠判别
用Morris 水迷宫定位航行实验测试其逃避潜伏期,以空白组大鼠4 次训练的平均逃避潜伏期(学习成绩)作为参考值(所有空白大鼠学习成绩的平均值记为A),并计算出同1 d 内每只造模大鼠的平均逃避潜伏期(记为B),若(B-A)/B>20%则判定造模成功,归为痴呆大鼠。
1.3.2 分组及给药
将50 只判定造模成功的痴呆大鼠按逃避潜伏期随机分为5 组:模型组、石杉碱甲组(0.046 mg/kg)、开心散低剂量组(11.48 mg/kg)、开心散中剂量组(22.96 mg/kg)与开心散高剂量组(45.92 mg/kg),每组10 只。 连续灌胃给药30 d,每日1 次。 空白组、假手术组与模型组给予等量的纯化水。
1.3.3 Morris 水迷宫行为学测试
(1)定位航行试验
试验共历时5 d,每天定于固定时间段,每个时间段训练4 次。 4 次训练即将动物分别从4 个不同的起始点(不同象限)放入水中。 动物找到平台后或120 s 内找不到平台(潜伏期记为120 s),则由实验者将其拿上平台,在平台上休息15 s,再进行下一次试验。 每日以动物4 次训练测得逃避潜伏期的平均值作为动物当日的学习成绩。 前2 d 的定位航行试验作为适应性游泳训练以熟悉迷宫环境,统计动物在第3、4、5 天的学习成绩变化。
(2)空间探索试验
第6 天撤除原平台,将动物任选1 个入水点放入水中,所有动物必须为同一入水点,记录动物在2 min 内跨越原平台的次数、在目标象限的停留时间、目标象限的游泳路程及游泳总路程,计算得出目标象限游泳路程所占总路程的百分比(目标象限游泳路程/游泳总路程)。
1.3.4 标本采集
Morris 行为学测试结束后,每组随机选取4 只大鼠,低温环境下快速断头取脑,置于冰砖上矢状切割脑组织,左侧半脑组织用4%的多聚甲醛溶液固定,4℃保存,用于病理染色及免疫组化分析;右侧半脑低温下进行海马和皮层的分离,并将海马、皮层分别用锡箔纸包裹,置于冻存管,-80℃保存,备用于Western blot 检测;剩余的各组大鼠在低温环境下快速断头取脑,以冷生理盐水清洗去除残血,滤纸吸干后用锡箔纸包裹,-80℃冻存,以供ELISA检测。
1.3.5 HE 染色与Nissl 染色
采用HE 染色及Nissl 染色法观察各组大鼠脑组织的病理形态与损伤状况,在400 倍成像下查看皮层、海马组织各区域神经元的数量、结构与排列,并分析尼氏小体的数目与着色深浅,截图采集图像。
1.3.6 酶联免疫吸附法(ELISA)
样本处理:准确称取待测脑组织重量,按重量(g):体积(mL)= 1 ∶9 的比例加入9 倍体积0.9%的生理盐水,并放入匀浆珠,冰水浴条件机械匀浆,制成10%的脑组织匀浆,低温(4℃)离心10 min(3500 r/min),分离上清液备检。
检测指标:胆碱能神经递质(ACh、ChAT 及AChE)、炎症因子(TNF-α、IL-6 及IL-1β)及β-淀粉样蛋白(APP、Aβ1-40及Aβ1-42)。
1.3.7 免疫组化染色分析(IHC)
采用IHC 法检测大脑组织中tau 蛋白、GSK-3β的表达水平:在400 倍成像下分别截取海马及皮层区域内互不重叠的3 个视野,分别测量每张切片中海马及皮层区域各3 个视野阳性表达的积分光密度(integrated optical density,IOD)值,IOD 值越高,代表阳性表达越强。
1.3.8 蛋白免疫印迹法(Western blot)
使用Western blot 法测定皮层、海马组织中BAX、BCL-2 的表达程度:分析目标条带的光密度值,将目的条带灰度值/内参条带灰度值的比值作为目标蛋白的相对表达量。
1.4 统计学方法
所有数据均采用SAS 8.2 软件进行处理,各组数列均呈正态分布时,数据以平均数±标准差(±s)表示,采用ANOVA 进行单因素方差分析,同时用LSD-t检验法进行组间的多重比较,P<0.05 表示差异具有统计学意义。
2 结果
2.1 开心散对AD 大鼠学习记忆能力的影响
2.1.1 开心散对AD 大鼠逃避潜伏期的影响
定位航行实验结果显示,与空白组或假手术组相比,模型组大鼠在第3、4、5 天的逃避潜伏期明显延长,差异有统计学意义(P<0.05)。 相较于模型组,在第3 天,开心散低、中、高剂量组逃避潜伏期明显下降(P<0.05 或P<0.01);第4 天,石杉碱甲组、开心散低、中剂量组逃避潜伏期显著缩短(P<0.05 或P<0.01);第5 天,石杉碱甲组、开心散中剂量组逃避潜伏期明显缩短(P<0.05)(结果见表1、图1)。
表1 开心散对AD 大鼠逃避潜伏期的影响(±s)Table 1 Effect of Kaixin San on escape latency in AD rats
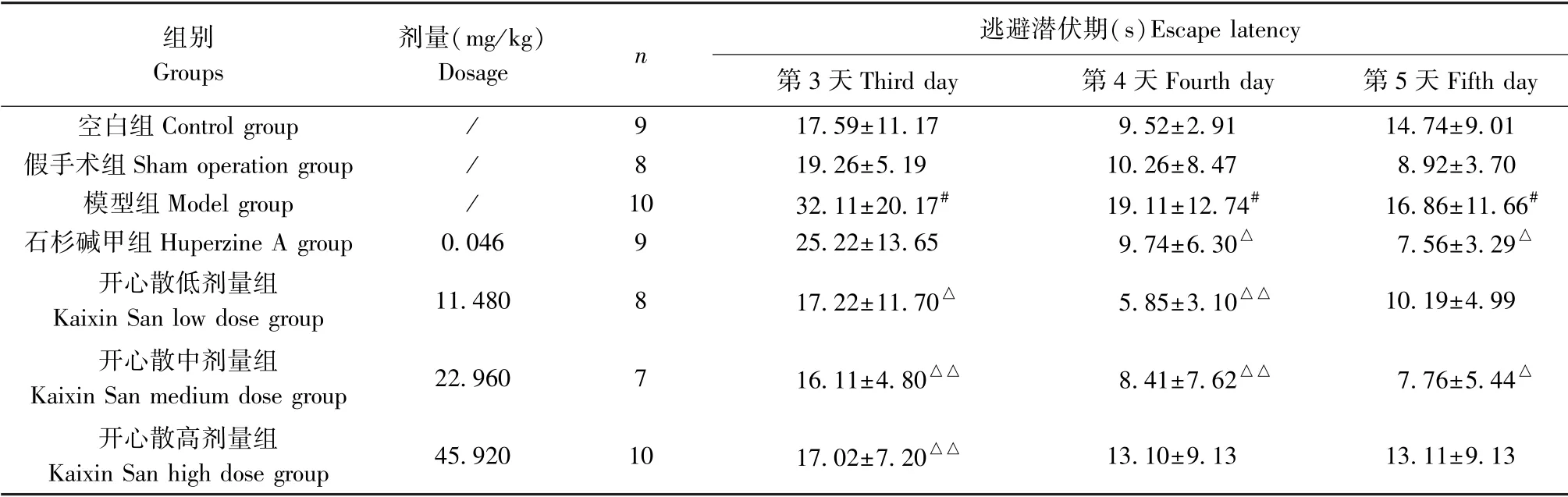
表1 开心散对AD 大鼠逃避潜伏期的影响(±s)Table 1 Effect of Kaixin San on escape latency in AD rats
注:与空白组或假手术组相比,#P<0.05;与模型组相比,△P<0.05,△△P<0.01。Note. Compared with the control group or sham operation group,#P<0.05. Compared with the model group,△P<0.05,△△P<0.01.
组别Groups剂量(mg/kg)Dosage n逃避潜伏期(s)Escape latency第3 天Third day 第4 天Fourth day 第5 天Fifth day空白组Control group / 9 17.59±11.17 9.52±2.91 14.74±9.01假手术组Sham operation group / 8 19.26±5.19 10.26±8.47 8.92±3.70模型组Model group / 10 32.11±20.17# 19.11±12.74# 16.86±11.66#石杉碱甲组Huperzine A group 0.046 9 25.22±13.65 9.74±6.30△ 7.56±3.29△开心散低剂量组Kaixin San low dose group 11.480 8 17.22±11.70△ 5.85±3.10△△ 10.19±4.99开心散中剂量组Kaixin San medium dose group 22.960 7 16.11±4.80△△ 8.41±7.62△△ 7.76±5.44△开心散高剂量组Kaixin San high dose group 45.920 10 17.02±7.20△△ 13.10±9.13 13.11±9.13

图1 开心散对AD 大鼠逃避潜伏期的影响Note. Compared with the control group or sham operation group,# P< 0.05. Compared with the model group,△P < 0.05,△△P<0.01.Figure 1 Effect of Kaixin San on escape latency in AD rats
2.1.2 开心散对AD 大鼠空间探索能力的影响
与空白组或假手术组相比,模型组穿越平台次数、目标象限停留时间及游泳路程所占百分比均明显减少,差异有统计学意义(P<0.05);相较于模型组,开心散中、高剂量组的穿越平台次数增加(P<0.05);开心散低、高剂量组的目标象限停留时间与游泳路程所占百分比均明显提升(P<0.05 或P<0.01)(结果见表2、图2)。
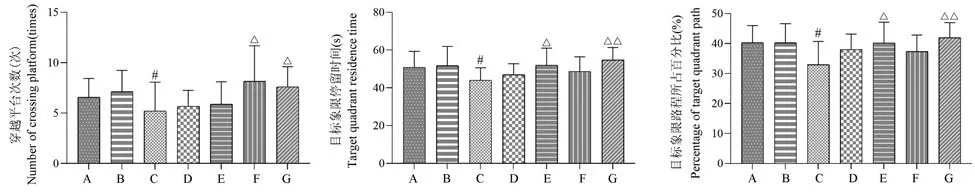
图2 开心散对AD 大鼠空间探索能力的影响Note. A, Control group. B, Sham operation group. C, Model group. D, Huperzine A group. E, Kaixin San low dose group. F, Kaixin San medium dose group. G, Kaixin San high dose group. Compared with the control group or sham operation group,#P<0.05. Compared with the model group,△P<0.05,△△P<0.01.Figure 2 Effect of Kaixin San on spatial exploration ability of AD rats
表2 开心散对AD 大鼠空间探索能力的影响(±s)Table 2 Effect of Kaixin San on spatial exploration ability of AD rats
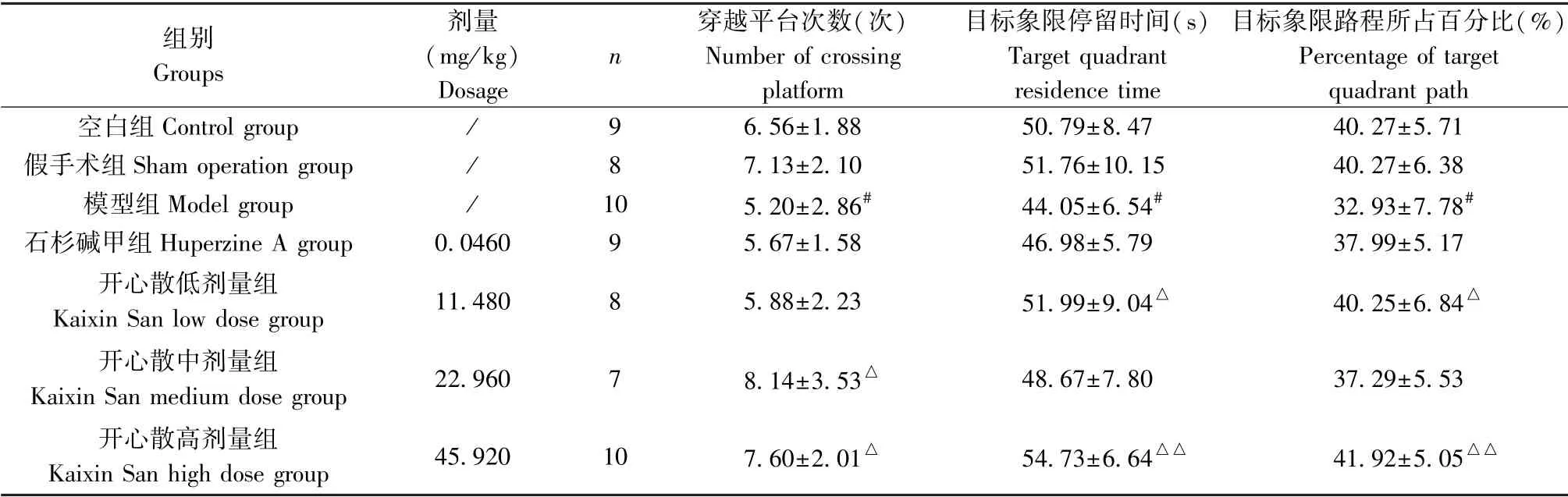
表2 开心散对AD 大鼠空间探索能力的影响(±s)Table 2 Effect of Kaixin San on spatial exploration ability of AD rats
注:与空白组或假手术组相比,#P<0.05;与模型组相比,△P<0.05,△△P<0.01。Note. Compared with the control group or sham operation group, #P<0.05. Compared with the model group,△P<0.05,△△P<0.01.
组别Groups剂量(mg/kg)Dosage n穿越平台次数(次)Number of crossing platform目标象限停留时间(s)Target quadrant residence time目标象限路程所占百分比(%)Percentage of target quadrant path空白组Control group / 9 6.56±1.88 50.79±8.47 40.27±5.71假手术组Sham operation group / 8 7.13±2.10 51.76±10.15 40.27±6.38模型组Model group / 10 5.20±2.86# 44.05±6.54# 32.93±7.78#石杉碱甲组Huperzine A group 0.0460 9 5.67±1.58 46.98±5.79 37.99±5.17开心散低剂量组Kaixin San low dose group 11.480 8 5.88±2.23 51.99±9.04△ 40.25±6.84△开心散中剂量组Kaixin San medium dose group 22.960 7 8.14±3.53△ 48.67±7.80 37.29±5.53开心散高剂量组Kaixin San high dose group 45.920 10 7.60±2.01△ 54.73±6.64△△ 41.92±5.05△△
2.2 开心散对AD 大鼠脑组织病理形态的影响
2.2.1 HE 染色
HE 染色结果显示,空白组、假手术组大鼠皮层神经元边界清晰,形态规则;海马组织神经元数量丰富、排列紧密,形态结构正常。 与空白组相比,模型组皮层、海马组织均可见神经元皱缩,皮质细胞数量明显减少,细胞间隙增大;海马组织细胞排列散乱无序,细胞层数减少,形态不规则,甚至出现核仁消失。 相较于模型组,各给药组脑组织病理形态有不同程度的改善,皮层神经元数量增多,皱缩状态缓解;海马区域细胞排列较整齐,细胞层数增加,形态结构趋于正常(结果见图3)。
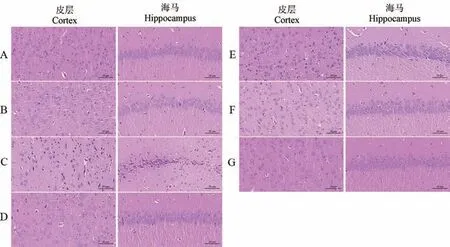
图3 开心散对AD 大鼠脑组织病理形态的影响(HE 染色)Note. A, Control group. B, Sham operation group. C, Model group. D, Huperzine A group. E, Kaixin San low dose group. F, Kaixin San medium dose group. G, Kaixin San high dose group.Figure 3 Effect of Kaixin San on pathological morphology of brain tissue in AD rats (HE staining)
2.2.2 Nissl 染色
Nissl 染色结果显示,空白组、假手术组大鼠皮层及海马组织神经元排列整齐、均匀,细胞结构完整;尼氏小体数量丰富,形态正常,尼氏物质呈深蓝色颗粒或斑块状染色。 与空白组相比,模型组皮层、海马中尼氏小体数量明显减少,染色变浅,神经元排列散乱且间隙明显增大。 相较于模型组,各给药组脑组织病理状况有不同程度的改善,其皮层及海马组织中尼氏小体数量增加,且海马CA1 区细胞排列紧密整齐,胞浆着色变深(结果见图4)。

图4 开心散对AD 大鼠脑组织病理形态的影响(Nissl 染色)Note. A, Control group. B, Sham operation group. C, Model group. D, Huperzine A group. E, Kaixin San low dose group. F, Kaixin San medium dose group. G, Kaixin San high dose group.Figure 4 Effect of Kaixin San on pathological morphology of brain tissue in AD rats (Nissl staining)
2.3 开心散对AD 大鼠脑组织中胆碱能神经递质的影响
与空白组或假手术组相比,模型组大鼠脑组织中ChAT 的活性及ACh 的含量均明显降低,AChE的活性升高,差异有统计学意义(P<0.05 或P<0.01)。 相较于模型组,开心散低、高剂量组ACh 的含量明显增加(P<0.05 或P<0.01);石杉碱甲组、开心散低、中剂量组ChAT 的活性增强,且AChE 的活性显著降低(P<0.05 或P<0.01)(结果见表3、图5)。
表3 开心散对AD 大鼠胆碱能神经递质的影响(±s,n=6)Table 3 Effect of Kaixin San on cholinergic neurotransmitter in AD rats
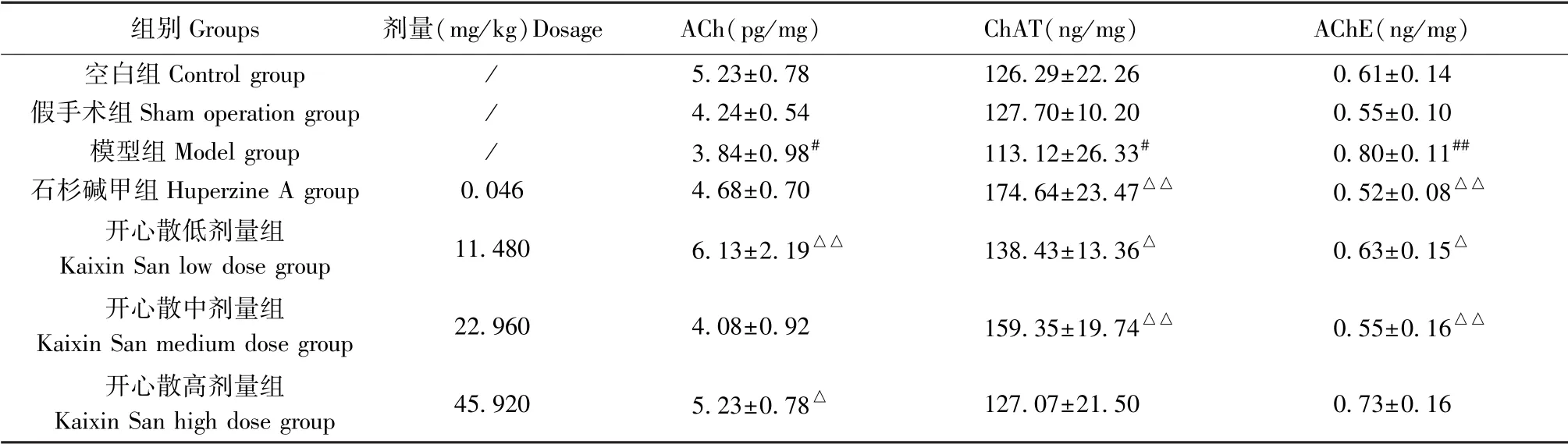
表3 开心散对AD 大鼠胆碱能神经递质的影响(±s,n=6)Table 3 Effect of Kaixin San on cholinergic neurotransmitter in AD rats
注:与空白组或假手术组相比,#P<0.05,##P<0.01;与模型组相比,△P<0.05,△△P<0.01。Note. Compared with the control group or sham operation group,#P<0.05,##P<0.01. Compared with the model group,△P<0.05,△△P<0.01.
组别Groups 剂量(mg/kg)Dosage ACh(pg/mg) ChAT(ng/mg) AChE(ng/mg)空白组Control group / 5.23±0.78 126.29±22.26 0.61±0.14假手术组Sham operation group / 4.24±0.54 127.70±10.20 0.55±0.10模型组Model group / 3.84±0.98# 113.12±26.33# 0.80±0.11##石杉碱甲组Huperzine A group 0.046 4.68±0.70 174.64±23.47△△ 0.52±0.08△△开心散低剂量组Kaixin San low dose group 11.480 6.13±2.19△△ 138.43±13.36△ 0.63±0.15△开心散中剂量组Kaixin San medium dose group 22.960 4.08±0.92 159.35±19.74△△ 0.55±0.16△△开心散高剂量组Kaixin San high dose group 45.920 5.23±0.78△ 127.07±21.50 0.73±0.16
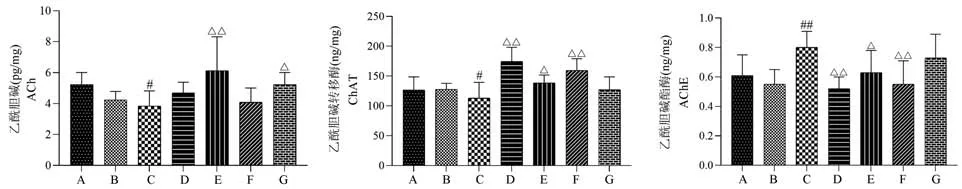
图5 开心散对AD 大鼠胆碱能神经递质的影响Note. A, Control group. B, Sham operation group. C, Model group. D, Huperzine A group. E, Kaixin San low dose group. F, Kaixin San medium dose group. G, Kaixin San high dose group. Compared with the control group or sham operation group,#P<0.05,##P<0.01.Compared with the model group,△P<0.05,△△P<0.01.Figure 5 Effect of Kaixin San on cholinergic neurotransmitter in AD rats
2.4 开心散对AD 大鼠脑组织中炎症因子的影响
与空白组或假手术组相比,模型组大鼠脑组织中TNF-α、IL-1β 及IL-6 等炎症因子的含量明显升高,差异有统计学意义(P<0.01)。 相较于模型组,石杉碱甲组、开心散低剂量组TNF-α 的含量明显下降(P<0.05);石杉碱甲组、开心散低、中剂量组IL-1β 与IL-6 的含量显著降低(P<0.05 或P<0.01)。(结果见表4、图6)
表4 开心散对AD 大鼠脑组织炎症因子的影响(±s,n=6)Table 4 Effect of Kaixin San on inflammatory factors in brain tissue of AD rats

表4 开心散对AD 大鼠脑组织炎症因子的影响(±s,n=6)Table 4 Effect of Kaixin San on inflammatory factors in brain tissue of AD rats
注:与空白组或假手术组相比,##P<0.01;与模型组相比,△P<0.05,△△P<0.01。Note. Compared with the control group or sham operation group,##P<0.01. Compared with the model group,△P<0.05,△△P<0.01.
组别Groups 剂量(mg/kg)Dosage TNF-α(pg/mg) IL-1β(pg/mg) IL-6(pg/mg)空白组Control group / 8.58±2.76 8.62±1.35 7.32±1.46假手术组Sham operation group / 8.38±1.53 8.24±0.86 6.32±0.58模型组Model group / 13.30±2.19## 11.51±1.26## 10.03±1.62##石杉碱甲组Huperzine A group 0.046 9.46±2.63△ 7.99±1.69△△ 7.60±1.66△开心散低剂量组Kaixin San low dose group 11.480 9.52±3.37△ 9.24±1.57△ 7.23±2.00△开心散中剂量组Kaixin San medium dose group 22.960 13.24±2.44 8.50±2.54△△ 6.81±2.49△△开心散高剂量组Kaixin San high dose group 45.920 10.22±3.10 10.63±1.75 8.35±2.31

图6 开心散对AD 大鼠脑组织炎症因子的影响Note. A, Control group. B, Sham operation group. C, Model group. D, Huperzine A group. E, Kaixin San low dose group. F, Kaixin San medium dose group. G, Kaixin San high dose group. Compared with the control group or sham operation group,##P<0.01. Compared with the model group,△P<0.05,△△P<0.01.Figure 6 Effect of Kaixin San on inflammatory factors in brain tissue of AD rats
2.5 开心散对AD 大鼠脑组织中β-淀粉样蛋白含量的影响
与空白组或假手术组相比,模型组大鼠脑组织中APP、Aβ1-40及Aβ1-42的含量明显升高,差异有统计学意义(P<0.05 或P<0.01);相较于模型组,石杉碱甲组、开心散低、高剂量组APP 的含量显著下降(P<0.01);开心散中剂量组Aβ1-40的含量降低(P<0.05);石杉碱甲组、开心散中、高剂量组Aβ1-42的含量均明显减少(P<0.05 或P<0.01)(结果见表5、图7)。
表5 开心散对AD 大鼠脑组织中β-淀粉样蛋白含量的影响(±s,n=6)Table 5 Effect of Kaixin San on β-amyloid protein content in brain tissue of AD rats
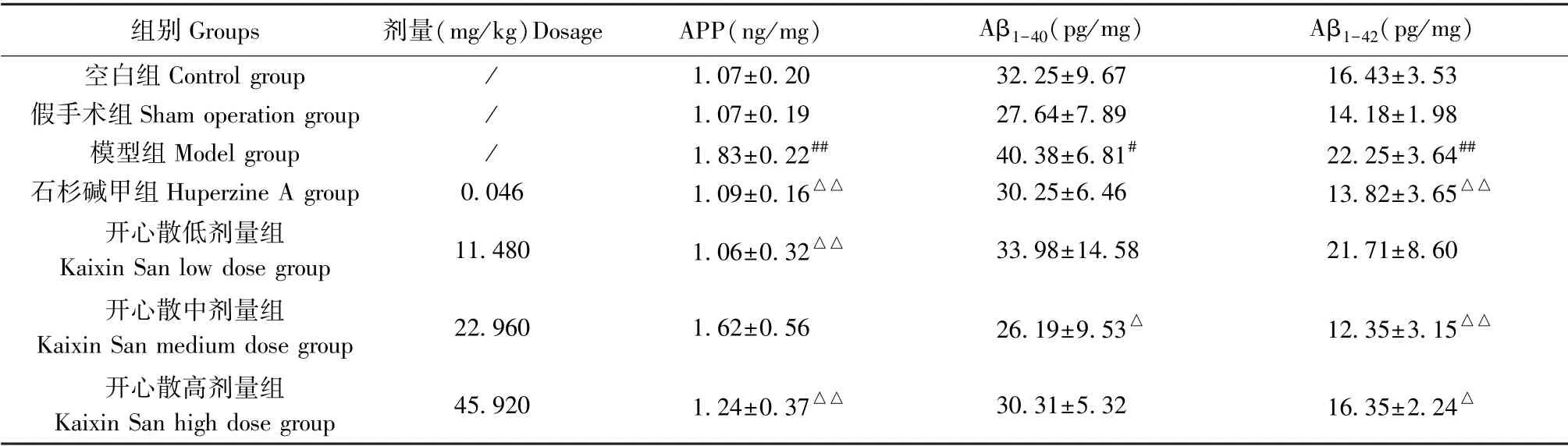
表5 开心散对AD 大鼠脑组织中β-淀粉样蛋白含量的影响(±s,n=6)Table 5 Effect of Kaixin San on β-amyloid protein content in brain tissue of AD rats
注:与空白组或假手术组相比,#P<0.05,##P<0.01;与模型组相比,△P<0.05,△△P<0.01。Note. Compared with the control group or sham operation group,#P<0.05,##P<0.01. Compared with the model group,△P<0.05,△△P<0.01.
组别Groups 剂量(mg/kg)Dosage APP(ng/mg) Aβ1-40(pg/mg) Aβ1-42(pg/mg)空白组Control group / 1.07±0.20 32.25±9.67 16.43±3.53假手术组Sham operation group / 1.07±0.19 27.64±7.89 14.18±1.98模型组Model group / 1.83±0.22## 40.38±6.81# 22.25±3.64##石杉碱甲组Huperzine A group 0.046 1.09±0.16△△ 30.25±6.46 13.82±3.65△△开心散低剂量组Kaixin San low dose group 11.480 1.06±0.32△△ 33.98±14.58 21.71±8.60开心散中剂量组Kaixin San medium dose group 22.960 1.62±0.56 26.19±9.53△ 12.35±3.15△△开心散高剂量组Kaixin San high dose group 45.920 1.24±0.37△△ 30.31±5.32 16.35±2.24△
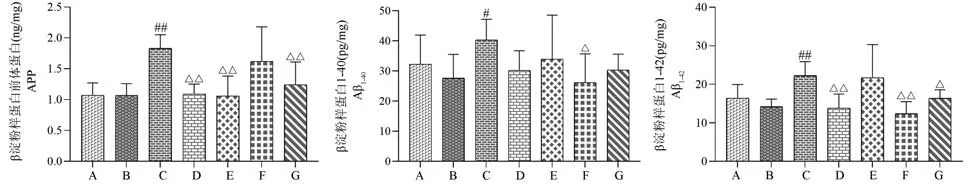
图7 开心散对AD 大鼠脑组织中β-淀粉样蛋白含量的影响Note. A, Control group. B, Sham operation group. C, Model group. D, Huperzine A group. E, Kaixin San low dose group. F, Kaixin San medium dose group. G, Kaixin San high dose group. Compared with the control group or sham operation group,#P<0.05,##P<0.01. Compared with the model group,△P<0.05,△△P<0.01.Figure 7 Effect of Kaixin San on β-amyloid protein content in brain tissue of AD rats
2.6 开心散对AD 大鼠脑组织中tau 蛋白磷酸化的影响
2.6.1 开心散对AD 大鼠皮层、海马组织中tau 蛋白表达水平的影响
与空白组或假手术组相比,模型组大鼠皮层、海马组织中tau 蛋白棕黄色阳性表达产物明显增多,差异有统计学意义(P<0.05 或P<0.01);相较于模型组,开心散中剂量组皮层组织中tau 蛋白的阳性表达量显著下降(P<0.05);石杉碱甲组、开心散低剂量组海马组织中tau 蛋白的表达水平均有下调(P<0.05)(结果见表6、图8、图9)。
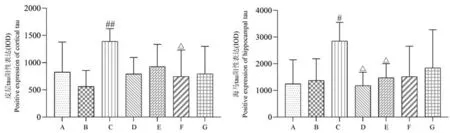
图8 开心散对AD 大鼠脑组织中tau 蛋白表达水平的影响Note. A, Control group. B, Sham operation group. C, Model group. D, Huperzine A group. E, Kaixin San low dose group. F, Kaixin San medium dose group. G, Kaixin San high dose group. Compared with the control group or sham operation group,#P<0.05,##P<0.01. Compared with the model group,△P<0.05.Figure 8 Effect of Kaixin San on the expression of tau in brain tissue of AD rats

图9 开心散对AD 大鼠脑组织中tau 蛋白表达水平的影响Note. A, Control group. B, Sham operation group. C, Model group. D, Huperzine A group. E, Kaixin San low dose group. F, Kaixin San medium dose group. G, Kaixin San high dose group.Figure 9 Effect of Kaixin San on the expression of tau in brain bissue of AD rats
表6 开心散对AD 大鼠脑组织中tau 蛋白表达水平的影响(±s,n=4)Table 6 Effect of Kaixin San on the expression of tau in brain tissue of AD rats
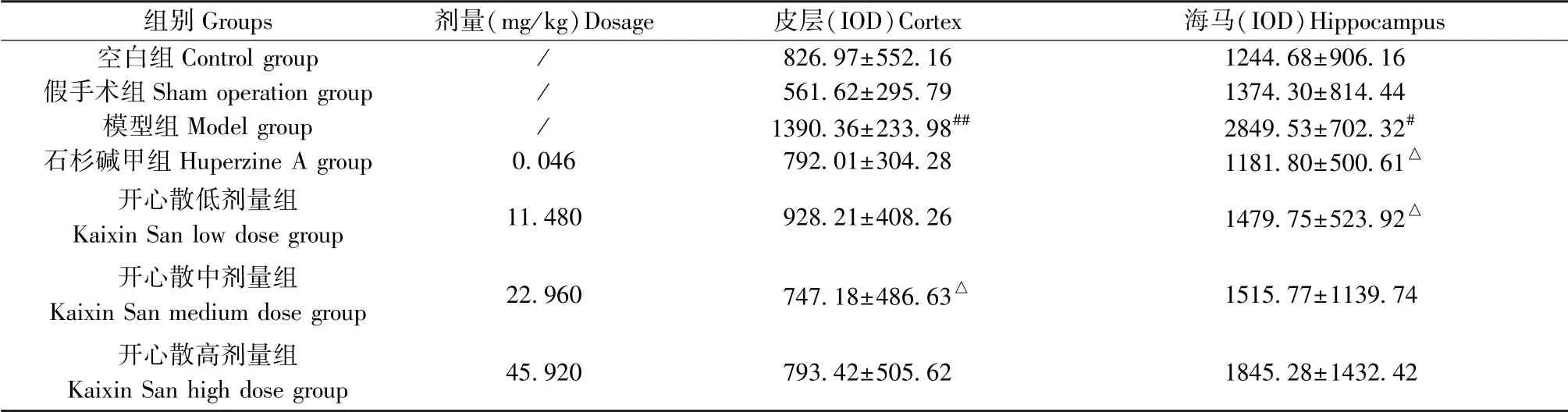
表6 开心散对AD 大鼠脑组织中tau 蛋白表达水平的影响(±s,n=4)Table 6 Effect of Kaixin San on the expression of tau in brain tissue of AD rats
注:与空白组或假手术组相比,#P<0.05,##P<0.01;与模型组相比,△P<0.05。Note. Compared with the control group or sham operation group,#P<0.05,##P<0.01. Compared with the model group,△P<0.05.
组别Groups 剂量(mg/kg)Dosage 皮层(IOD)Cortex 海马(IOD)Hippocampus空白组Control group / 826.97±552.16 1244.68±906.16假手术组Sham operation group / 561.62±295.79 1374.30±814.44模型组Model group / 1390.36±233.98## 2849.53±702.32#石杉碱甲组Huperzine A group 0.046 792.01±304.28 1181.80±500.61△开心散低剂量组Kaixin San low dose group 11.480 928.21±408.26 1479.75±523.92△开心散中剂量组Kaixin San medium dose group 22.960 747.18±486.63△ 1515.77±1139.74开心散高剂量组Kaixin San high dose group 45.920 793.42±505.62 1845.28±1432.42
2.6.2 开心散对AD 大鼠皮层、海马组织中GSK-3β 表达水平的影响
与空白组或假手术组相比,模型组大鼠皮层、海马组织中GSK-3β 棕黄色免疫阳性产物明显增多,差异有统计学意义(P<0.05);相较于模型组,石杉碱甲组、开心散高剂量组皮层组织中GSK-3β 阳性表达量显著降低(P<0.05 或P<0.01);石杉碱甲组、开心散低、中、高剂量组海马组织中GSK-3β 表达水平均下降(P<0.05 或P<0.01)。 (结果见表7、图10、图11)
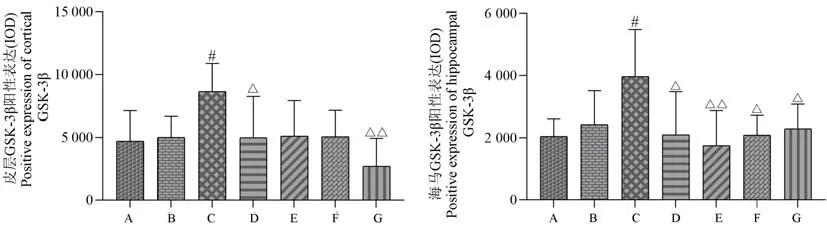
图10 开心散对AD 大鼠脑组织中GSK-3β 表达水平的影响Note. A, Control group. B, Sham operation group. C, Model group. D, Huperzine A group. E, Kaixin San low dose group. F, Kaixin San medium dose group. G, Kaixin San medium dose group. Compared with the control group or sham operation group,#P<0.05. Compared with the model group,△P<0.05,△△P<0.01.Figure 10 Effect of Kaixin San on GSK-3β expression in brain tissue of AD rats
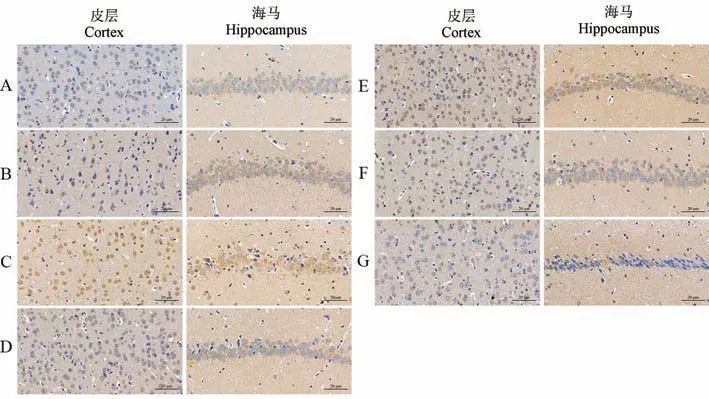
图11 开心散对AD 大鼠脑组织中GSK-3β 表达水平的影响Note. A, Control group. B, Shamoperation group. C, Model group. D, Huperzine A group. E, Kaixin San low dose group. F, Kaixin San medium dose group. G, Kaixin San high dose group.Figure 11 Effect of Kaixin San on GSK-3β expression in brain tissue of AD rats
表7 开心散对AD 大鼠脑组织中GSK-3β 表达水平的影响(±s,n=4)Table 7 Effect of Kaixin San on GSK-3β expression in brain tissue of AD rats
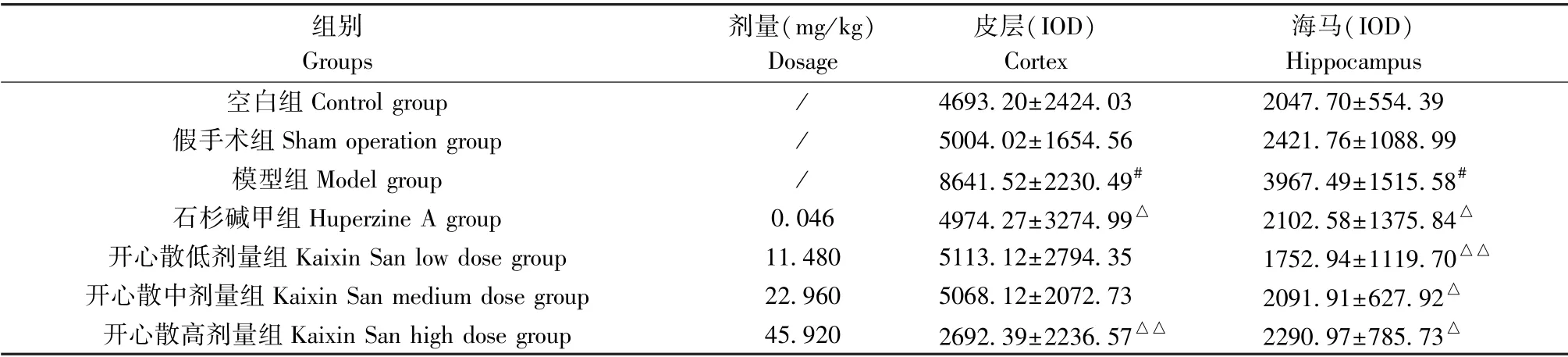
表7 开心散对AD 大鼠脑组织中GSK-3β 表达水平的影响(±s,n=4)Table 7 Effect of Kaixin San on GSK-3β expression in brain tissue of AD rats
注:与空白组或假手术组相比,#P<0.05;与模型组相比,△P<0.05,△△P<0.01。Note. Compared with the control group or sham operation group,#P<0.05. Compared with the model group,△P<0.05,△△P<0.01.
组别Groups剂量(mg/kg)Dosage皮层(IOD)Cortex海马(IOD)Hippocampus空白组Control group / 4693.20±2424.03 2047.70±554.39假手术组Sham operation group / 5004.02±1654.56 2421.76±1088.99模型组Model group / 8641.52±2230.49# 3967.49±1515.58#石杉碱甲组Huperzine A group 0.046 4974.27±3274.99△ 2102.58±1375.84△开心散低剂量组Kaixin San low dose group 11.480 5113.12±2794.35 1752.94±1119.70△△开心散中剂量组Kaixin San medium dose group 22.960 5068.12±2072.73 2091.91±627.92△开心散高剂量组Kaixin San high dose group 45.920 2692.39±2236.57△△ 2290.97±785.73△
2.7 开心散对AD 大鼠脑组织中BCL-2 与BAX表达水平的影响
与空白组或假手术组相比,模型组大鼠脑组织中BAX 蛋白的相对表达量升高,且BCL-2/BAX 的比值下降,但差异无统计学意义(P>0.05)。 相较于模型组,各给药组脑组织中BAX 蛋白的表达水平趋于下调(P>0.05),且BCL-2/BAX 的比值有不同程度的升高趋势(P>0.05)(结果见表8、图12、图13)。
图12 开心散对AD 大鼠脑组织中BCL-2 及BAX 表达水平的影响Note. A, Control group. B, Sham operation group. C, Model group. D, Huperzine A group. E, Kaixin San low dose group. F, Kaixin San medium dose group. G, Kaixin San high dose group.Figure 12 Effect of Kaixin San on expression of BCL-2 and BAX in brain tissue of AD rats

图13 开心散对AD 大鼠脑组织中BCL-2 及BAX 表达水平的影响Note. A, Control group. B, Sham operation group. C, Model group. D, Huperzine A group. E, Kaixin San low dose group.F, Kaixin San medium dose group. G, Kaixin San high dose group.Figure 13 Effect of Kaixin San on expression of BCL-2 and BAX in brain tissue of AD rats
表8 开心散对AD 大鼠脑组织中BCL-2 及BAX 表达水平的影响(±s,n=4)Table 8 Effect of Kaixin San on expression of BCL-2 and BAX in brain tissue of AD rats
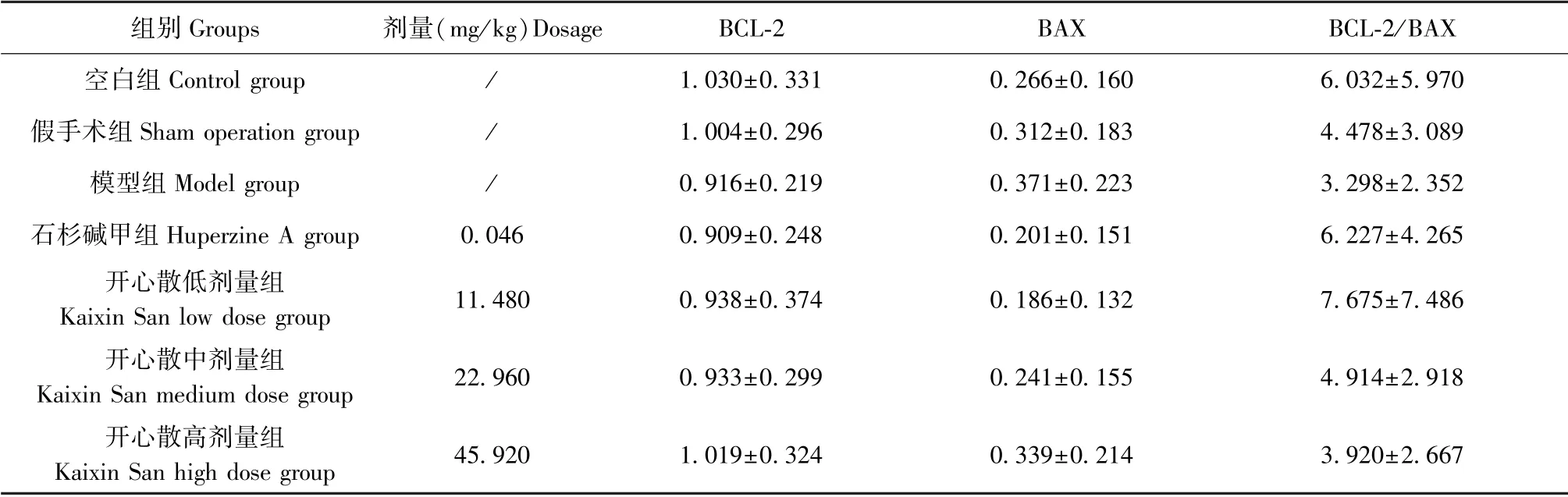
表8 开心散对AD 大鼠脑组织中BCL-2 及BAX 表达水平的影响(±s,n=4)Table 8 Effect of Kaixin San on expression of BCL-2 and BAX in brain tissue of AD rats
组别Groups 剂量(mg/kg)Dosage BCL-2 BAX BCL-2/BAX空白组Control group / 1.030±0.331 0.266±0.160 6.032±5.970假手术组Sham operation group / 1.004±0.296 0.312±0.183 4.478±3.089模型组Model group / 0.916±0.219 0.371±0.223 3.298±2.352石杉碱甲组Huperzine A group 0.046 0.909±0.248 0.201±0.151 6.227±4.265开心散低剂量组Kaixin San low dose group 11.480 0.938±0.374 0.186±0.132 7.675±7.486开心散中剂量组Kaixin San medium dose group 22.960 0.933±0.299 0.241±0.155 4.914±2.918开心散高剂量组Kaixin San high dose group 45.920 1.019±0.324 0.339±0.214 3.920±2.667
3 讨论
Morris 水迷宫作为现今应用最广泛的考察啮齿类动物空间学习与长期记忆的行为学测试[13],提供了一套评估不同认知域功能的灵活方式,其中最广为人知的隐藏平台训练(定位航行)和空间探索检验可有效评测鼠类的空间记忆与记忆保持能力[14]。本研究中,经开心散治疗后,Aβ1-42造模后的大鼠水迷宫各项目的测试成绩有较明显提升,说明开心散可在一定程度上改善机体的认知导航能力。
AD 作为一类中枢神经系统渐进性衰退病症,从起病、发展到恶化、死亡的整个过程均涉及到特有的病理生理学改变,HE 染色与Nissl 染色可通过简单的染料组合揭示细胞细节与超微结构分布,借此可推断神经元的功能状态与畸变信息[15]。 病理形态观察证实,相较于模型组,给药组大鼠皮层、海马组织病理状况有所改善,神经元数量增多,尼氏小体数目增加,形态结构趋于正常,表明开心散可缓解AD 动物的脑组织损伤,恢复神经元的生理功能。
ACh 参与大脑信息处理的神经传导,与人体的记忆行为及学习认知功能密切相关。 AD 的病变伴随着脑内ACh 的“合成-传递-摄取”链失衡、ChAT与AChE 的活性失常,胆碱能神经系统出现明显缺陷,进而导致机体学习记忆功能障碍[16]。 ELISA 检测证明,经开心散干预的AD 大鼠脑组织中AChE活性降低,ChAT 与ACh 的含量上升,进一步揭示了开心散对胆碱能神经传递的靶向作用,间接维持ACh 合成、降解过程的动态平衡。
慢性免疫炎症反应是AD 发生并且逐渐恶化的关键诱因[17-19],随着机体年龄的增长和Aβ 的持续生成与集聚,小胶质细胞(MG)与星形胶质细胞(AS)在长期慢性活化过程中被过度激活,导致炎性细胞因子如IL-1β、IL-6、TNF-α 的大量生成与释放,脑组织局部炎症反应加重,神经元受损、变性甚至死亡[20]。 研究过程中观察到,AD 大鼠经开心散治疗后,脑组织中的炎症因子含量均下降,证明开心散可抑制促炎因子的过度释放,由此减轻脑内炎症微环境的毒性效应。
Aβ 是由淀粉样前体蛋白(APP)水解生成的正常代谢物,在β-分泌酶和γ-分泌酶的剪辑切割下,APP 可降解为以Aβ1-40和Aβ1-42为代表的Aβ 肽段[21]。 在健康机体内,Aβ 的产生与降解可保持动态平衡;然而当机体发生衰老、受到物理或化学损伤时,会导致“Aβ-APP”代谢链失常,Aβ 因此聚积沉淀形成弥漫性的神经炎斑[22]。 经给药治疗后的AD 鼠脑内Aβ 相关蛋白含量均有降低,表明开心散可减少Aβ 的异常蓄积,使其生成与清除状态趋于平衡。
Tau 蛋白是一类与微管相关的组分,可与微管结合促进其稳定并组装成束,协助神经细胞间的物质转运[23]。 由于机体的衰老和致病因素的入侵,蛋白激酶如GSK-3β 活性的失衡,促使tau 蛋白的异常修饰和过度磷酸化,进而毁坏了微管的结构和稳定性,轴突运输、信号传导等生理功能损坏,最终导致神经元的变性死亡和痴呆的发生[24]。 开心散干预后的AD 大鼠皮层、海马组织内tau 蛋白及其磷酸化激酶GSK-3β 的表达水平明显下调,证明开心散可调控tau 蛋白磷酸化水平,维护中枢神经系统的正常运转。
BCL-2 蛋白质大家族主导着细胞对诱发凋亡的各种刺激及损害的敏感性与抵抗力[25]。 根据结构同源性与功能可分为抗凋亡蛋白(以BCL-2 为代表)与促凋亡蛋白(以BAX 为代表)[26],BCL-2 与BAX 在大脑中的比例介导着神经元的存活[27]。 研究发现,开心散治疗后的AD 大鼠脑组织中BAX 蛋白的表达量有所降低,且BCL-2/BAX 的比值趋于升高,表明开心散在一定程度上可干涉凋亡因子对神经元的毁伤,进而减少其凋亡的发生。
然而,本研究旨在对开心散抗痴呆的药理活性进行全面筛查与验证,所采用的海马CA1 区注射Aβ1-42寡聚体致痴呆模型只能复制AD 的部分症状与病因,且研究所设立的指标与靶点较为宽泛,缺乏针对单一神经功能系统或完整信号蛋白通路的侧重考查,还需在后续研究中加以补充探索。
由以上可知,开心散对双侧海马CA1 区注射Aβ1-42造模大鼠的痴呆症状与脑组织损伤有较好的治疗作用和缓解效果,其作用机制涉及到胆碱能神经递质、炎症因子、β-淀粉样蛋白、tau 蛋白磷酸化水平以及凋亡因子等多靶点、多通路的靶向调控与干预,此研究也进一步证实开心散抗痴呆的药理活性,其作为治疗“好忘”的经典古方具备进一步挖掘的价值。

