阪崎克罗诺杆菌单克隆抗体的制备及特性分析
张传印,蒋蔚,刘鹏选,王权 ,叶方钰,谢雨芮,韩先干,陈伟*
(1塔里木大学动物科学与技术学院,新疆 阿拉尔 843300)
(2中国农业科学院上海兽医研究所,上海 200241)
食源性致病菌污染是影响食品安全的重要因素,据世界卫生组织调查,由食品污染引起的食物中毒高达85%[1]。阪崎克罗诺杆菌(Cronobacter sakazakii,CS)是常见的一种食源性致病菌,该菌为革兰阴性菌,周生鞭毛、无芽胞,自身免疫力低下的人群如婴幼儿、老人及受过免疫损伤的成年人易感[2]。CS感染人体后能引起严重的脑膜炎、败血症、坏死性结肠炎等[3],甚至会形成肿瘤,影响神经系统的发育[4]。该菌主要分布于婴幼儿食品及冲调食品中[5],但王小龙等[6]的流行病学调查发现从谷物、藕粉、芝麻糊中能检测出CS,在面粉、香料、挂面、蔬菜、燕麦中也能检测出CS[7]。在某些CS感染患者的尿液、脑脊液、胃肠道[8]均能检出此菌,这表明此菌带来的危害严重,亟需加大防控力度。
CS为克罗诺杆菌属,该属含7个种,其余6个种分别为莫氏克罗诺杆菌、广泛克罗诺杆菌、苏黎世克罗诺杆菌、都柏林克罗诺杆菌、丙二酸克罗诺杆菌、康迪蒙提克罗诺杆菌[9],其中丙二酸克罗诺杆菌和阪崎克罗诺杆菌是临床株[10],这意味着致病的克罗诺菌株大多数为丙二酸克罗诺杆菌和阪崎克罗诺杆菌。关于广泛克罗诺杆菌及苏黎世克罗诺杆菌报道很少,其余3种菌株为环境共生菌故临床意义不大[11-12]。目前对CS的检测方法有微生物学检测法、分子学检测法、免疫学检测法等。传统微生物检测法主要包括DFI法[13]、三管法[14];分子生物学检测主要包括PCR、荧光定量PCR、LAMP环等温扩增;免疫学检测法主要包括胶体金免疫层析检测、酶联免疫检测、间接免疫荧光检测、免疫磁珠富集技术等。传统微生物检测耗时长、操作繁琐,分子生物学检测花费大、样品前处理时间长,而免疫学检测灵敏度高、耗时短、特异性强且操作简便。单克隆抗体技术是一种重要的免疫学技术,可广泛应用于抗原的鉴定[15],此技术具有操作简便、灵敏度高等优点。本试验以CS为免疫原制备抗CS单克隆抗体,可为该菌的防控提供基础。
1 材料与方法
1.1 试验材料
1.1.1 试验菌株、细胞和动物
阪崎克罗诺杆菌(ATCC21550、ATCC21561、ATCC21552、CMCC1.6765)、莫氏克罗诺杆菌CICC23943、苏黎世克罗诺杆菌CICC24178、都柏林克罗诺杆菌CICC21564、广泛克罗诺杆菌CICC21570、丙二酸克罗诺杆菌CICC21551、单增李斯特菌CICC21635、鼠伤寒沙门菌CMCC10248、副溶血弧菌、大肠杆菌O157∶H7、肺炎克雷伯菌、蜡样芽胞杆菌、枯草芽胞杆菌、普通变形杆菌、骨髓瘤细胞均由上海兽医研究所C301实验室保存;BALB/c及KM小鼠购自上海杰思捷实验动物有限公司。
1.1.2 试验试剂
弗氏完全佐剂、弗氏不完全佐剂、PEG 6 000购自美国Sigma公司;DMEM购自Gibco公司,南美特级胎牛血清及TSB肉汤购自上海秋爽生物科技有限公司;青链霉素混合液及L-谷氨酰胺购自北京索莱宝科技有限公司;次黄嘌呤(Hypoxanthine)、氨基喋呤(Aminopterin)、胸腺嘧啶核苷(Thymeidine)购自上海Sigma公司;细胞培养板及酶标板购自美国Corning公司;亚型鉴定试剂盒购自Southern Biotech公司。
1.1.3 试验引物
根据参考文献[16]-[19]中已报道的CS特异性鉴定引物,筛选出4对并由北京擎科生物科技上海分公司合成,其序列见表1。

表1 4对特异性引物序列
1.1.4 主要仪器
倒置显微镜购自德国Carl Zeiss公司;乳化仪购自Amalgamator公司;台式低温离心机购自Thermo Fisher科技有限公司;电子分析天平购自美国Mettler Toledo公司;CO2细胞培养箱购自美国Thermo Scientific公司;多功能酶标仪购自美国Biotek公司。
1.2 试验方法
1.2.1 阪崎克罗诺杆菌的复苏、纯化、鉴定
将4株CS(ATCC21550、ATCC21561、ATCC21552、CMCC1.6765)转接于TSB肉汤,37℃恒温摇床(200 r/min)增菌18 h。增菌完成后,将菌液用划线法接种于TSA平板上,37℃恒温箱培养18~24 h,以增菌→划线接种的方式纯化5代。第5代菌落增菌至OD600=1时,平板计数法[20]计此状态活菌数。将上述4株CS各取1 mL菌液,提取基因组后PCR鉴定并测序。
1.2.2 抗原制备及免疫动物
把增菌至OD600=1的4株菌的菌液(ATCC21550、ATCC21561、ATCC21552、CMCC1.6765)各 加 入0.3%甲醛灭活后等比例混匀,用无菌1×PBS洗脱甲醛5次(12 000 r/min,3 min),然后用0.9%NaCl生理盐水将菌液浓度调整为1×1010CFU/mL。
将制备的200 μL免疫原(灭活细菌量为2×109CFU)与200 μL弗氏完全佐剂混匀后乳化,免疫小鼠足垫;2周后第2次免疫,免疫量为1×109CFU,选用弗氏不完全佐剂乳化,免疫小鼠背部皮下;第3~5次免疫与第2次免疫一致,共免疫3只BALB/c小鼠。
1.2.3 间接ELISA法测定血清效价
对免疫后7 d小鼠采集血清,将血清二倍比稀释至128 000倍,利用间接ELISA法测定血清效价。步骤:把浓度为2×109CFU/mL菌悬液37℃包被4 h或4℃包被12 h;用1%明胶37℃封闭2 h;加入100 μL稀释后的血清37℃孵育1.5 h或4℃孵育12 h;加入100 μL 10 000倍稀释的羊抗鼠IgG,37 ℃孵育1 h;加入100 μL底物显色液37 ℃反应15 min,加入50 μL 2 mol/L H2SO4终止反应;多功能酶标仪读取OD450值,阳性判定标准为P/N≥2.1且OD450>1。
1.2.4 细胞融合
选取血清效价最高的小鼠,取脾脏细胞与均一、明亮、圆润、长势快的骨髓瘤细胞进行细胞融合。步骤:将骨髓瘤细胞和脾脏悬液转移至融合管内离心(1 000 r/min,8 min),弃掉上清;取1 mL融合剂PEG于45 s内均匀加入融合管内,反应90 s;细胞融合终止:30 s内均匀加入1 mL DMEM;30 s内均匀加入2 mL DMEM;2 min内快速加入10 mL DMEM。静置后离心(1 000 r/min,10 min),用 10 mL 20%FBS DMEM(1%HAT)重悬,取1滴混于24 mL 20%FBS DMEM(1%HAT)中,滴入预先铺布饲养层的96孔细胞培养板中,于第3~5 d观察。
1.2.5 细胞株筛选及亚克隆
细胞株筛选步骤与血清效价测定步骤一致。阳性瘤细胞株亚克隆步骤:把阳性瘤细胞悬液二倍稀释8~10梯度,静置5~10 min,计细胞数;选择计数结果为100~150的细胞悬液混于10 mL 20%FBS DMEM(1%HAT)中,均匀铺布至96孔细胞培养板中;剩余细胞悬液保留,备用。
1.2.6 单克隆抗体腹水制备
对同批健康BALB/c小鼠腹腔连续注射2次0.5 mg灭菌石蜡油,间隔为1周。第3周对每只小鼠腹腔注射1×106个杂交瘤细胞,采用体内诱生法[21]诱导小鼠产生腹水。小鼠腹水的处理:腹水常温静置2~4 h或4℃静置过夜后离心(1 000 r/min,30 min),抽取中层腹水,-80℃保存备用。
1.2.7 单克隆抗体效价测定
梯度稀释单克隆抗体,结合间接ELISA测定抗体效价,步骤同血清效价测定。
1.2.8 抗体特异性测定
将单增李斯特菌、鼠伤寒沙门菌、副溶血弧菌、蜡样芽胞杆菌、枯草芽胞杆菌、大肠杆菌O157∶H7、肺炎克雷伯菌、普通变形杆菌、苏黎世克罗诺杆菌、丙二酸克罗诺杆菌、莫氏克罗诺杆菌、广泛克罗诺杆菌、都柏林克罗诺杆菌作为ELISA包被原,将抗CS单克隆抗体稀释至1∶20 000,测其与上述菌株的交叉反应,步骤同血清效价测定。
1.2.9 抗体亚型测定
根据SBA Clonotyping System-HRP抗体亚型鉴定试剂盒说明书步骤,利用ELISA测定抗体亚型。抗体稀释液为5%FBS PBST,亚型试剂稀释液为1%BSA PBST。
1.2.10 抗原表位测定
包被及封闭完成后,用辣根过氧化物酶(HRP)标记2H2抗体,加50 μL酶标抗体(1∶500)及50 μL 不同梯度稀释的9D10抗体,对照孔加入100 μL 2H2酶标抗体(1∶1 000),37 ℃孵育2 h;加入100 μL底物显色液 37 ℃反应 15 min,用50 μL 2 mol/L H2SO4终止反应;多功能酶标仪读取OD450值。
2 结果与分析
2.1 菌落计数结果
将纯化后的4株CS增菌至OD600=1时,其3组平行菌落计数结果如图1所示,计数结果均为2×109CFU/mL。

图1 菌落计数结果
2.2 鉴定结果
4对CS特异性引物扩增片段分别为149 bp、282 bp、469 bp、952 bp,PCR鉴定后条带大小均正确,将产物纯化后测序,比对测序结果表明4株菌株均为CS,PCR鉴定结果如图2所示。

图2 CS特异性引物鉴定结果
2.3 免疫血清效价
采集3只小鼠经5次免疫后7 d的血清,把血清梯度稀释后,利用间接ELISA测其血清效价,结果如表2所示,3只小鼠血清效价均可达32 000。

表2 5次免疫后3只小鼠血清效价
2.4 亚克隆及筛选
如图3所示,细胞融合后5 d细胞团内细胞圆润、均一,细胞团大小适中,呈葡萄串状。选择此状态下的培养基上清用间接ELISA测定其效价并且对阳性孔换新培养基3 d后复检,复检阳性孔进行亚克隆。本试验共计4次亚克隆,第1次亚克隆阳性率为37.5%;第2次亚克隆阳性率为48.9%;第3次亚克隆阳性率为72.9%;第4次亚克隆阳性率93.8%,经4次克隆成功筛选出2株抗体效价高且特异性好的细胞株,根据融合板坐标,分别命名为2H2、9D10。
图3 细胞融合后5 d瘤细胞团
2.5 单克隆抗体腹水效价
取1 μL单克隆抗体腹水将其梯度稀释,利用间接ELISA测定OD450值,P/N≥2.1且OD450>1判定为阳性,图4中a图与b图N值分别为0.083和0.082。如图4所示,2H2抗体腹水效价为6 000 000;9D10抗体腹水效价为2 000 000。

图4 2株单克隆抗体腹水效价
2.6 单克隆抗体特异性试验
如图5所示,稀释20 000倍的2株抗体与单增李斯特菌、鼠伤寒沙门菌、副溶血弧菌、蜡样芽胞杆菌、枯草芽胞杆菌、大肠杆菌O157∶H7、肺炎克雷伯菌、普通变形杆菌、苏黎世克罗诺杆菌、丙二酸克罗诺杆菌、莫氏克罗诺杆菌、广泛克罗诺杆菌、都柏林克罗诺杆菌均无交叉反应,阪崎克罗诺杆菌为阳性对照,由此表明9D10抗体和2H2抗体特异性良好。
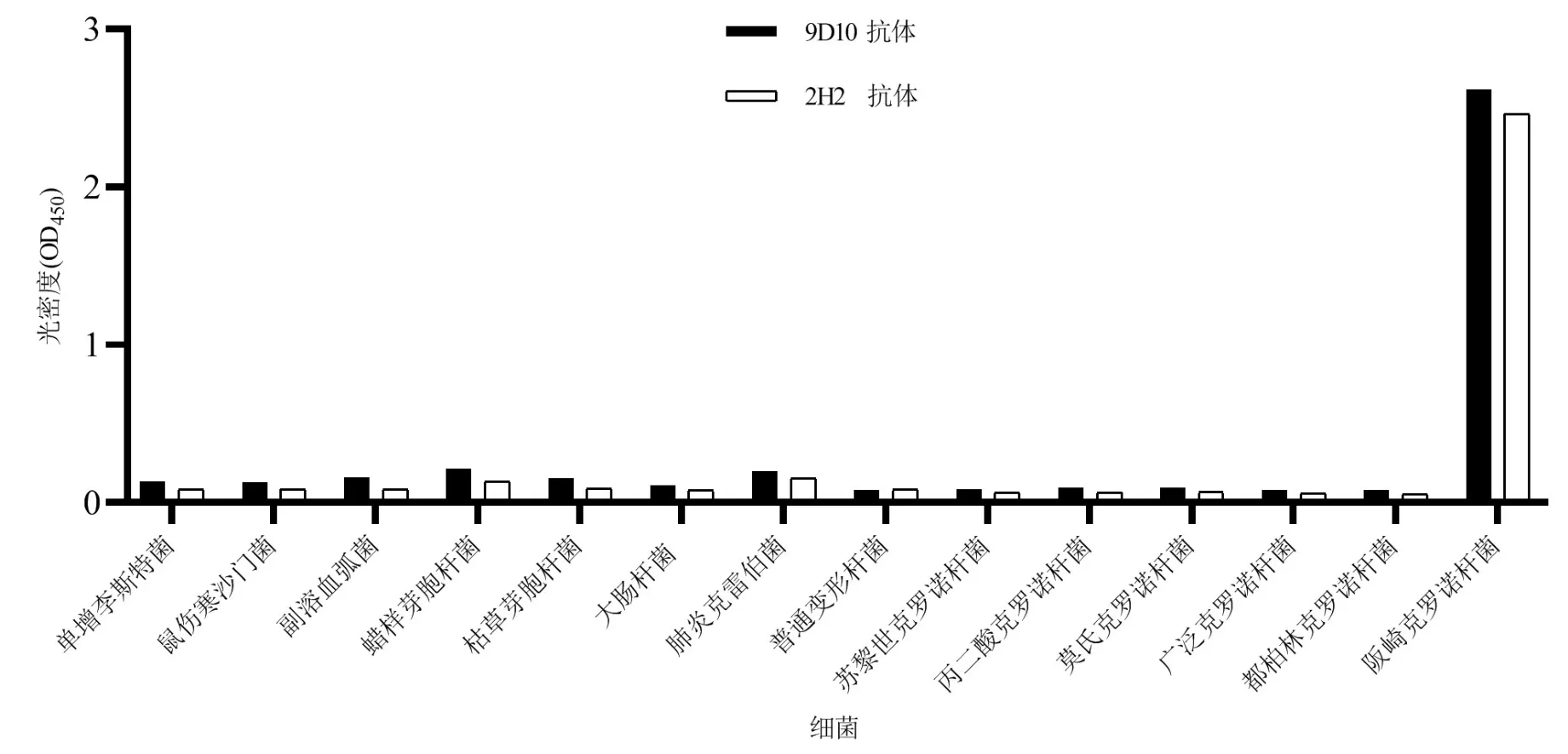
图5 2株单克隆抗体特异性
2.7 亚型鉴定结果
单克隆抗体共计有6种重链亚型,分别为IgA、IgM、IgG2a、IgG1、IgG3、IgG2b;有2种轻链亚型,分别为 Lambda、Kappa。经 SBA Clonotyping System-HRP抗体亚型试剂盒鉴定,2H2抗体及9D10抗体重链均为IgG2a,2株抗体轻链均为Kappa,如表3所示。
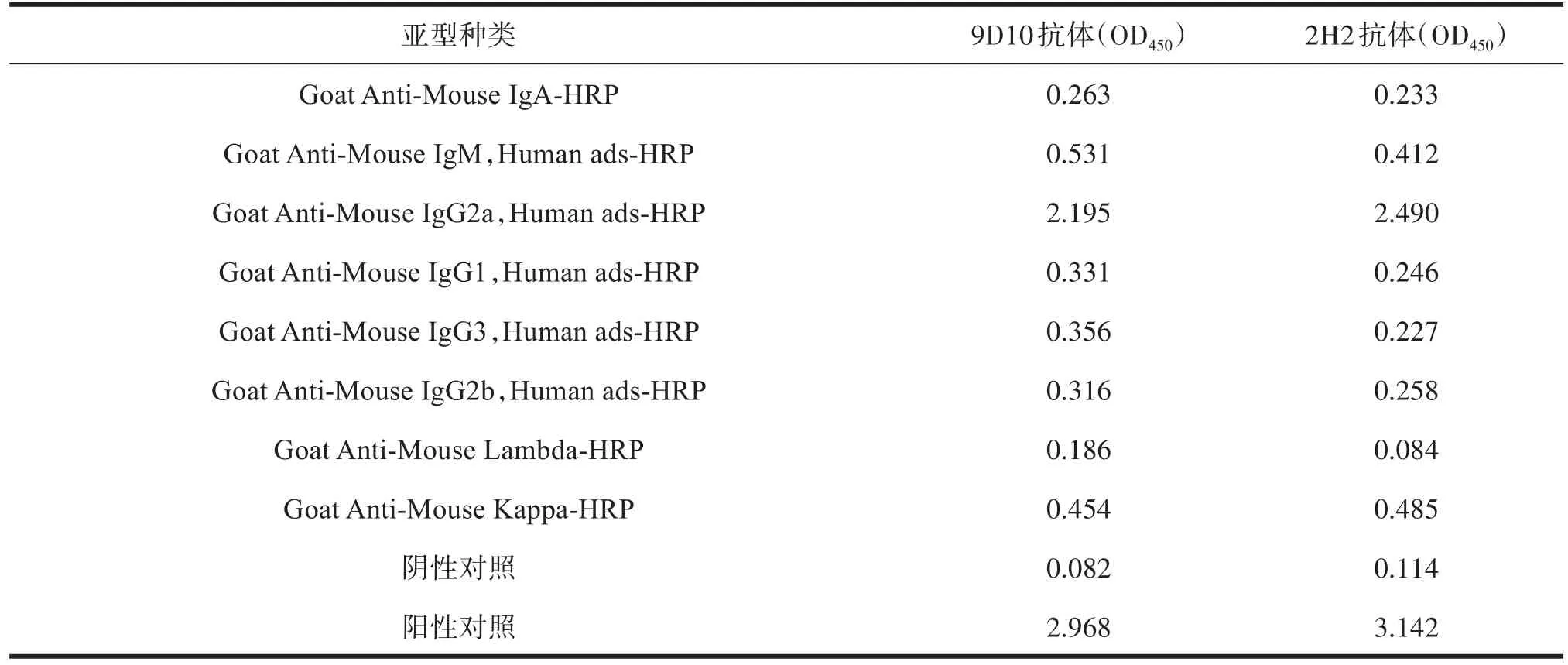
表3 2株单克隆抗体亚型测定结果
2.8 单克隆抗体竞争ELISA试验
竞争ELISA结果如图6所示,未经HRP标记的9D10抗体加入后,与对照组OD450值差异不显著,表明9D10抗体与2H2抗体针对CS不同抗原表位。
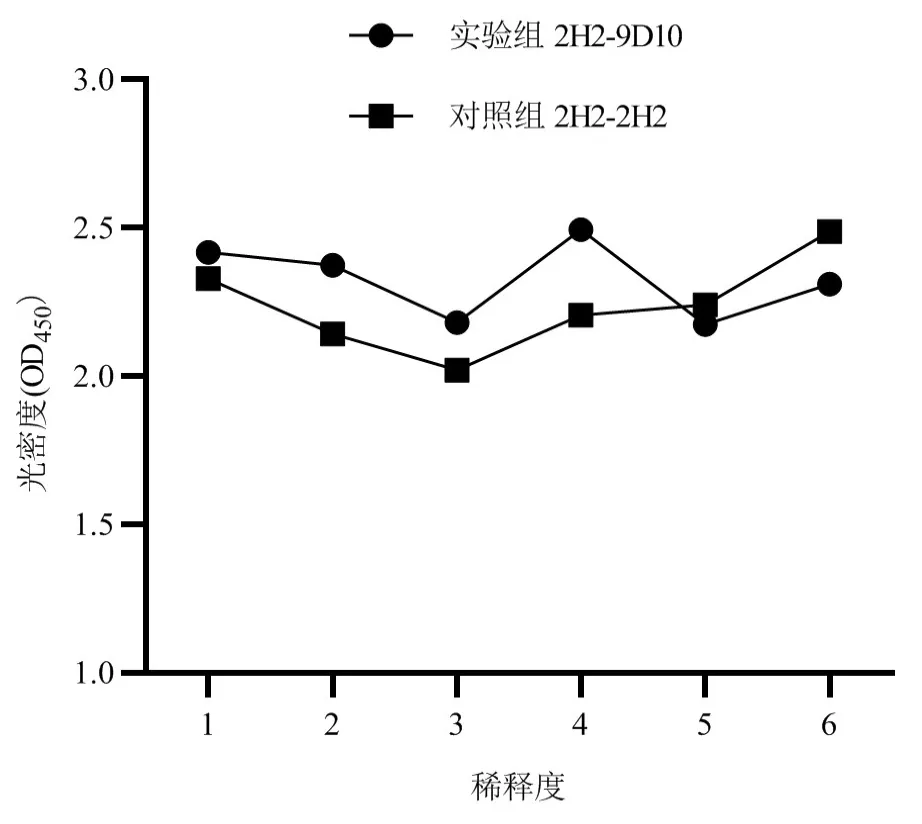
图6 2株单克隆抗体竞争ELISA结果
3 讨论
CS引起的疾病发病率不算很高,但致死率极高[22]。该菌是食源性致病菌检测的重点,免疫学方法是检测该菌的方式之一[5]。单克隆抗体技术是免疫学工作中经常采用的一种技术[15],此技术具有操作简便、灵敏度高等优点。在单抗制备中免疫程序起着重要的作用,一般采用8~12周龄BALB/c小鼠免疫。免疫原制备选用甲醛灭活,制作成颗粒性抗原,这是由于颗粒性抗原比可溶性抗原有更好的免疫原性,从而让小鼠有更好的免疫效果。选择4种CS等量混合免疫,避免因个别菌种差异导致单克隆抗体针对的抗原表位差异太大,以保证抗CS单克隆抗体的均一。因初步融合细胞较为脆弱,需要提取KM小鼠腹腔内的细胞铺布融合细胞饲养层。阳性细胞株需要进一步克隆时应趁早,避免细胞团块太多造成无效克隆。另外因为细胞的生长较为苛刻,所以应及时关注细胞状态,避免因为主观原因(CO2不足、H2O不足、温度变化)而造成细胞状态不好甚至死亡。
本研究制备的2株抗体,采用的是P/N≥2.1且OD450>1双重判断标准,9D10抗体和2H2抗体效价分别为2×106和6×106。其他文献报道的研究中抗CS单克隆抗体效价分别为 50 000[23]、100 000[5]、200 000[24],相比而言,本试验制备的单抗腹水效价相对较高。特异性试验表明,9D10与2H2单抗对常见的其他食源性致病菌如大肠杆菌、肺炎克雷伯菌、沙门菌等均无交叉反应。克罗诺杆菌属7个种之间同源性较高,相互之间容易产生抗原交叉[25-26],而本试验制备的2株抗体与克罗诺菌属其他菌种均无交叉反应,这说明2株抗体种属间特异性较好,可以用于克罗诺杆菌属中CS的鉴别诊断。亚型鉴定结果表明,本试验2株抗体的重链均为IgG2a,轻链均为Kappa,其他文献报道的研究中抗CS单克隆抗体重链也多为IgG型,轻链多为Kappa型[23-24,27-28]。Ig主要在机体免疫中起保护作用,大多数抗菌、抗病毒产生的抗体类型,多数为IgG型抗体,IgG是唯一能通过胎盘的免疫球蛋白,在婴儿期能够起到很好的防御作用,还有中和细菌、毒素,结合微生物促成吞噬作用,激活补体等作用[15]。因此,本研究获得的2株单抗将来可用于CS的治疗研究。此外,可以利用单抗捕获细菌,如杨柳等[29]利用磁珠耦连抗CS单克隆抗体,富集环境中存在的CS,也可以利用单抗建立检测方法,如向双林等[5]以2株抗CS单克隆抗体分别作为捕捉抗体和检测抗体,建立双抗夹心ELISA方法,检测限度可达103CFU·mL-1。本研究利用HRP对抗体标记,通过竞争ELISA法测定2株抗体抗原表位竞争性,结果表明这2株抗体针对CS不同的抗原表位,可为将来建立检测CS的免疫学检测方法提供基础,如双抗夹心ELISA法。
4 结论
综上,本研究成功制备出2株抗CS单克隆抗体9D10抗体和2H2抗体,效价均超过一百万,2株抗体效价分别为2×106、6×106;2株抗体的特异性均较好,不仅与常见的食源性细菌,如大肠杆菌、单增李斯特菌、沙门菌等无交叉反应,与CS同属的5种其他菌,如苏黎世克罗诺杆菌、丙二酸克罗诺杆菌等也均无交叉反应;2株抗体的重链均为IgG2a,轻链均为Kappa;2株抗体针对CS不同的抗原表位。抗CS单抗的成功制备,为后续针对CS的检测与治疗技术研究打下了很好的基础。

