Ca2+对‘伏脆蜜’裂果调控生理的研究
张晶晶,宋璐瑶,王振磊 ,吴翠云 ,林敏娟*
(1塔里木大学园艺与林学学院,新疆 阿拉尔 843300)
(2南疆特色果树高效优质栽培与深加工技术国家地方联合工程实验室,新疆 阿拉尔 843300)
鲜食枣‘伏脆蜜’具有早熟丰产、耐旱、含糖量高且口味酸甜等特点,深受广大消费者喜爱[1]。但因成熟期‘伏脆蜜’裂果率较高,因而严重影响果实品质与产量。
分布在纤维素和半纤维素微丝中的果胶质与木质素、蛋白质及矿物质共同构成植物细胞壁结构,细胞壁结构物质变化与裂果的发生密切相关,有关学者对龙眼[2]、番茄[3]及锦橙[4]研究发现,裂果果皮中纤维素及果胶含量显著低于正常果果皮。Ca2+在维持细胞壁结构和功能中发挥着重要作用,缺钙是导致果实裂果的重要原因之一[5]。通过喷施钙制剂可补充果实的Ca2+含量,高活性钙与果胶质结合形成果胶酸钙,果胶酸钙可以连接相邻细胞,增加表皮层厚度和细胞间韧性。郭红彦等[6]研究发现不同时期喷施CaCl2可提高‘壶瓶枣’果皮中原果胶及纤维素含量,降低枣果实裂果率。因此Ca2+可通过影响植物细胞壁中物质的含量影响裂果的发生[7-9]。
有研究发现,细胞壁代谢相关酶对细胞壁网络结构的形成起主要作用,细胞壁代谢酶可通过降解细胞壁物质含量而降低果皮强度,导致裂果率增加[8]。易裂荔枝品种‘糯米糍’中的果胶酶、纤维素酶和果胶甲酯酶活性显著高于耐裂荔枝品种‘淮枝’[10]。喷施钙制剂可明显降低植物细胞壁降解酶活性,使细胞壁物质不易发生水解,有利于维持细胞壁结构稳定,增加果皮抗裂能力,不易裂果[7,11]。喷施外源钙素可显著降低‘寒富’[12]苹果及脐橙[13]中果胶甲酯酶、多聚半乳糖醛酸酶、纤维素酶的活性,减少细胞壁物质的水解,提高果实硬度从而降低果实裂果率。果皮解剖结构也是引起裂果的重要因素,不同品种果实之间由于果皮组织解剖结构不同会导致果皮延展性及抗张强度不同,致使裂果率不同[14],果实表皮层厚度、表皮细胞大小与形状、细胞排列疏松程度和果肉空腔大小都与果实抗裂相关[15-16]。
目前关于枣裂果的研究多集中于同一品种不同部位或者不同品种相同部位的激素含量、矿物质元素、果皮解剖结构等方面。关于喷施外源Ca素对枣裂果部位及非裂果部位细胞壁物质含量、细胞壁代谢酶活性、果皮解剖结构等方面的研究报道较少。因此本研究以易裂鲜食枣品种‘伏脆蜜’为试验材料,测定喷施CaCl2、喷施清水、自然条件处理后的‘伏脆蜜’枣裂果及非裂果部位细胞壁物质含量、细胞壁代谢酶活性,观察果皮解剖结构,以期通过研究喷施CaCl2对枣裂果及相关生理指标的影响,探讨Ca2+对枣裂果的作用机理,为枣裂果防治提供科学理论依据。
1 材料与方法
1.1 试验材料
试验材料为易裂鲜食枣品种‘伏脆蜜’,来自于塔里木大学园艺试验站枣种质资源圃,树龄10年,常规田间管理,水肥条件一致。
1.2 试验设计与处理方法
于2021年枣树盛花期,选择长势一致、开花较多的果树进行挂牌标记。盛花期后30~65 d对枣树进行喷施清水以及喷施CaCl2(200倍液)处理,以自然条件对照。每个处理选取10棵枣树,每隔7 d在傍晚黄昏时分从枣树不同方向分别喷施CaCl2、喷施清水,至叶面、果面自然滴水为止,共喷施5次。在枣裂果中期(盛花期后80 d)采摘100个裂果果实,蒸馏水清洗干净,取裂果部位和非裂果部位果皮,液氮冷冻后装入自封袋,做好标记,置于-80℃冰箱保存备用。
1.3 枣裂果方式及裂果率调查
盛花期后80 d(枣裂果中期),分别调查统计喷施CaCl2、喷施清水以及自然条件下100个枣裂果的裂果方式(纵裂、环裂、不规则裂),每个处理重复3次。分别调查统计喷施CaCl2、喷施清水及自然条件下3棵枣树总果数以及裂果数,并计算裂果率[17]。
1.4 细胞壁代谢酶活性测定
纤维素酶(cellulase,CE)和多聚半乳糖醛酸酶(polygalacturonase,PG)活性采用DNS终止反应法[18],果胶甲酯酶(pectin methylesterase,PME)活性及β-半乳糖苷酶(β-galactosidase,β-Gal)活性测定采用果胶甲酯化程度试剂盒及β-半乳糖苷酶试剂盒(苏州科铭生物技术有限公司)。
纤维素酶及多聚半乳糖醛酸酶液提取:称取0.2 g果皮于预冷的研钵中,加入1 mL 0.04 mol/L,pH为6.0的醋酸钠溶液研磨,将研磨过后的匀浆倒入10 mL离心管,用醋酸钠缓冲液冲洗研钵3遍,每次加1mL,将样液置于4℃冰箱中保存1h后,4℃,5000 r/min离心30 min,上清液即为两种酶的粗提取液,将提取液置于0℃碎冰上待测。
纤维素酶:吸取2 mL 1%甲基纤维素和0.5 mL粗酶液于试管中,40℃水浴保温1 h后立即加入2.5 mL DNS终止反应,置于沸水中显色5 min,待冷却后于540 nm下比色。
多聚半乳糖醛酸酶:吸取0.2 mL 0.04 mol/L,pH为4.6的醋酸钠缓冲液于玻璃试管中,加入0.3 mL 1%多聚半乳糖醛酸溶液,吸取0.1 mL酶液于试管中,加入0.4 mL蒸馏水于37℃水浴保温1 h,立即加入1 mL DNS终止反应,置于沸水中显色5 min,待冷却后于540 nm下比色。
果胶甲酯酶:取适量枣果皮组织,液氮研磨,取约0.1 g组织,加入1 mL蒸馏水,冰浴震荡2 min,4℃9 500 r/min高速离心10 min,弃去上清液,留沉淀。沉淀中加入1 mL提取液,混匀后90℃水浴2 h,冷却后4℃9 500 r/min离心10 min,上清液即为果胶酯酶待测液。
β-半乳糖苷酶:取0.1 g枣果皮组织于研钵中,液氮迅速研磨,加入1 mL提取液,冰浴震荡2 min,4℃11 500 r/min离心10 min,上清液即为β-Gal提取液,放置0℃冰上待测。
1.5 细胞壁物质含量测定
纤维素和半纤维素的含量测定采用蒽酮比色法,水溶性果胶、离子结合型果胶及共价结合型果胶的含量测定采用咔唑硫酸比色法[18]。
称取1.0 g果皮,加入2.5 mL 80%的乙醇溶液,将匀浆倒入15 mL离心管中再依次加入2.5 mL 80%的乙醇提取液冲洗3次,于90℃水浴20 min,冷却后6 000 r/min离心15 min,弃去上清液(重复5~6次),加入10 mL 90%的二甲基亚砜于4℃冰箱静置15 h,6 000 r/min离心,弃上清液,加入10 mL氯仿∶甲醇为1∶1的混合液冲洗滤渣,离心弃上清液,加10 mL丙酮,洗涤沉淀(重复2遍),弃去上清液,将沉淀置于45℃恒温箱中烘干至恒重,得到粗细胞壁。
粗细胞壁用50 mmol/L的乙酸钠溶液(pH为6.5)震荡3 h提取得到水溶性果胶,5 000 r/min离心后取出水溶性果胶溶液,在沉淀中加入50 mmol/L EDTA溶液(含50 mmol/L的乙酸钠)震荡3 h得到离子结合型果胶,5 000 r/min离心后取出离子结合型果胶溶液,在沉淀中加入50 mmol/L碳酸钠溶液(含2 mmol/L EDTA)得到共价结合型果胶,剩余沉淀用4 mmol/L氢氧化钾溶液提取12 h,洗涤沉淀1次,合并2次上清液,得到半纤维素提取液,剩余沉淀再用ddH2O洗涤2次,离心弃上清液,沉淀即为纤维素,加入10 mL 60%浓硫酸置于4℃冰箱水解12 h,以测定纤维素含量。
1.6 石蜡切片制作与解剖结构观察
石蜡切片制作在参考高秋玲等[19]研究方法的基础上略有改动。用不锈钢刀片在喷施CaCl2处理、喷施清水处理、自然条件的裂果及非裂果部位分别切取5 mm×5 mm大的枣果皮组织,立即放入由50%乙醇∶醋酸∶38%甲醛配置比例为90∶5∶5的FAA固定液中,抽至真空,常温保存备用。FAA固定枣果实材料经乙醇梯度脱水-二甲苯透明-浸蜡-包埋、修蜡-切片(5~10 μm)、粘片-二甲苯40 ℃脱蜡-染色(番红,固绿)-封片。将喷施CaCl2、喷施清水、自然条件下的裂果及非裂果部位分别制作6张石蜡切片,在光学显微镜(10×),总放大倍率为6.3倍下观测并拍照,每个切片观察5个视野。测量果皮蜡质层厚度、表皮层厚度、内表皮层厚度及果肉空腔大小。
1.7 数据分析
采用DPS 7.55软件和Microsoft Office Excel 2010软件对数据进行处理并作图,采用Duncan新复极差测验法进行差异显著性检验。
2 结果与分析
2.1 不同处理对‘伏脆蜜’裂果方式及裂果率的影响
由表1分析可知,纵裂是‘伏脆蜜’主要的裂果方式,纵裂率为77.00%~81.00%,环裂率为9.00%~15.33%,不规则裂变化范围为7.67%~10.00%;喷施CaCl2可显著降低枣裂果率,喷施CaCl2后枣裂果率分别比自然条件及喷施清水处理低10.61%、24.29%。

表1 不同处理对‘伏脆蜜’裂果方式及裂果率的影响 %
2.2 不同处理对‘伏脆蜜’果皮细胞壁代谢酶活性的影响
由表2分析可知,喷施CaCl2、喷施清水及自然条件下枣果皮不同部位细胞壁代谢酶活性存在显著差异,喷施CaCl2后非裂果部位CE及β-Gal活性高达2 678.63 U/g、25.35 U/g,高于自然条件及喷施清水处理裂果及非裂果部位酶活性;喷施CaCl2后的‘伏脆蜜’PG活性显著降低,非裂果部位PG值最低为2 149.29 U/g,分别比自然条件及喷施清水处理非裂果部位酶活性低74.34 U/g、258.70 U/g;自然条件及喷施清水处理裂果及非裂果部位PME活性显著高于喷施CaCl2处理,喷施CaCl2后非裂果部位酶活性相比自然条件及喷施清水处理降低12.29%、20.15%。
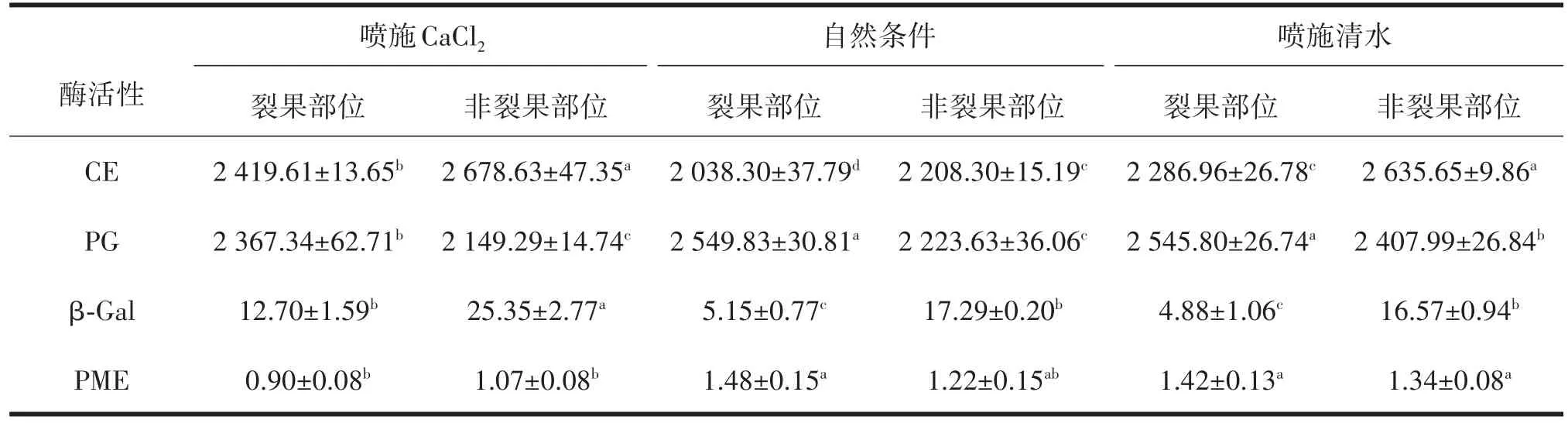
表2 不同处理对‘伏脆蜜’果皮细胞壁代谢酶活性的影响 U/g
2.3 不同处理对‘伏脆蜜’果皮细胞壁物质含量的影响
由表3分析可知,喷施CaCl2、喷施清水及自然条件下枣果皮裂果及非裂果部位细胞壁物质含量差异显著,喷施CaCl2和喷施清水处理及自然条件非裂果部位的水溶性果胶、离子结合型果胶、共价结合型果胶、半纤维素及纤维素含量显著高于裂果部位。喷施CaCl2后非裂果部位水溶性果胶、离子结合型果胶、共价结合型果胶、半纤维素及纤维素含量分别为2.75%、1.00%、1.86%、1.45%、2.65%,显著高于喷施清水处理及自然条件裂果及非裂果部位酶活性。
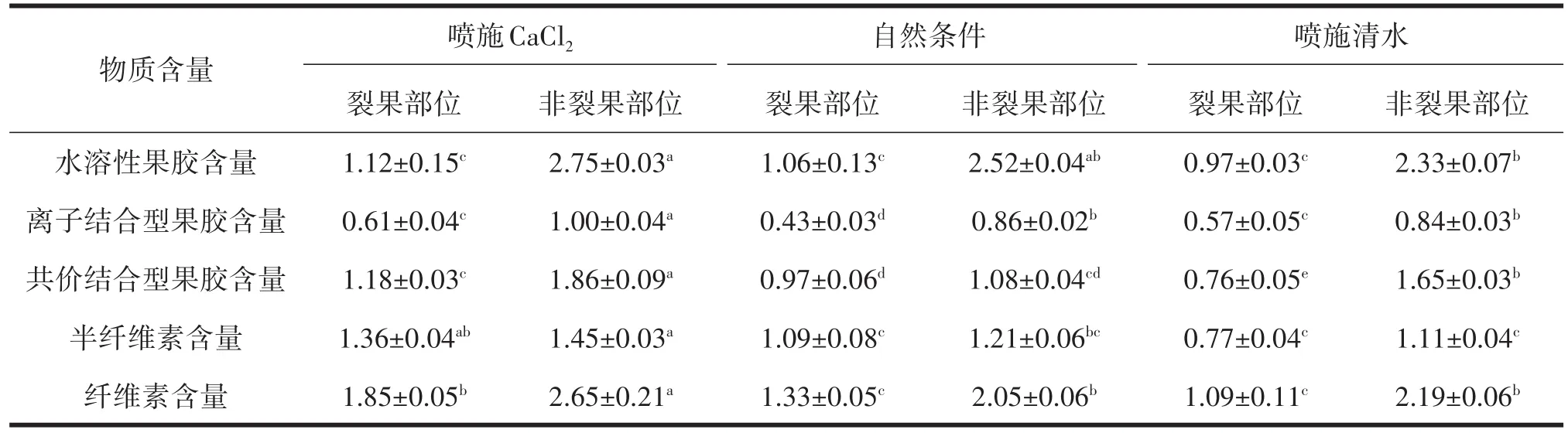
表3 不同处理对‘伏脆蜜’果皮细胞壁物质含量的影响 %
2.4 不同处理对‘伏脆蜜’果皮解剖结构的影响
由表4分析可知,喷施CaCl2、喷施清水及自然条件下非裂果部位蜡质层、表皮层及内表皮层厚度均显著高于裂果部位,3个处理非裂果部位枣果皮蜡质层、表皮层、内表皮层厚度均表现为喷施CaCl2>自然条件>喷施清水,喷施CaCl2处理后非裂果部位蜡质层厚度相比自然条件及喷施清水非裂果部位高22.38%及25.73%;自然条件及喷施CaCl2、喷施清水后非裂果部位表皮层厚度差异不显著;喷施CaCl2处理下非裂果部位内表皮层厚度分别是自然条件及喷施清水非裂果部位的1.05倍及1.14倍;喷施CaCl2处理后非裂果部位果肉空腔最小值为100.13µm。
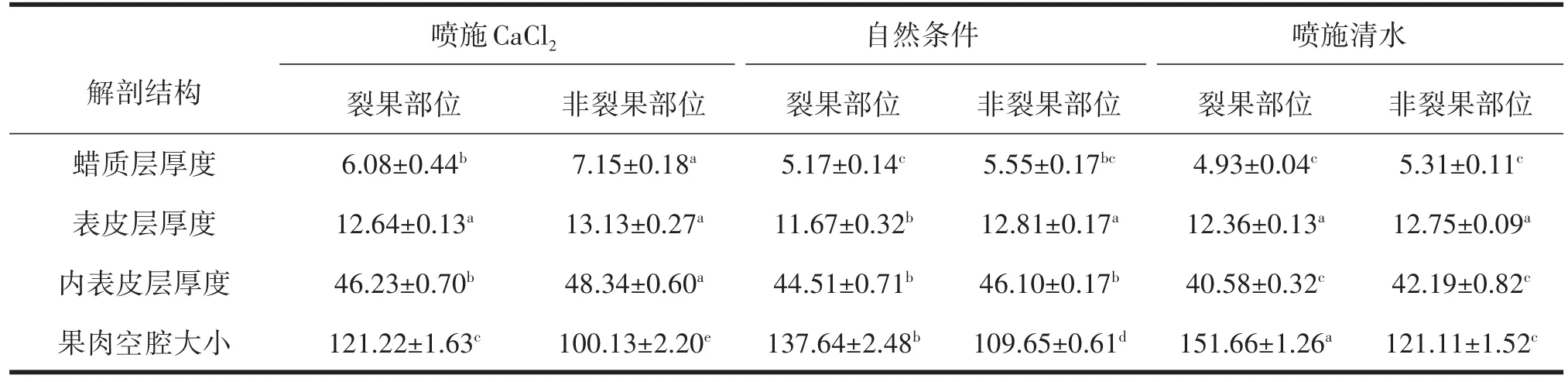
表4 不同处理对‘伏脆蜜’果皮细胞壁解剖结构的影响 µm
由图1可知,非裂果部位相比裂果部位表皮层及内表皮层细胞排列紧密且整齐,喷施CaCl2后枣果皮细胞相比自然条件及喷施清水处理后裂果和非裂果部位枣果皮细胞结构较为完整,表皮细胞排列整齐;喷施清水后裂果部位表皮层有明显龟裂现象,喷施CaCl2后裂果部位和非裂果枣果肉空腔相比自然条件和清水处理后的小且少。
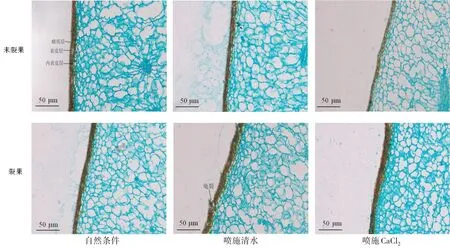
图1 不同处理后‘伏脆蜜’果皮不同部位细胞结构的变化
3 讨论
3.1 喷施CaCl2处理细胞壁代谢酶与裂果的关系
果胶酶分为多聚半乳糖醛酸酶、果胶甲酯酶、原果胶酶及果胶裂解酶,这四种酶可协同作用将复杂的果胶分解为小分子物质致使植物细胞壁被破坏,从而导致果皮细胞壁延展性降低,果实裂果率增加[20-21]。锦橙果皮中Ca2+含量较低会导致PG活性升高,裂果率升高,喷施CaCl2可显著降低锦橙裂果率[4]。丁改秀等[22]研究结果表明降低PME活性可降低‘壶瓶枣’裂果率。β-Gal是一种存在于植物、动物、微生物的糖苷键水解酶[23],β-Gal水解以后,抑制番茄中β-半乳糖苷酶基因TBG6的表达,导致裂果率上升[24]。CE可将不溶性纤维素转化为小分子物质,降低果皮机械强度[25]。本研究发现,喷施CaCl2后非裂果部位PG及PME活性显著低于自然条件及喷施清水处理裂果及非裂果部位酶活性,β-Gal活性及CE活性高于自然条件及喷施清水处理裂果及非裂果部位酶活性,与王建宇等[18]对‘伏脆蜜’非裂果部位CE活性显著高于裂果部位CE活性研究结果一致,郭红彦等[6]认为喷施CaCl2可降低‘壶瓶枣’的CE活性,关于Ca2+对枣果CE活性的影响仍需进一步研究验证。
3.2 喷施CaCl2处理细胞壁物质与裂果的关系
枣果皮细胞壁结构由果胶质、纤维素及半纤维素等多糖物质组成,细胞壁物质含量的变化及纤维素分子在细胞壁内的排列方式与裂果紧密相关[26]。当番荔枝果实中原果胶合成被抑制时,果皮容易开裂[27]。‘荔枝’[28]及‘壶瓶枣’[6]果皮中钙含量较高时,纤维素、半纤维素及果胶质含量也高,与裂果率呈负相关。本研究发现,喷施CaCl2处理非裂果部位果胶类物质、纤维素及半纤维素含量都显著高于喷施清水处理及自然条件裂果及非裂果部位细胞壁物质含量。王建宇等[18]研究也发现非裂果部位果胶质含量显著高于裂果部位。可能是因为Ca素抑制了细胞壁代谢酶的活性,降低了纤维素及果胶类物质分解速度,最终导致裂果率下降。
3.3 喷施CaCl2处理细胞壁解剖结构与裂果的关系
果实的外表皮由角质层、表皮细胞和亚表皮细胞组成。枣果果皮角质层厚度、表皮层厚度及细胞排列的致密及均匀度与枣果的抗裂性密切相关[29-30]。角质层是植物与外界的第一接触面,角质层蜡质是由位于角质层外的外层蜡质和深嵌在角质层中的内层蜡质两部分构成[31]。‘灵武长枣’‘赞皇大枣’及其他鲜枣品种的果皮表皮层厚度、亚表皮层厚度、表皮层数均与裂果率呈负相关[32-34]。郗鑫等[35]通过对枣果表皮细胞研究发现,耐裂品种及正常果皮细胞排列紧密,易裂品种枣果皮呈长圆形或卵圆形且排列疏松无规则。本研究结果表明,喷施CaCl2处理非裂果部位蜡质层、表皮层、内表皮层厚度显著高于自然条件及喷施清水处理,喷施CaCl2处理后枣果皮表皮细胞排列整齐,无明显龟裂现象,且果肉空腔较小,这与郭红彦等[6]对喷施CaCl2后可使枣果角质层保存完整、表皮细胞排列紧实规整、不发生龟裂且果肉空腔较小研究一致,因此喷施CaCl2可增强枣果抗裂性。
4 结论
喷施外源Ca可以显著降低枣果皮非裂果部位PG及PME活性,提高CE及β-Gal活性,显著提高纤维素、半纤维素、水溶性果胶、离子结合型果胶及共价结合型果胶含量,从而使枣果皮蜡质层、表皮层、内表皮层的厚度增加,维持枣果皮较好的稳定性及延展性。综上所述,喷施CaCl2可显著降低鲜食枣‘伏脆密’的裂果率。

