活性碳酸镍的制备及其在光亮镀镍液除杂中的应用
吴双成
(甘肃省兰州市皋兰县石洞镇三厂52小区,甘肃 兰州 730299)
镀镍溶液中Zn2+的质量浓度为20 ~ 60 mg/L时,镀层光亮而发脆,大于60 mg/L时则低电流密度区呈灰黑色,严重时出现黑色条纹、针孔及发脆[1]。因此,镀镍溶液中Zn2+的质量浓度应控制在60 mg/L以下。硫酸盐体系镀镍液中的锌杂质主要来源于原料(如硫酸镍)、含锌活性炭,以及落入槽内的锌铝合金压铸件和黄铜件。尤其是锌合金压铸件基体在滚镀镍前一定要先镀铜底层,再浸泡于10%(质量分数)硫酸中2 min,直至表面无溶解冒泡现象为止。
通常采用沉淀法去除镀镍溶液中的 Zn2+杂质,但该法会损失大量镍盐,效率不高,需多次处理。另外镀液pH > 4时,镀层易出现针孔和麻点,加之电沉积出的锌容易重新溶解于镀液中,因此在沉淀法处理后还应采用低电流密度电解法进一步除杂。活性碳酸镍载体吸附法[2-4]是一种特殊的沉淀法,该法采用比表面积较大的NiCO3作为载体,令镀液中的Zn2+吸附于其上,并反应生成ZnCO3沉淀,再过滤去除Zn2+杂质。该法不仅除锌效率高(理论上一般在 98%以上),还能同时去除镀液中的铜、铅等其他金属杂质。然而市售碳酸镍晶体活性较差,实际的除锌效率仅 34%左右,并且需要重复处理数次才见效。因此一般的做法是:在除杂处理前制备新鲜的活性碳酸镍,保证其结构疏松,具有较大的体积和比表面积,以及高含水量。
活性碳酸镍以硫酸镍和碳酸钠为原料制备而得。本文主要对制备活性碳酸镍的反应机制、原料和工艺参数控制及活性碳酸镍在镍镀液除锌杂质中的应用进行简要探讨。
1 制备活性碳酸镍的基本原理
碳酸钠与硫酸镍反应的产物除了碳酸镍外,还有 NiCO3·Ni(OH)2、NiCO3·Ni(OH)2·4H2O、2NiCO3·3Ni(OH)2·4H2O等多种碱式碳酸镍,统称为活性碳酸镍或碱式碳酸镍[3]。因此活性碳酸镍是由不定数量的碳酸镍、氢氧化镍和水分子组成的复合物[5],其分子式可用xNiCO3·yNi(OH)2·zH2O表示,具体组成与制备溶液的pH有关,pH < 10时以NiCO3为主,pH > 10时以Ni(OH)2为主。相关反应如式(1)-(4)所示。从中可知,1 mol Na2CO3与1 mol NiSO4·7H2O反应可生成1 mol活性碳酸镍,但无法准确计算出活性碳酸镍的质量,只能根据生产实际测知。

参考国内相关发明专利[6],在pH为6.0 ~ 7.2的氯化镍溶液中加入碳酸钠溶液,通过控制碳酸钠溶液的流量,将反应体系的pH调到8.5 ~ 9.5之间,搅拌反应后获得碱式碳酸镍粗品。将碱式碳酸镍粗品依次进行陈化、洗涤、烘干及筛分,获得比表面积大、粒径大的活性碱式碳酸镍。该法不但提高了反应速率,还避免了反应过程中出现“冒槽”(指溶液溢出槽外)现象。
图1所示为普通碳酸镍(NiCO3)和活性碱式碳酸镍[NiCO3·2Ni(OH)2·4H2O]的外观。

图1 普通碳酸镍(a)和活性碱式碳酸镍(b)的外观Figure 1 Appearance of common nickel carbonate (a) and active basic nickel carbonate (b)
2 活性碳酸镍的制备
2.1 原料
2.1.1 硫酸镍
硫酸镍又名硫酸亚镍,有无水物、六水物和七水物3种,其中的结晶水数量主要与制备时的结晶温度有关。在31.5 °C以下结晶所得为七水合硫酸镍,绿色、透明状,较易风化;31.5 ~ 53.3 °C内结晶所得为六水合硫酸镍,是蓝色或翠绿色的细粒结晶体;硫酸镍在103.3 °C时失去6个结晶水,在278.4 ~ 280.0 °C会失去全部结晶水,无水硫酸镍为黄绿色结晶体,在840 °C时开始分解,释放出三氧化硫,转变为氧化镍。从理论上来说,我国大部分地区的年平均气温都低于31.5 °C,所以硫酸镍更应该以七水合物为主,那种以六水合物为主的说法不太合理。国内北方的镀镍溶液配方及化验单一般注明为 NiSO4·7H2O,南方则都是注明为NiSO4·6H2O。这不仅给南北方技术交流带来误会,还给同一地区的不同电镀厂带来困惑。如化验单写的是NiSO4·7H2O,但在配制镀液时的用量却是按NiSO4·6H2O来计算的。
2.1.2 碳酸钠
碳酸钠,俗名苏打、纯碱、洗涤碱、块碱、口碱(历史上,一般经张家口和古北口转运全国,故有此一说)和碱面(食用碱)。碳酸钠晶体有Na2CO3·H2O、Na2CO3·7H2O和Na2CO3·10H2O三种,在空气中很容易失去结晶水,使表面失去光泽,渐渐碎裂成粉末,最终转变为无水碳酸钠。Na2CO3长期暴露在空气中能吸收水分和二氧化碳而生成碳酸氢钠,并结成硬块。
2.2 制备过程
首先计算出Na2CO3和NiSO4·7H2O用量。用热水溶解食品级或工业级Na2CO3,配成1%的水溶液,待用;另用热水溶解工业级硫酸镍,配成1% ~ 2%的水溶液。在强烈搅拌下,将硫酸镍水溶液缓缓加入Na2CO3溶液中(不可颠倒而为),然后用吸管吸出上清液(主要含Na2SO4),接着洗涤沉淀物2次,将沉淀装入涤纶布袋内,离心脱水便得到活性碳酸镍。
由于活性碳酸镍是由不定数量的碳酸镍、氢氧化镍和结晶水组成的复合物,因此无法准确计算出 1 kg NiSO4·7H2O能够制得多少活性碳酸镍,但根据生产实际测算,1 kg NiSO4·7H2O大约能够制得0.376 ~ 0.446 kg活性碳酸镍。
2.3 注意事项
(1) 制备活性碳酸镍所用Na2CO3和NiSO4溶液的浓度一定要低,反应温度一般30 ~ 35 °C为佳。若反应物浓度高、反应温度高,则反应过快,得到的碳酸镍颗粒大,吸附效果差。
(2) 实际制备活性碳酸镍时,将Na2CO3和NiSO4的质量比控制在1.5∶1左右,碳酸钠用量比理论用量高许多(约为4倍)有利于生成比表面积大、结构疏松和体积庞大的活性碳酸镍。
(3) 应边搅拌边缓缓地将NiSO4溶液加入Na2CO3溶液中,不可反过来操作,否则反应过于激烈,可能出现“冒槽”现象。
(4) 制成的活性碳酸镍应及时使用,存放时间不宜过长(一般不要超过半年),否则将影响其活性。可能原因有两点:一是“陈化”会使NiCO3晶体由疏松变得紧凑,比表面积减小,吸附作用减弱;二是活性碳酸镍吸收了空气中的二氧化碳,其中的Ni(OH)2含量降低,碱性减弱。
3 活性碳酸镍在硫酸盐体系镀镍液除锌杂质中的应用
3.1 吸附除杂原理
碳酸镍和碳酸锌的溶度积[7]分别为6.6 × 10-9和1.4 × 10-11,镀液中加入活性碳酸镍后存在多种平衡,如式(5)-(7)所示。
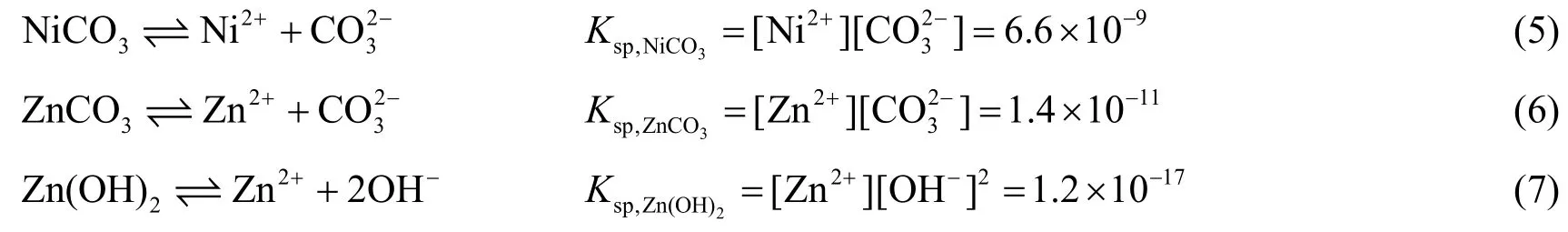
若发生Zn(OH)2与ZnCO3共沉淀,则溶液中Zn2+浓度相同,即:

碳酸镍转化为碳酸锌的反应(NiCO3+ Zn2+= ZnCO3↓+ Ni2+)的平衡常数为:
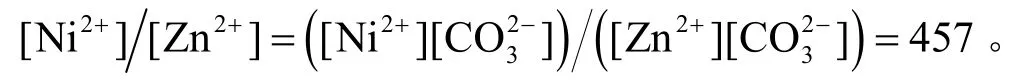
即[Zn2+]/[Ni2+]= 1/457 = 0.002 19。
如果镀液中NiSO4·7H2O质量浓度是280.88 g/L,即[Ni2+]= 1 mol/L,NiSO4的活度系数是0.042 5,则Ni2+的有效浓度为0.042 5 mol/L,而Zn2+的浓度为0.002 19 × 0.042 5 mol/L = 9.3 × 10-5mol/L。可见镀液中加入适量活性碳酸镍时,理论上可以将Zn2+的质量浓度降到9.3 × 10-5mol/L × 65.39 g/mol × 103= 6.1 mg/L。
如果镀液中NiSO4·7H2O的质量浓度是350 g/L,即[Ni2+]= 1.246 mol/L,根据活度系数随浓度增大而减小的趋势,取硫酸镍的活化系数为0.04进行近似处理,那么Ni2+的有效浓度为1.246 × 0.04 = 0.049 8 (mol/L),Zn2+的浓度为0.002 19 × 0.049 8 = 1.1 × 10-4(mol/L)。这说明加入适量活性碳酸镍时,理论上可以使Zn2+的质量浓度降到 1.1 × 10-4mol/L × 65.39 g/mol × 103= 7.1 mg/L。
显然,活性碳酸镍处理能有效去除镀镍溶液中的Zn2+。在实际生产中,为了确保Zn2+降到60 mg/L以下,需进一步在低电流密度下电解处理镀液。
活性碳酸镍净化镀镍溶液不仅能去除Zn2+,还能去除Cu2+、Fe3+、Pb2+等杂质金属离子。如预镀镍中含有Zn2+100 mg/L、Cu2+20 mg/L和Pb2+10 mg/L时,先把镀液pH调至6.2,加入2.5 g/L活性碳酸镍,搅拌均匀后静置6 h,Zn2+的质量浓度降至0.9 mg/L,去除效率高于98%,Cu2+和Pb2+的质量浓度分别降低至0.37 mg/L和2.7 mg/L。
3.2 注意事项
(1) 活性碳酸镍吸附镀镍液中金属杂质的适宜pH约为6.2,温度为40 ~ 50 °C,加入活性碳酸镍后的数小时内完成过滤。
(2) 镀镍溶液中锌含量低于0.1 g/L时,活性碳酸镍加入量以0.5 ~ 1.0 g/L为宜;镀镍溶液中锌的质量浓度高于 0.1 g/L时,活性碳酸镍加入量增大到 1.0 ~ 2.0 g/L。剩余的活性碳酸镍可用硫酸溶解,再加入少量Na2CO3中和,留作下次制备活性碳酸镍时使用。
(4) 可以在搅拌条件下将碳酸钠粉末直接撒入镀镍溶液中,但要注意少量多次撒入,并且充分搅拌,在镀液中原位生成的活性碳酸镍同样可以除去Zn2+、Cu2+、Fe2+、Pb2+等杂质离子,如此可省去另外制备活性碳酸镍的麻烦。

