热灭活处理对新型冠状病毒鼻咽拭子核酸检测质量的影响
曹娴 浦晓红 许晔琼 赵一琳 俞建峰 陈洁 宛传丹
作者单位:215500 江苏常熟,常熟市医学检验所质量管理科
冠状病毒一直以来严重影响着人类健康,该类病毒遗传特征复杂,在进化过程中易发生重组与变异。目前研究表明,能感染人类的冠状病毒多达十几种。2019 年12 月底首次出现未明病毒呼吸道感染病例[1],2020 年1 月初,我国科学家鉴定出新型冠状病毒(2019 novel coronavirus,2019-nCoV)并对其进行全基因组测序,揭示该病毒为新型冠状病毒肺炎(新冠肺炎)的致病原因[2]。冠状病毒属病毒是遗传物质最大的正链单股RNA 病毒,基因功能研究显示,2/3 的基因用于编码非结构蛋白,行使病毒复制酶与翻译调控等功能,如ORF1ab 为RNA 依赖的RNA 聚合酶基因;其余基因编码S、M、E 与N 蛋白,N 蛋白识别基因组折叠包装[3]。2019-nCoV 非结构蛋白基因较保守,结构蛋白基因易发生变异,造成新冠肺炎与往年严重急性呼吸综合征(severe acut respiratory syndrome,SARS)等感染性疾病在流行病学与临床诊断治疗上存在差异[4]。2019-nCoV传染性极强,主要通过呼吸道飞沫、接触传播以及气溶胶近距离传播,短时间内在我国各地区和境外出现大量感染病例[5]。国际病毒分类委员会将2019-nCoV 命名为严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)[5]。按照《中华人民共和国传染病防治法》规定,将新冠肺炎列为乙类传染病,按甲类传染病预防和控制[6]。截至2022 年5 月,全球累计确诊病例已超1.6 亿名,超过380 万例死亡病例[7]。2019-nCoV 传染性强,人群普遍易感,且由其急性感染造成的新冠肺炎目前尚无特效药治疗方案[8]。早期诊断和及时采取防控措施是阻止新冠肺炎疫情蔓延的关键,因此对各地标本采集、核酸筛查与医护和社区人员的安全管控能力提出了较高的要求。本研究针对2019-nCoV 核酸早期筛查标本的实验室前期处理灭活环节进行调查研究,优化大规模检测标本的处理流程,为2019-nCoV 核酸标本的高效检测提出合理建议,现将结果报告如下。
1 资料与方法
1.1 标本来源 按照二级生物安全实验室管控要求,对2019-nCoV 阳性标本的处理应严格执行三级个人防护措施。本研究采用购买的室内质控品来模拟临床阳性标本的检测过程,评估和分析热灭活处理前后以及不同待检时长(2 h、8 h、24 h、48 h)对2019-nCoV ORF1ab 基因和N 基因双重荧光反转录聚合酶链反应(reverse transcriptase polymerase chain reaction,RT-PCR)结果循环阈值(cycle threshold,CT 值)的影响。
1.2 仪器与试剂 ABI 7500 实时荧光PCR 检测仪(美国应用生物系统ABI 公司),SAW-96 全自动核酸提取仪(硕世生物科技股份有限公司),DHP-9032电热恒温箱(上海一恒科学仪器有限公司),HFsafe-1200LCBB2 生物安全柜(上海力申科学仪器有限公司)。KDC-40 低速离心机(安徽中科中佳科学仪器有限公司)。2019-nCoV 核酸标本前处理室配置3 台干热烤箱和3 台生物安全柜,用于分捡标本。各实验室分区设备:Ⅰ区:超净工作台1 台,移液器1 套(1~10 μL,20~200 μL,100~1 000 μL),微量离心机、小型振荡器、冰箱3 台;Ⅱ区:生物安全柜2 台,全自动核酸提取仪4台,移液器1套(1~10 μL, 20~200 μL,100~1 000 μL),8 通道移液器(5~50 μL),冰箱4台,振荡器2个,移动消毒车2台,洗眼器1个;Ⅲ区:平板离心机2 台,实时荧光PCR 检测仪6 台,移动消毒车1 台。耗材实验室配置对讲机,有问题实时沟通。
1.3 标本分组 以室内质量控制(质控)品标本(邦德胜生物科技公司;核酸浓度1 000 个拷贝/mL)作为阳性标本,分装后分为未灭活组(20 份)与热灭活组(30 份)。根据提取前处理方法不同,未灭活组分为未灭活组1(解冻后即刻提取)、未灭活组2(30 min)、未灭活组3(60 min)、未灭活组4(120 min),每组5 份标本;热灭活组分为热灭活组1(56 ℃,30 min)、热灭活组2(56 ℃,60 min)、热灭活组3(56 ℃,120 min),每组10 份标本,记录各组标本核酸扩增曲线的CT 值。
1.4 核酸提取和扩增检测 使用全自动核酸提取仪及配套扩增检测试剂,采用磁珠快速抽提法提取核酸,扩增检测靶基因为2019-nCoV ORF1ab 基因与N 基因,采用双重RT-PCR 法进行检测分析。
1.5 RT-PCR 扩增反应 配制反应体系:扩增反应液7.5 μL,酶混合液5.0 μL,2019-nCoV 反应液4.0 μL,去RNA 酶水3.5 μL,总体积20 μL。扩增检测循环参数为反转录反应,50 ℃ 10 min,预变性97 ℃ 1 min,变性97 ℃ 5 s,退火、延伸及检测荧光58 ℃ 30 s,共45 个循环。
1.6 统计学分析 采用SPSS 22.0 软件进行统计分析。对2019-nCoV 中ORF1ab 基因和N 基因扩增均呈典型阳性扩增曲线的标本记录CT 值,取平均值进行分析。采用单因素方差分析考察各组CT 值的一致性。P<0.05 为差异有统计学意义。
2 结果
2.1 热灭活对2019-nCoV 核酸稳定性的影响 除加热灭活,其他条件与未灭活组处理一致。同时提取,未灭活组与热灭活组1、2、3 的ORF1ab 基因和N 基因扩增检测结果CT 值比较差异有统计学意义(F=19.256,P<0.05),两两比较显示热灭活时长可对RNA 核酸扩增曲线CT 值造成显著影响。见表1。
表1 未热灭活组与热灭活不同处理后样本的ORF1ab 基因CT 值比较(±s)
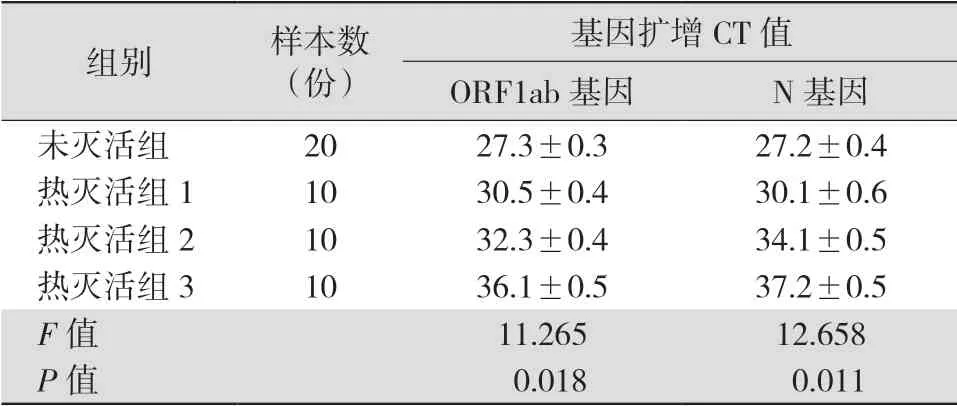
表1 未热灭活组与热灭活不同处理后样本的ORF1ab 基因CT 值比较(±s)
注:热灭活组1 为56 ℃下灭活30 min,热灭活组2 为56 ℃ 下灭活60 min,热灭活组3 为56 ℃下灭活120 min;CT 值为循环阈值
组别 样本数(份)基因扩增CT 值ORF1ab 基因 N 基因未灭活组 20 27.3±0.3 27.2±0.4热灭活组1 10 30.5±0.4 30.1±0.6热灭活组2 10 32.3±0.4 34.1±0.5热灭活组3 10 36.1±0.5 37.2±0.5 F 值 11.265 12.658 P 值 0.018 0.011
2.2 未灭活组不同待检时长2019-nCoV 核酸检测结果比较 为评估RNA 经过不同待检时长的稳定性,以室内质控品在未热灭活条件下,模拟在不同待检时间(2 h、8 h、24 h、48 h)内2019-nCoV 阳性样本核酸检测结果CT 值的影响。未灭活组待检时长在48 h 内,不同待检时长样本检测结果的CT 值差异无统计学意义(P>0.05)。见表2。
表2 不同待检时长下未灭活标本检测CT 值(±s)

表2 不同待检时长下未灭活标本检测CT 值(±s)
注:CT 值为循环阈值
待检时长样本数(份)基因扩增CT 值ORF1ab 基因 N 基因2 h 5 28.3±0.5 26.5±0.3 8 h 5 29.5±0.3 27.3±0.4 24 h 5 29.4±0.3 27.1±0.5 48 h 5 30.2±0.7 28.7±0.7 F 值 1.717 5.864 P 值 0.106 0.117
2.3 热灭活处理对不同浓度2019-nCoV 核酸样本的影响 为研究样本前处理对不同浓度核酸样本检测的影响,将定值高浓度室内质控品(5×105个拷贝/mL)以1∶1 000 稀释至理论值(5×102个拷贝/mL),再以热灭活方式进行处理,扩增检测结果显示,热灭活处理对两种浓度水平的2019-nCoV 核酸稳定性均有显著影响,而对低浓度2019-nCoV 核酸稳定性影响更大。见表3。5×102个拷贝/mL 是本实验室病毒核酸检出限,如果给予热灭活处理,将影响低浓度临床标本的阳性检出率。

表3 热灭活处理对不同浓度水平核酸的影响
3 讨论
实验室检测是确认2019-nCoV 感染的重要依据。病毒核酸检测,特别是RT-PCR 检测技术是目前2019-nCoV 病原学检测的首选方法[9],因其能高效快速进行大范围筛查,具有较高的敏感度与特异度。核酸检测是疫情常态化管理的重要措施。但由于病毒RNA 极易在体外降解,因此RNA 病毒极易受外境环境因素的影响,其检测结果会受到样本采集、运输分检、灭活处理、核酸提取与核酸扩增检测等多环节和因素的影响。核酸样本原则上在检测前需进行灭活处理。在整个核酸检测过程中,质控尤为重要,检测试剂的性能验证、室内质控以及人员的检验操作均应按照相关标准操作规程进行,但标本的生物安全前期灭活处理对检测结果是否产生影响尚未经过系统论证。因此,在生物安全高要求的前体下,需要对核酸检测实验室2019-nCoV 的样本转运、灭活处理进行充分认识与评估,以确保后期检测质量的可靠性。
本研究针对本实验室采取烤箱干浴热灭活方式以及实际标本量在实验室可能的待检时长对后期核酸检测结果的影响进行充分评估与论证,确保本实验室能在满足生物安全要求的前提下,准确高效地检测2019-nCoV。对比实验表明,56 ℃ 30 min 以上会对核酸稳定性产生显著影响,热灭活时间越长,核酸扩增检测结果CT 值差异越显著。虽然某些保存管中含有RNA 保护剂、病毒灭活酶等,使病毒核酸在一定温度范围内能保持稳定。但是, 大多数RNA酶在56 ℃仍保持活性,对病毒RNA 具有破坏性,而达到56 ℃才能消除病毒的传染活性[10]。为研究热灭活的主要影响因素,考察未灭活组在不同转运待检时长下核酸的稳定性,结果显示48 h 内待检时长不会显著影响核酸扩增检测结果的CT 值。进一步分析不同病毒载量(核酸浓度)标本对热灭活处理的敏感度,结果显示可能存在差异。分组处理显示,低值标本灭活后,待测时长超过8 h,将导致检测结果严重不稳定,甚至出现假阴性结果(如本研究中存在阳性标本CT 值检测不出的情况)。因此,在临床检测实际操作中,一定要注意热灭活时长对低浓度标本的影响。采取其他防控方式以取代热灭活处理,加强实验室防护,尽可能不进行热灭活处理,以筛查出感染者,防止漏检。
疫情防控应本着早发现、早诊断、早隔离、早治疗的原则[11]。当前新冠肺炎疫情防控进入常态化阶段,本着“应检尽检、愿检尽检”的原则,及时准确检测样本有利于及时发现无症状感染者,确认疑似病例,控制可能的散发病例和境外输入病例,防患于未然。采用RT-PCR 技术对2019-nCoV 进行病原学检测是新冠肺炎确诊的主要方法和依据[12]。新冠肺炎疫情暴发突然,之前很多厂家在检测试剂盒性能验证上把控不严,行业内也缺乏标准流程。各地实验室现有配置条件多数不能满足三级生物安全设施的要求。为更好地控制疫情蔓延,必须要做好病毒病原学检测的第一道关。升级生物安全防范但也不能降低核酸检测质量,这就要求对2019-nCoV标本处理的每一个环节做好性能质量评估,将影响病毒RNA 的因素降到最低,提高实验室检测能力,为疫情防控提供精确数据。
利益冲突所有作者均声明不存在利益冲突

