乙烯利诱导对3个菠萝栽培品种花芽分化形态与内源激素含量的影响
邓 彪,蔡昭艳,王小媚,董 龙,徐 健,刘业强,韦巧云,方位宽,任 惠,苏伟强,邱文武,黄章保,黄辉晔
(1 广西壮族自治区农业科学院园艺研究所/农业部南宁南亚热带果树科学观测实验站,南宁,530007;2 广西南亚热带农业科学研究所,广西龙州,532415;3 广西壮族自治区农业科学院植物保护研究所,南宁,530007)
菠萝Ananascomosus(Linn.)Merr.又称凤梨,是凤梨科凤梨属多年生草本果树,在热带水果生产和贸易中的地位仅次于香蕉和杧果[1]。我国是菠萝生产大国,菠萝一直以来作为我国热带、南亚热带特色高效果树发展,是农民重要的经济来源。但至今大陆地区无自主知识产权的菠萝鲜食新品种,原有的主栽品种“巴厘”仍占全国菠萝栽培总面积的80%以上。由于品种结构单一,产期集中,种性退化严重,且叶缘分布密刺,果眼深,蛋白酶含量高,不利于生产操作和消费者食用,市场竞争优势不明显,价格起伏较大,产业低迷徘徊[2]。随着市场对菠萝品种多样化和差异化需求的提升,自21世纪初以来,大陆地区先后从我国台湾、美国引进“台农16号”“台农17号”“金菠萝”等优良新品种[3-4]。这些品种鲜食肉质细嫩,风味浓,贮运性强,叶片无刺或仅叶尖有刺,田间操作方便,综合品质优,深受广大种植者和消费者欢迎,已经逐渐占据鲜食菠萝市场,栽培面积逐年扩大,市场潜力广阔。
试种及推广这3个菠萝品种发现,当植株达到一定营养生长量后,喷施乙烯利诱导开花时,由于其对乙烯利的敏感性存在较大差异,导致开花时间不一致和开花率低等问题,严重影响了品种产量和品质。菠萝开花受品种、植株营养状况、环境条件等因素影响,催花成功率又影响品种产量和产值,催花也是保证菠萝按照预期目标集中上市的有效途径[5]。现有相关报道探究了乙烯利催花对凤梨科不同属的粉菠萝、无刺卡因、丹尼斯和空气凤梨等品种内源激素含量的影响,激素含量变化不一致[6-9],主要由于不同种属对乙烯利的敏感性差异所致[10]。目前国内缺乏“台农16号”“台农17号”“金菠萝”乙烯利诱导后花芽分化形态和内源激素含量变化研究。因此,我们开展此项研究,以探究3个菠萝品种成花机理,为菠萝生产上实现乙烯利周年稳定高效催花提供参考。
1 材料与方法
1.1 材料
在广西崇左市龙州县彬桥镇菠萝品种比较试验示范基地,选择定植苗木规格、定植时间、田间管理相同且植株生长势一致的“台农16号”“台农17号”“金菠萝”3个菠萝品种12月龄植株供试。40%乙烯利水剂,上海彭浦化工厂生产;脱落酸(ABA)、吲哚乙酸(IAA)、玉米素(ZT)标样由Sigma公司提供;C2H4标样浓度为100 mg/L,由上海伟创标准气体有限公司提供。
1.2 方法
2018年9月28日3个品种分别每株使用40%乙烯利500倍液+1%尿素混合溶液50 mL灌心处理诱导催花,以1%尿素为对照,重复3次,处理后观察3个菠萝品种花芽分化形态,并测定不同内源激素含量。即诱导催花后每隔2 d取样1次,每个品种每次取长3 cm茎尖3个,分别置于70% FAA固定液固定,制作石蜡切片观察茎尖顶端分生组织花芽分化。诱导催花后每4 d分别对茎尖顶端分生组织取样,置于液氮中保存,每个品种重复取3株,测定脱落酸(ABA)、吲哚乙酸(IAA)、反式玉米素核苷(TZR)及乙烯前体1-氨基环丙烷羧酸(ACC)含量。其中,ABA、IAA、TZR含量测定采用异丙醇-水-盐酸提取方法,使用安捷伦1290高效液相色谱仪串联AB Qtrap 6500质谱仪测定含量。ACC以水提取样品,使用waters ACQUITY UPLC高效液相色谱仪串联Xevo TQ质谱仪测定含量。
1.3 数据分析
利用Excel 365软件计算处理数据,用Adobe Illustrator CC 2017作图并修正。
2 结果与分析
2.1 顶端分生组织形态变化
由图1看出,乙烯利处理后,在花芽未分化期,茎尖呈细圆锥状,周围被黄白色嫩叶包裹,未出现花芽分化。在花芽分化初期,茎尖顶端分生组织基部逐渐膨大,开始形成花芽,整个花序呈穗状,花序轴由基部向顶部、由外至内不断分化出多个花芽。在小花分化期,茎顶端组织基部变圆,钝圆形苞片顶部呈红色,茎伸长更加明显,花序基部第1轮先发育的花芽形成苞片、花萼、花瓣、雄蕊、子房等器官[11]。

图1 乙烯利诱导催花后菠萝顶端花芽形态变化
2.2 不同品种花芽分化
由图2看出,乙烯利处理后,菠萝花芽分化进程可为花芽未分化期、花芽分化初期、小花分化期3个阶段[11],诱导催花后3个菠萝品种花芽分化时间存在差异。处理后0~6 d为“金菠萝”花芽未分化期,8~18 d为花芽分化初期,20~36 d为小花分化期;处理后0~12 d为“台农16号”花芽未分化期,14~24 d为花芽分化初期,26~36 d为小花分化期;处理后0~10 d为“台农17号”花芽未分化期,12~22 d为花芽分化初期,24~36 d进入小花分化期。3个品种的花序形成时间从早到晚依次为“金菠萝”“台农17号”“台农16号”。“金菠萝”进入花芽分化初期历时最短,诱导处理后6 d开始形成花序原基,向花芽分化初期阶段发展,而“台农17号”“台农16号”进入花芽分化初期分别经历了10 d和12 d。

图2 乙烯利诱导催花后3个菠萝品种花芽分化过程
2.3 花芽分化的细胞学观察
由图3看出,乙烯利处理0 d,3个菠萝品种植株茎尖顶端生长点小、窄,周围被叶原基包裹,处于花芽未分化状态。处理后10 d,“金菠萝”顶端生长点变宽,周围分化出圆球状突起,形成了花原基;“台农17号”顶端生长点也开始变宽,周围的叶原基停止发育,花原基开始形成;“台农16号”顶端生长点慢慢变宽,叶原基还没停止发育,未见花原基的出现。处理后18 d,“金菠萝”花序轴逐渐伸长,顶端生长点继续膨大,在其基部分化出苞片原基并形成苞片,苞片叶腋处包裹的花原基开始分化;“台农17号”“台农16号”也可见苞片和没有分化的花原基。处理后36 d,“金菠萝”花序基部先发育的花原基,已经分化出形态分明的花萼、花瓣、雌雄蕊,形成了完整花器官,花序顶部已分化出冠芽原基;“台农17号”花序基部先发育的花原基也分化出花萼、花瓣、雌雄蕊,子房顶部凸起显现,上端靠近顶端生长点附近的花原基正进入小花分化期,花腔呈现初步轮廓;“台农16号”菠萝花序基部先发育的花原基分化出花萼、花瓣、雌雄蕊,子房发育不明显,上端靠近顶端生长点附近的花原基仍有少量还在花芽分化期。

图3 乙烯利诱导催花后3个菠萝品种花芽分化形态
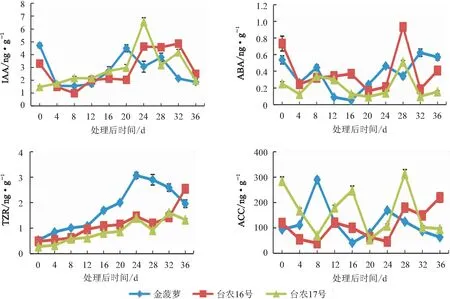
2.4 内源激素含量变化
2.4.1 吲哚乙酸(IAA)含量变化 由图4看出,乙烯利处理后36 d,3个品种顶芽生长点IAA含量较低,“金菠萝”“台农16号”顶芽生长点IAA含量较未处理前明显降低,而“台农17号”顶芽生长点IAA含量保持平缓,此时期芽生长点显微结构显示,3个品种正处于由营养生长向生殖生长的转变期。在花芽分化初期,3个品种顶芽生长点IAA含量逐渐上升;“金菠萝”“台农16号”“台农17号”分别在处理后20 d、24 d、24 d达到第一个峰值,此时正处于向小花分化期转变。在小花分化期,3个品种顶芽生长点IAA含量均有所降低,随后升高,最后降低至未分化期的水平。3个品种AA含量变化规律基本一致。
2.4.2 脱落酸(ABA)含量变化 由图4看出,乙烯利处理后,3个菠萝品种顶芽生长点ABA含量均波动较大,根据不同品种的花芽分化时间不同,ABA含量变化趋势与花芽分化过程基本一致。从花芽未分化进入花序分化期的0~4 d,3个菠萝品种顶芽生长点ABA含量均较未处理前明显降低;在未分化期后期开始形成花原基后,ABA含量水平小幅升高;第一层花原基均形成后,开始降低,直至进入花芽分化初期ABA含量水平降至最低点并保持基本不变,“金菠萝”“台农16号”“台农17号”分别在处理后12~16 d、20~24 d、16~20 d ABA含量降至最低;花芽分化初期快结束时,3个菠萝品种花芽分化均处于花原基膨大期。整体来说,ABA含量在此之前都处于较低水平,在随后的小花分化期,3个菠萝品种ABA含量才呈现较大的上升趋势,直至花器官逐渐成熟,ABA含量又变至未分化期的水平。
2.4.3 反式玉米素核苷(TZR)含量变化 由图4看出,乙烯利处理后,3个菠萝品种的顶芽生长点TZR含量变化显著,不同品种间变化趋势表现一定差异。3个品种的TZR含量均逐渐升高,处理后24 d,TZR含量达到峰值,此时“金菠萝”已经进入小花分化期,花器官进行分化和发育,而另外2个品种为花芽分化初期向小花分化期的过渡时期;随后“金菠萝”TZR含量一直降低,“台农16号”小幅降低后又迅速升高,而“台农17号”变化波动较大,表现为降低后升高再降低。整体来说,3个品种花芽分化开始后的TZR含量均高于未分化期,其中“金菠萝”的TZR含量显著高于其他2个品种,处理后16~32 d差异极显著,且比其他2个品种波动小。
2.4.4 1-氨基环丙烷羧酸(ACC)含量变化 由图4看出,乙烯利处理后,3个菠萝品种顶芽生长点ACC含量变化波动较大,基本呈“下降后上升再下降再上升后下降”的趋势。0~4 d,“金菠萝” 顶芽生长点ACC含量变化不大;0~8 d,“台农16号”“台农17号”顶芽生长点ACC含量降低,均为花芽未分化期;而后3个品种分别在4~8 d、8~12 d、8~16 d,ACC含量迅速增加出现第一个峰值,为向生殖生长转变的阶段,其后在花芽分化初期结束时ACC含量降至最低。“金菠萝”“台农16号”“台农17号”的ACC含量分别在处理后24、28、28 d出现第二个峰值,此时花分生组织进一步分化为不同的花器官,之后花器官的发育过程中ACC含量降低。
注:ABA、 IAA 、TZR 、ACC分别为脱落酸、吲哚乙酸、反式玉米素核苷及乙烯前体1-氨基环丙烷羧酸。图5同。
2.4.5 内源激素比值变化 由图5看出,ACC/IAA和ACC/ABA的比值变化比较相似,在花芽分化前期3个品种间差异较大,中后期降低后慢慢平稳。ACC/TZR、IAA/TZR和ABA/TZR三者的变化比较相似,花芽分化开始后迅速降低并保持,“金菠萝”一直变化不大,而另外两个品种出现不同程度的波动。在花芽分化前期3个品种的IAA/ABA较为一致,与3个品种花芽分化过程一致,“金菠萝”在第8天开始迅速升高,第12天“台农17号”,第16天“台农16号”均迅速升高,3个品种在花芽分化初期结束时均迅速降低;随后“金菠萝”的IAA/ABA变化不大,而另外两个品种出现较大波动。

图5 乙烯利诱导催花后3个菠萝品种顶芽生长点4种内源激素含量比变化
综合来看,花芽花器官形态形成时期,“金菠萝”较另外2个品种稳定,“台农16号”和“台农17号”都出现不同程度地波动。
3 结论与讨论
本试验中,乙烯利诱导催花后,观察“金菠萝”“台农16号”“台农17号”3个菠萝品种茎尖顶端分生组织花芽分化过程的解剖学形态,进一步证实了3个菠萝品种花芽分化时序和分化质量存在差异性[6,9]。研究发现,3个品种中,金菠萝”花序形成最早,其次为“台农17号”,“ 台农16号”最晚,本研究结果与生产上诱导催花后3个菠萝品种现红抽蕾时序一致[4,12]。试验发现,3个菠萝品种花芽分化质量也存在差异性,诱导催花后第36天,“金菠萝”花序轴两侧基部最先发育的第1轮小花对称、整齐、大小基本一致;而“台农16号”和“台农17号”花序轴两侧基部的第1轮小花多数呈现不对称、不整齐、大小不一致的情况,由此轮花向上且在花序轴两侧相同位置的小花均出现这种情况。菠萝同层花序分化质量差异可能是造成后期菠萝聚合果果眼发育不对称、不整齐、大小不一致的原因。
目前已证实乙烯是唯一能直接启动菠萝生殖生长的内源激素,可以通过乙烯利诱导菠萝内源乙烯的生物合成。由于ACC是乙烯合成的前体物质,乙烯生物合成的调节依赖于ACC 的含量及组织转化ACC释放乙烯的能力[13],因而ACC 含量变化能直接反映植物体内乙烯含量的变化[14],乙烯诱导菠萝开花已是共识[15]。以往研究中,ACC或乙烯含量变化在多个菠萝品种催花后基本一致,均表现为升高[16],且与乙烯相关的合成前体物质也会迅速升高[17]。本研究中,3个菠萝品种在花芽未分化期的ACC含量表现出不升反降的情况,可能是诱导处理后外源大量乙烯利进入组织细胞与乙烯受体结合,且释放乙烯需要一个过程;而受植物生长调节剂刺激向生殖生长转变时,ACC含量迅速升高,促进花原基的形成,并在花芽分化初期,也就是第一轮花原基全部形成后降至最低;在诱导处理后24、28、28 d分别出现第二个峰值,说明花器官分化和形成需要较高含量的ACC,随后花器官发育时期ACC含量降低;“台农16号”因为花芽分化的时序较慢,可能诱导处理后36 d并未完成花器官分化,从而ACC还未降低。结果表明,高水平的ACC含量主要促进花原基形成和花器官分化,而在整个花芽分化时期ACC含量有波动,并不一直维持高水平。
IAA参与植物多个生长和发育过程[18],对植物花芽分化的影响比较复杂,一般低浓度的IAA对花芽分化起促进作用,高浓度的IAA对花芽分化起抑制作用,但不同植物对IAA的敏感程度不一致 ,在一些植物中促进和抑制的程度也不一样[19-21]。本研究中,IAA含量有降低再升高后降低的过程,较低水平的IAA含量促进菠萝进入花芽分化,逐步升高的IAA可以促进花原基形成,进一步证明IAA可以激活花原基发育[22];达到最高水平后,不同花分生组织形成,有所降低但仍较高水平的IAA含量有利于花器官的形成发育,完成第一层小花的花芽分化,最后降低恢复至未分化时期的含量水平。
ABA与植物休眠相关,一般在休眠芽中ABA含量相对较高,也就是说高水平的ABA含量不利于植物进入花芽分化[23],但其促进和抑制花芽分化都有报道,对植物花芽分化的影响也比较复杂[24-26]。本研究中,在花芽未分化期、花芽分化初期ABA含量迅速降低后,迅速进入花芽分化,之后ABA的水平虽然有起伏,但波动不大,均保持较低水平,尤其花原基膨大期降至最低,促进菠萝进入花芽分化,有利于花原基形成,并向花分生组织转变;在小花分化期,较高水平的ABA含量有利于花器官的形成发育[27]。所以,IAA和ABA对菠萝花芽分化的作用是双重的,前期需要两者保持较低水平,后期花器官形态形成发育需要较高水平含量,随后降低至较低水平,这两种内源激素的变化比较相似。
TZR是CTK的活性形式,反映了植物体内细胞分裂和代谢的强度,大量研究表明其与开花成正相关,参与植物生殖生长,促进花芽分化[28-30]。本研究中,“金菠萝”TZR含量变化比较稳定,先升高后降低;而另外2个品种前期,也就是花原基形成时期,和“金菠萝”变化基本一致,一直呈升高趋势,但升高幅度明显低于“金菠萝”,小花分化期开始后,3个品种TZR含量出现不同变化。同时,3个品种花芽分化开始后,TZR含量一直高于未分化期。说明TZR含量升高对菠萝花芽分化整个过程都有促进作用,与花原基形成的数量成正相关,而进入小花分化期后,TZR含量会有所降低,花原基形成有所放缓,但花器官的分化和发育也需要ZTR保持较高含量。推测3个菠萝品种在小花分化期TZR含量变化不同,可能是影响菠萝最终成花质量的一个因素。
内源激素间互作共同影响植物生长发育,不同内源激素对植株开花的影响最终几乎都与乙烯相关,开花诱导最终受乙烯调控[31],植物内源激素间的平衡关系对植物生长发育调节作用显著[32-33]。本研究中,花芽花器官形态形成时期,“金菠萝”的6个内源激素含量比值较另外2个品种明显更稳定,“台农16号”“台农17号”都出现不同程度地波动。推测不同内源激素间的平衡稳定性影响菠萝花芽分化质量。

