一株枯草芽孢杆菌的分离鉴定及其体外降解AFB1的效果分析
高颖,张弘弢,陈媛媛
(黑龙江八一农垦大学,大庆 163319)
黄曲霉毒素(aflatoxin,简称AF)是主要由黄曲霉和寄生曲霉产生的次级代谢产物,是一种二氢呋喃香豆素的化学结构类似物,具有高致癌性。黄曲霉毒素耐热性强,在光、热等条件下以及酸、中性溶液中都较稳定,在强酸溶液中或氧化剂存在时少部分可发生分解[1]。目前,已分离鉴定出黄曲霉毒素B1、B2、G1和G2等20余种[2]。其中,黄曲霉毒素B1(AFB1)最为常见且毒性最强,它的毒性是氰化钾的10倍,砒霜的68倍。由于产生黄曲霉毒素的真菌在自然界中广泛存在,因而土壤、食品、饲料等受到污染的情况极为普遍[3-4]。
目前,传统的霉菌毒素脱毒方法主要包括物理法和化学法[5-7]。然而,这些方法在实际生产运用中存在诸多缺陷,如脱毒效率低下、易降低营养物质利用率、毒素二次污染、影响饲料适口性等;同时由于部分脱毒工艺昂贵,难以规模化量产,难以应用于实际生产[8-9]。因此控制霉菌毒素的污染急需一种高效率、特异性强以及对饲料和环境没有污染的技术。
近年来,利用微生物降解法去除AFB1已经成为较为安全有效的新方法,也是去除AFB1的新研究方向之一。微生物降解法不但处理条件温和,不会破坏产品品质,而且有些还能增加产品营养价值。研究从小鼠粪便中初筛分离到15株能够在初筛培养基生长良好的菌株,经复筛从中筛选到一株能够高效降解AFB1的菌株SM2,并对菌株SM2培养物的不同组分进行脱毒活性研究表明,不同组分对AFB1的降解率不同。上清液的脱毒能力最强,活菌体悬液脱毒能力下降明显,灭活菌体悬液脱毒能力最差,细菌培养上清液的脱毒效果与发酵液基本相同,无显著差异,由此确定枯草芽胞杆菌SM2的脱毒能力主要来源于上清液中的某种活性物质。试验结果可为在实践中使用枯草芽孢杆菌解决AFB1污染问题提供理论依据,同时为后续微生物脱毒制剂的开发奠定基础。
1 材料
1.1 菌株来源
从哈尔滨医科大学实验动物中心健康小鼠粪便分离获得。
1.2 试验试剂
普通营养肉汤(NB)培养基、MRS固体培养基、LB培养基,购自青岛海博生物技术有限公司;Ex Taq DNA聚合酶、Ex Taq Buffer、DNA Marker(2 000)、6×Loading Buffer、d NTP Mixture、溴化乙锭(EB)、琼脂糖,购自TaKaRa公司;引物,购自生工生物工程(上海)股份有限公司;增强革兰氏染色液,购自北京雷根生物技术有限公司;糖类生化反应管,购自青岛海博生物技术有限公司;细菌DNA提取试剂盒,购自北京天根生化科技有限公司;AFB1标准品,购自SIGMA公司;AFB1 ELISA检测试剂盒,购自青岛普瑞邦生物工程有限公司。
1.3 主要仪器
台式低速离心机(L3-5K)购自湖南可成仪器设备有限公司;高速台式离心机(1-14K型)购自SIGMA有限公司;PCR仪,电泳仪,电泳槽,紫外凝胶成像分析系统,购自美国BIO-BAD;电热恒温水浴锅(Hws24)购自上海一恒仪器有限公司;恒温培养箱(DHP-9272)购自上海一恒科学仪器有限公司。
2 方法
2.1 细菌的分离培养
初筛:适量采取健康小鼠的新鲜粪便,用生理盐水稀释至不同的浓度(10-1、10-2、10-3、10-4、10-5、10-6、10-7、10-8),取10-4、10-5和10-6三个浓度在平板上均匀涂布,以香豆素为唯一碳源,置于37℃常规恒温培养箱中培养,每组三个重复。每隔12 h进行挑菌操作,挑取生长较好的菌落,再于LB固体培养基上划线分离3次,重复此步骤4~5次,直至平皿中菌落完全相同,没有杂菌。
2.2 降解AFB1菌株的分离与筛选
复筛:挑取初筛得到的纯种菌株接种于100 mL LB培养基中,培养24~36 h。将上述菌液按照4%比例接入100 mL新的LB培养基中,37℃培养72 h。向无菌EP管中加入菌株发酵液和AFB1标准品溶液(1 000 ng·mL-1),使AFB1终浓度为100 μg·mL-1,同时以无菌LB培养基加AFB1标准品溶液作为空白对照,37℃温箱内振荡作用72 h,每组处理做3个平行,重复3次。作用结束后,按照AFB1 ELISA检测试剂盒说明书检测每组AFB1含量,选取AFB1降解率最高的菌株作为目标菌株。AFB1降解率按照以下公式计算:AFB1降解率(%)=(1-试验组AFB1含量/空白组AFB1含量)×100。
2.3 AFB1降解率最高菌株的鉴定
2.3.1 形态学鉴定
将复筛得到的AFB1降解率最高的菌株划线接种于MRS琼脂平板,37℃培养箱内培养24~48 h,观察菌落形态,并挑取单个菌落进行革兰氏染色,观察菌体形态。
2.3.2 生理生化鉴定
将分离纯化的AFB1降解率最高的菌株接种到七叶苷、麦芽糖、甘露醇、水杨苷、蔗糖、菊糖、乳糖、硝酸盐还原、硫化氢、脲酶等生化特性培养基中,观察结果。鉴定方法主要参照《常见细菌系统鉴定手册》[10]和《乳酸细菌分类鉴定及实验方法》[11]。
2.3.3 温度特性
根据ELISA试验结果,从分离的15株菌中挑出1株能够高效降解AFB1的菌株进行生化特性分析。从该菌株培养液中抽取20 μL菌液于980 μL LB液体培养基中,以LB液体培养基为对照,置于摇床内150 r·min-1,分别在32、34、36、37、38、40℃下培养24 h,每个温度做三个重复,利用酶标仪测定600 nm处吸光度值,以温度(℃)为横坐标,吸光度值为纵坐标绘制温度曲线。
2.3.4 耐酸碱特性
同1.2.3.3接菌方法,在pH值分别为3.0、4.0、5.0、6.0、7.0、8.0、9.0的LB培养基中接菌,每个酸碱度做三个重复,置于摇床内150 r·min-1,培养24 h,测定600 nm处OD(吸光度)值。以pH值为横坐标,吸光度值为纵坐标绘制耐酸耐碱特性曲线。
2.3.5 耐胆盐特性
将接种菌液的无胆盐LB培养基作为空白对照组,胆盐浓度分别为0.5%、1.0%、1.5%、2.0%为试验组,每个胆盐浓度三个重复。置于摇床内150 r·min-1,37℃,培养24 h后,测定600 nm处吸光度值,并以胆盐浓度作为横坐标,培养液吸光度值为纵坐标绘制曲线。
2.3.6 16S rDNA鉴定
(1)提取DNA:按照细菌基因组DNA提取试剂盒(北京天根生化科技有限公司)说明书操作。(2)PCR扩增:采用通用引物,正向引物为27F:5'-AGAGTTTGATCMTGGCTCAG-3',反向引物为1492R:5-GGTTACCTTGTTACGACTT-3'[12]。PCR扩增体系为25 μL反应体系:Premix Taq 12.5 μL、上游引物1 μL、下游引物1 μL,模板DNA 5 μL,ddH2O 5.5 μL。以提取的DNA为模板,按PCR反应体系依次加入模板DNA和其他试剂,置于PCR仪中开始扩增。扩增程序为:94℃预变性5 min;94℃变性1 min,58℃退火1 min,72℃延伸2 min,循环30次;72℃延伸10 min,4℃保温[13]。PCR反应产物用琼脂糖凝胶电泳检测并观察结果。(3)将PCR产物送至生工生物工程(上海)股份有限公司测序,测得基因序列在NCBI上进行BLAST初步确定属种,与GenBank数据库中已知序列进行同源性比对,最后利用MEGA 5.0软件构建系统发育进化树[14]。
2.4 AFB1降解率最高菌株脱毒活性组分的确定
取2 mL筛选菌株发酵液置于无菌EP管中,4℃、10 000 r·min-1离心10 min,离心结束后收集上清液备用。将菌体沉淀使用无菌生理盐水洗涤2次,加入2 mL生理盐水重悬菌体,制备活菌菌体悬液备用。从上述菌体悬液中吸取1 mL于离心管中,再放入高压锅121℃,15 min,制备灭活菌菌体悬液。向发酵液、上清液、活菌菌体悬液、灭活菌菌体悬液中分别加入终浓度为100 ng·mL-1的AFB1标准品溶液,同时以LB培养基加AFB1标准品溶液作为空白对照,37℃温箱内振荡作用72 h,每组试验做3个平行,重复2次,作用结束后测定各组分AFB1降解率。
3 结果与分析
3.1 菌株的筛选
经过初筛得到15株能够在以香豆素为唯一碳源的LB固体培养基生长良好的菌株,以对AFB1标准品溶液的降解率为指标对初筛菌株进行复筛,从中筛选出1株能够高效降解AFB1的菌株SM2,其降解率达到69.2%(表1)。

表1 降解黄曲霉毒素B1菌株的筛选结果Table 1 Results of the screened aflatoxin B1 degradation strains
3.2 AFB1降解率最高菌株SM2的鉴定
3.2.1 形态学鉴定
取培养后的菌株平板观察,其生长为灰白色、呈现不透明的圆形菌落,边缘不规则,表面有皱襞,菌落中心有乳白色突起,呈山丘状,且菌落不易挑起(图1-a)。菌株培养18~24 h时经革兰氏染色后,在油镜下观察可见紫色短杆状菌体,判定为革兰氏阳性菌(图1-b)。

图1 SM2菌株在MRS琼脂培养基上的形态(a)及革兰氏染色,1000×(b)Fig.1 Morphology of SM2 strain on MRS agar medium(a)and Gram staining result(b)
3.2.2 生理生化鉴定
SM2菌株生理生化鉴定结果如表2所示,将该鉴定结果对比GB/T26428-2010《饲用微生物制剂中枯草芽胞杆菌的检测》,可初步判定该菌株属于枯草芽胞杆菌。

表2 分离菌株生化特性鉴定Table 2 Biochemical characterization of isolated strains
3.2.3 PCR扩增产物检测
通过琼脂糖凝胶电泳试验发现,SM2菌株的DNA扩增产物大小在1500 bp左右,与预测基因片段大小相符,试验分离菌株提取DNA满足测序要求,结果如图2所示。

图2 SM2菌株PCR扩增产物电泳结果图Fig.2 Electrophoresis results of PCR amplification products of SM2 strain
3.2.4 基因序列比对
将PCR扩增产物测得的序列与GenBank数据库中的序列进行BLAST同源性比对分析,结果显示,SM2菌株与枯草芽孢杆菌FWJ16X的同源性为100%,确定分离菌株为枯草芽孢杆菌FWJ16X。
3.2.5 温度特性
如图3所示,枯草芽孢杆菌FWJ16X在培养温度为38℃时,吸光度值达到最高,即菌群数量达到最大。而随着温度继续升高,菌群数量开始迅速下降,即38℃为枯草芽孢杆菌FWJ16X的最佳生长温度。

图3 枯草芽孢杆菌FWJ16X温度曲线Fig.3 Temperature curve of Bacillus subtilis FWJ16X
3.2.6 耐酸碱特性
如图4所示,不同的培养基酸碱度对枯草芽孢杆菌FWJ16X的生长影响是不同的。当培养基pH值在3.0~7.0之间时,枯草芽孢杆菌FWJ16X的生长数量处于稳定上升的状态。当pH=7.0时,枯草芽孢杆菌FWJ16X菌群数量达到峰值,若培养基pH值继续增加,菌群数量开始快速降低,说明枯草芽孢杆菌FWJ16X的最佳生长pH值为7.0。
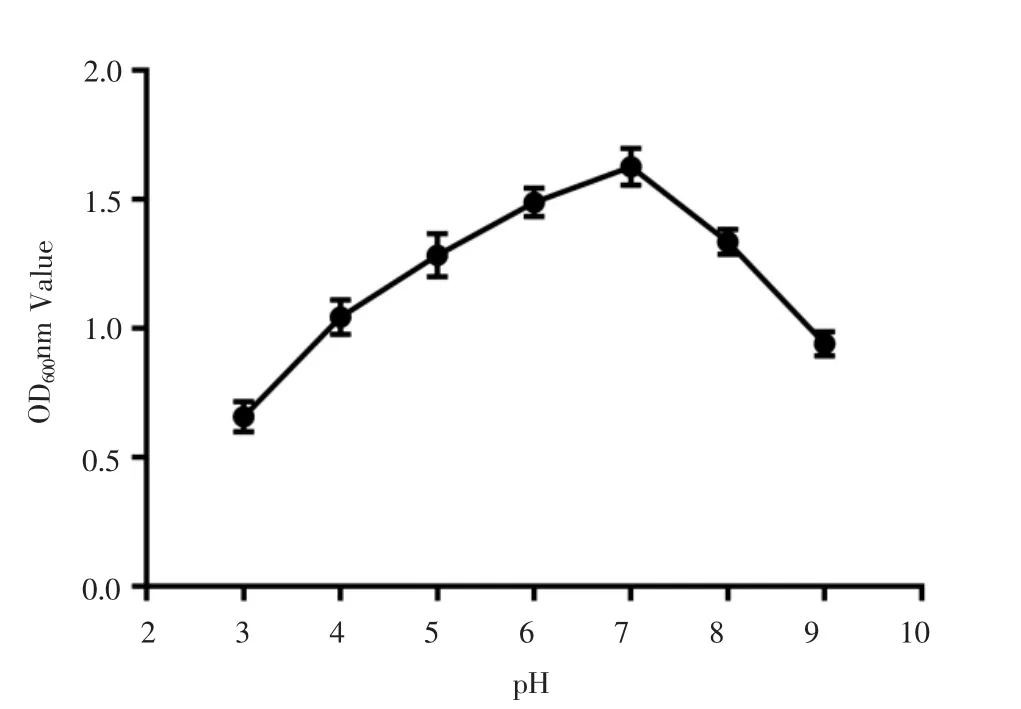
图4 枯草芽孢杆菌FWJ16X耐酸碱特性曲线Fig.4 Acid and alkali resistance curve of Bacillus subtilis FWJ16X
3.2.7 耐胆盐特性
如图5所示,随着胆盐浓度的增加,枯草芽孢杆菌FWJ16X的数量开始下降,当胆盐浓度在1.5%时,菌群数量下降较为迅速,继续增加胆盐浓度,菌群数量继续下降。但当胆盐浓度达到2%时,菌群数量依然大于对照组的50%,说明枯草芽孢杆菌FWJ16X具有较强的胆盐耐受能力。

图5 枯草芽孢杆菌FWJ16X耐胆盐曲线Fig.5 Biliary salt tolerance curve of Bacillus subtilis FWJ16X
3.3 脱毒活性组分的定位
对枯草芽孢杆菌FWJ16X培养物的不同组分进行AFB1降解活性测定。结果显示,发酵液的不同组分均具有一定的黄曲霉毒素B1降解活性(表3)。其中,上清液的脱毒活性显著高于菌体悬液,上清液对AFB1的降解率为68.6%,发酵液、活菌体悬液和灭活菌体悬液对AFB1的降解率分别为70.8%、30.6%、21.2%。与发酵液的AFB1降解率70.8%相比,细菌培养上清液的脱毒效果基本相同,无显著差异。

表3 枯草芽孢杆菌FWJ16X降解AFB1脱毒活性成分分析Table 3 Analysis of detoxification active components of Bacillus subtilis for reducing FWJ16X degradation of AFB1
4 讨论
由于黄曲霉毒素具有强毒性、高稳定性和高致癌性等特点,不仅会影响粮食及饲料产品的经济效益,同时也潜在威胁着人类和动物的健康,因此探索去除黄曲霉毒素的方法具有重要意义。目前,黄曲霉毒素的去除方法主要包括物理法、化学法和生物法。由于物理法与化学法的传统性、局限性以及不稳定性,所以解决霉菌毒素污染问题主要集中在生物法上。生物法主要利用的是物理吸附结合毒素(酵母、乳酸菌等)、分泌活性物质降解毒素两个途径,并且生物法不但处理条件温和,不会破坏产品品质,而且有些还能增加产品营养价值[15]。
试验研究以香豆素为唯一碳源,从小鼠粪便分离并培养出15株生长良好的菌株,并以AFB1降解率为指标筛选出了一株能够高效降解AFB1的菌株,其降解率为69.2%,并通过形态学、生理生化试验和16S rDNA序列分析鉴定该菌株为枯草芽孢杆菌FWJ16X。通过测定其上清液、发酵液、活菌体悬液以及灭活菌体悬液,枯草芽孢杆菌FWJ16X去除AFB1的能力主要依靠的是由其菌体细胞代谢产生并分泌至胞外的某种活性物质的生物降解作用,而不是菌体本身的吸附作用,这和张晓静[19]的研究结果相一致。
目前国内外的研究多集中在利用微生物分泌活性物质降解毒素,因为微生物的物理吸附作用存在着结合可逆不稳定,毒素易重新释放,引起二次污染的问题,加之吸附效果受菌、环境等条件限制,致使菌体吸附不是清除黄曲霉毒素的最佳选择[16]。Liew等[17]在评估干酪乳杆菌(Lcs)在不同浓度下结合黄曲霉毒素B1(AFB1)能力时,测定不同Lcs细胞成分(包括活细胞、热处理细胞和细胞壁)的AFB1结合效率。发现活Lcs细胞对AFB1的结合效率最高(98%)。刘亚楠等[18]为了提高枯草芽孢杆菌Q125(Bacillus subtilis)降解AFB1的能力,对显著影响AFB1降解的发酵条件进行优化后,上清液对AFB1的降解率从69.24%升高至100%,降解效率明显提高;蛋白酶K和SDS处理分别使AFB1降解率降低了5.05%和36.72%(P<0.05),推测蛋白或酶可能是菌株Q125培养上清液降解AFB1的活性物质成分。段素云等[20]以香豆素为唯一碳源进行初筛,通过测定对AFB1的降解能力成功筛选到1株能高效降解AFB1的菌株解淀粉芽胞杆菌(Bacillus amyloliquefaciens),降解率达86.1%。通过测定解淀粉芽胞杆菌各活性组分对AFB1的降解能力,确定其脱毒物质为一种胞外产物。研究虽然确定了枯草芽孢杆菌FWJ16X降解AFB1的脱毒成分是菌体细胞代谢产生并分泌至胞外的某种活性物质,但是缺乏对该活性物质具体种类和特性的了解,因此,在后续试验中将会采取加热、蛋白酶K处理等措施进一步分析和研究具体该活性物质的种类和特性。
5 结论
研究通过利用香豆素为唯一碳源,经过初筛和复筛过程,筛选出1株枯草芽孢杆菌FWJ16X具有AFB1去除能力;同时通过枯草芽孢杆菌FWJ16X各组分去除AFB1能力的比较,发现枯草芽孢杆菌FWJ16X去除AFB1的能力主要由菌体代谢产生的某种活性物质主导,并提示其是一种胞外物质。为后期分离纯化该菌株去除AFB1的活性物质,研究其作用机制,以及其在食品、饲料等脱毒上的具体应用提供基础。

