淤泥质潮滩重金属和溶解性有机质的潮汐变化特征及其环境影响评价
张丽聪,肖凯*,张鹏,李海龙,王俊坚,李镇扬,王芬芳,徐华林,郭跃华
1. 南方科技大学环境科学与工程学院,广东 深圳 518055;2. 中国地质大学(北京)水资源与环境学院,北京 100083;3. 厦门大学环境与生态学院,福建 厦门 361102;4. 广东内伶仃福田国家级自然保护区管理局,广东 深圳 518040;5. 广东省中交一航局生态工程有限公司,广东 深圳 518107
淤泥质潮滩指富含泥质沉积物的潮滩,位于平均大潮高潮线与平均大潮低潮线之间的地带,可分为光滩和沼泽带(杨世伦,2003)。在世界范围内,淤泥质潮滩广泛分布于纬度 73°以下的一些海湾和河口等处。中国潮滩岸线总长约为4000 km(王颖,1990),具有规模大、分布广、类型多的特点(陈思明,2018)。潮滩具有多种生态价值,如过滤污染物、为动植物提供栖息地和提高海岸的防护能力等(Goodwin,2001;Wang et al.,2012;Leonardi et al.,2016)。但近几十年来,随着沿海经济的发展,海岸带出现了不同程度的重金属污染问题。
泥质潮滩作为海陆交互带,它们是环境相关溶质(如重金属、碳和营养盐)活跃的生物地球化学转化区,由于涉及含水层,其溶质成分复杂。水体中重金属浓度和溶解态有机质(Dissolved Organic Matter,DOM)特征受到物理驱动、一系列复杂的水岩相互作用和生物地球化学作用而表现出复杂的变化(O’Connor et al.,2018;Liu et al.,2019;Zhang et al.,2022)。这些作用包括载体上离子的吸附和解吸、有机物质的再矿化、氧化还原反应产生或消耗金属氧化物等(李海龙等,2015)。潮滩水体中重金属如果过度富集不仅会影响动植物的生长,污染食物链,而且会影响海洋重金属的均衡(Marchand et al.,2016;Trezzi et al.,2016)。DOM是全球碳循环的重要组成部分,在水生生态系统的生物地球化学过程发挥着重要的作用,但同样具有生物毒性和遗传毒性(He et al.,2015;Tang et al.,2020)。有色溶解有机质(Colored Dissolved Organic Matter,CDOM)是指在紫外-可见波长范围内可以吸收和重新发射光的DOM部分,可有效反映DOM的来源、分子特性(芳香性和分子量)或微生物成分等(Zhou et al.,2010;Pain et al.,2019)。已有大量的研究表明,有机质的再矿化作用与络合作用均会对重金属产生影响(Roy et al.,2011;Liu et al.,2019)。
潮滩沉积物和地下水中的重金属和有机碳可以通过地表水-地下水直接的对流与扩散作用,及底栖动物洞穴冲刷输送到地表水中(Burdige,2006;Kalnejais et al.,2015;Xiao et al.,2021;Pan et al.,2022)。海底地下水排泄(Submarine Groundwater Discharge,SGD)已被认为是碳、重金属、营养盐向海排泄的重要途径。大量研究表明,SGD携带的溶解态重金属和有机碳在量级上和河流输送的通量相当,有些甚至远超过河流通量(Chen et al.,2018;Wang et al.,2019)。当具有不同组分的地下水和海水混合时,潮滩内的地表水-地下水对流和扩散过程可能会增加或减少重金属和DOM浓度,进而影响污染物在沉积物中的迁移转化过程(Beck et al.,2008;Seidel et al.,2014;O′Connor et al.,2018)。但是鲜有研究同时关注重金属和DOM特征在潮汐尺度上的动态特征及相互作用机制。另外,目前对于DOM的研究主要集中于地表水体中或者地表河口区域,对于潮滩浅层地下水的研究也较少(Pain et al.,2019)。
综上所述,选取漳江口的红树林湿地自然保护区的淤泥质光滩作为研究场地,在潮汐尺度内收集地下水和地表水样本,以研究重金属(Cr、Cu、Zn、As、Ba、Pb和Hg)浓度和有机质特征随潮汐的变化规律和驱动机制,定量评估重金属和有机质在沉积物-水界面的对流和扩散通量,评估其生态环境效应和污染风险。研究成果有助于增强对淤泥质潮滩水动力过程及其对地下水重金属和有机质循环影响的了解,有助于潮滩特殊生境的保护和有效管理。
1 材料与方法
1.1 研究区概况
研究区位于福建省云霄县漳江口红树林国家自然保护区(117°24'07″—117°30'00″E,23°53'45″—23°56'00″N),具体位置如图1所示。该保护区由河口水域、红树林湿地、光滩和盐沼组成,总面积为2360.0 hm2。该区域属亚热带海洋性季风气候,夏热冬温,年均降雨量为1714.5 mm。潮汐类型属于不规则半日潮,平均潮差为2.32 m(Wang et al.,2022)。监测点位于自然保护区的淤泥质潮滩,与潮沟相邻。沉积物以淤泥和砂质淤泥为主,厚度超过2 m,其中含有大量植物残体、钙质、软体动物残体和石灰物质,有机质含量大多在2.5%—10.0%范围内(薛博,2007)。

图1 漳江口的地理位置和监测点的分布示意图(改自Wang et al., 2022)Figure 1 Locations of the Zhangjiang Estuary and monitoring point (modified from Wang et al., 2022)
1.2 野外工作方法
1.2.1 地下水动态监测
监测点安装有“对井”装置,可以实现对两个不同深度地下水的水压、电导率和温度的自动监测(Hou et al.,2016)。图2为对井装置结构,其由上下两个相同的井筒和一根固定的链接杆组成,井筒有内外套筒,外套筒筒壁上均匀分布着直径为 5 mm的透水孔,内筒中放置了传感器(CTD-Divers)。监测时间为2020年10月11日13:00—20:00,频率为60分钟/次。

图2 对井装置的组成Figure 2 The schematic structure diagrams showing
1.2.2 水样采集
从低潮到高潮期间,地下水每隔2小时采集1次,共采集3次;地表水每隔1小时采集1次,共采集8次(图3)。为减小采样活动对监测的地下水位产生影响,采样点选取在“对井”装置2 m附近。地下水采集是使用挖坑渗水法收集 0.5 m深的水样;地表水样品使用Niskin采水器采集(水面以下50 cm)(Xiao et al.,2022)。水样的理化参数包括盐度、pH和溶解氧(DO),使用便携式多参仪(Hanna,HI 9829)进行现场测量。水样过0.45 μm醋酸纤维滤膜保存于预先经过特殊处理的样品瓶中。重金属样品加入HNO3酸化至pH为1.5—2.0。有机质样品置于棕色玻璃瓶中,4 ℃下保存,待测。

图3 地下水监测周期与采样频率Figure 3 Groundwater monitoring period and sampling frequency
1.3 室内实验
水样中的Cr、Cu、Zn、As、Ba和Pb使用电感耦合等离子体质谱仪(ICP-MS,Thermo Fisher Scientific,USA)测量,Hg采用原子荧光光谱仪测量。为减小测量误差,每份样品均分别3次测样后取平均质量浓度。水样中溶解性有机碳质量浓度(DOC)通过总有机碳分析仪(TOC-LCSH/CSN)配备ASI-L(Shimadzu,Japan)自动进样装置检测,样品检测前,通过滴入盐酸将样品酸化至pH=2左右,去除水样中无机碳干扰。水样中DOM的光谱特征采用紫外-可见光分光光度计(Shimadzu,Japan)测定,以Milli-Q超纯水作为空白水样。扫描波长范围为200—800 nm,波段步长为1 nm。本文共考虑了 SUVA254、E2/E3、a254、a350和a3655种DOM光谱特征,具体计算方法和含义描述见表1。

表1 溶解性有机质光谱特征指数含义Table 1 Meaning of spectral characteristic index of chromophoric dissolved organic matter
1.4 计算方法
1.4.1 沉积物-水界面的交换通量
本研究计算的重金属和 DOM 在沉积物-水界面的交换通量包括水力梯度驱动的对流通量和浓度梯度驱动的扩散通量。对流通量采用“对井法”(Hou et al.,2016)计算,根据广义达西定律,首先计算地下水-地表水交换速率qn:

式中:
Kv——沉积物垂向渗透系数,利用原位降水头法测定(Wang et al.,2014),其值为 1.2×10-7m·s-1;
J——上下两个单井的水力梯度,计算方法为:

式中:
hup和hlow——上下井的等效淡水水头;
ΔL——上下井的间距,值为0.4 m;
cup和clow——上、下井处地下水的盐度,利用监测的电导率和温度数据获得(Cox et al.,1967);
φ——淡水与海水的动态黏度之比;
ε——常数,为 7.143×10-4m3·kg-1,用于描述密度和盐度间的线性关系。
若qn>0,表示为地下水排泄;qn<0,则表示地表水入渗到含水层中。
对流携带的重金属和DOM通量F可按如下公式估算(Qu et al.,2017):

式中:
此外,本研究还考虑了垂向分子扩散通量,根据菲克第一定律,目标溶质在地下水与地表水之间的扩散通量(F0)可表示为(Fick,1855):

式中:
φ0——沉积物在深度为1—10 cm和20—30 cm孔隙度的平均值,为0.4。

Ds——溶质的分子扩散系数,当沉积物的孔隙度φ0<0.7 时为(Ullman et al.,1987):

式中:
D0——目标溶质在无限稀释条件下的扩散系数。不同金属(Cr、Cu、Zn、As、Ba、Pb 和 Hg)和 DOC 的 D0分别为 7.95×10-6、6.59×10-6、6.86×10-6、 6.56×10-6、 1.84×10-6、 8.41×10-6、14.00×10-6、100.00×10-6cm2·s-1(Poisson et al.,1983;Dharmaprakash et al.,1989;Kuss et al.,2009;Wang et al.,2016;Yao et al.,2020)。
1.4.2 重金属污染评价
采用单因子污染指数法(Pi)和综合污染指数法(Psyn)(Hakanson,1980;Sun et al.,2020)评估研究区地下水和地表水中重金属的污染状况,具体公式如下:

式中:
Ci——第i种金属的平均质量浓度;
Si——第i种金属评价标准,地表水采用《地表水环境质量标准》(GB 3838—2002)中的Ⅰ类标准,对地下水采用国土资源部修订的《地下水质量标准》(GB/T 14848—2017)的Ⅰ类标准。根据 Pi值可将水质可分为四类:清洁(Pi<1,Ⅰ类)、轻度污染(1<Pi<3,Ⅱ类)、中度污染(3<Pi<6,Ⅲ类),和重度污染(Pi>6,Ⅳ类)(Luo et al.,2022)。同样,根据 Psyn值可将水质分为清洁(Psyn≤1)、轻度污染(1<Psyn≤2)、中度污染(2<Psyn≤3)和重度污染(Psyn>3)4个等级(Sun et al.,2020)。
1.4.3 统计分析
采用单因素方差分析(ANOVA)和 Tukey事后检验研究地表水和地下水中相关物理化学参数的差异性,当显著性水平P<0.01时为差异极显著;P<0.05时为显著。同时,对于不满足单因素方差分析数据,需通过对数转换以满足方差齐性要求。采用Mantel test分析和Pearson相关分析研究相关参数的相关性。统计分析及数据可视化利用 R语言(R3.6.0软件)完成,示意图和统计图分别在CorelDRAW 2018和Sigmaplot 14.0软件中完成。
2 结果
2.1 理化参数、重金属和有机质的潮汐变化
在取样期间,地表水中的盐度、pH和DO总体呈现先下降后上升的变化趋势,在低潮时达到最低值,在涨潮过程中呈增大趋势(图4)。在地下水中,盐度和pH较稳定,DO随潮水位的增加而迅速降低,从 7.01 mg·L-1减少到 2.82 mg·L-1。此外,地表水中的pH和DO均高于地下水,且存在显著差异(pH:P=0.0004;DO:P=0.002),而盐度差异性不显著(P=0.720)。

图4 潮滩地表水和地下水中理化参数(盐度,pH和DO)的潮汐变化Figure 4 Tidal variations of physicochemicla parameters (salinity, pH and DO) in the surface water and groundwater in the tidal mudflat
地表水中重金属平均质量浓度的大小顺序为:Ba>Zn>Pb>As>Cu>Cr>Hg;地下水中的为:Ba>Zn>As>Cu>Cr>Pb>Hg。在均值水平上,地表水中 Cr、Zn、As和Hg与地下水中的质量浓度很接近,但地表水中的Cu、Ba和Pb分别是地下水中3.4、2.5和9.2倍。在取样期间,地表水和地下水中重金属的质量浓度随潮汐的变化较复杂(图5)。除As和Pb,地表水中的重金属均在低潮位时达到最大值。除Pb外,地表水中的重金属质量浓度随着潮位的增加总体呈现先上升后下降的变化趋势。地下水中Ba和Cu的变化较稳定,而Cr、As和Hg表现出先增加后减少的趋势,Zn表现出持续增加的趋势。根据方差分析,地表水和地下水中的As和Ba存在显著差异(As:P=0.049;Ba:P=0.038),而 Cr、Cu、Zn、Pb和 Hg不存在显著差异(Cr:P=0.569;Cu:P=0.332;Zn:P=0.900;Pb:P=0.563;Hg:P=0.925)。
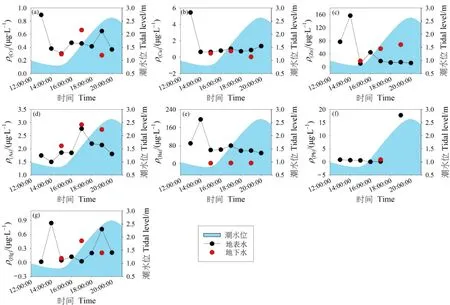
图5 潮滩地表水和地下水中重金属质量浓度的潮汐变化Figure 5 Tidal variations of heavy metals in surface water and groundwater in the tidal mudflat
在取样期间,地表水中的 DOC质量浓度、CDOM的光谱特征指数随潮汐的变化明显,通常在低潮时达到最大值,并随着潮汐水位的增加而降低。对比,在地下水中这些指标随着潮汐水位的增加而呈现出增加的趋势(图6)。地表水和地下水中DOC的平均值分别为 (3.11±0.29) mg·L-1和 (3.32±0.16) mg·L-1。根据方差分析,地表水和地下水中DOC、CDOM紫外光谱特征(SUVA254,a350)均存在显著差异(SUVA254:P=0.014;a350:P=0.003),而DOC质量浓度和溶解有机质相对分子量(E2/E3)不存在显著差异(DOC:P=0.275;E2/E3:P=0.132)。
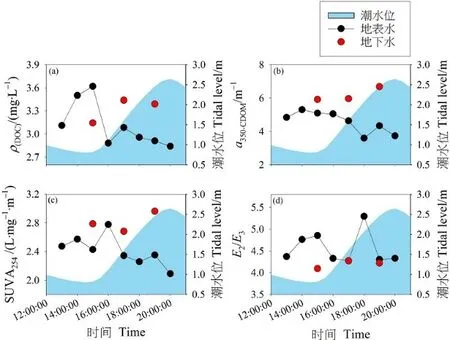
图6 潮滩地表水和地下水中DOC和CDOM光谱特征指数的潮汐变化Figure 6 Tidal variations of the DOC and spectral characteristic indexes of CDOM in the surface water and groundwater in the tidal mudflat
2.2 沉积物-水界面水交换速率
根据公式(1),计算得到监测点处地下水-地表水交换速率,结果如图7所示。地下水-地表水交换速率具有明显的周期性变化,但由于水力梯度和渗透系数较小,导致整体交换速率较低,平均地下水排泄速率和地表水入渗速率分别为 3.22×10-5m·h-1和2.10×10-5m·h-1,净排泄速率为1.12×10-5m·h-1。在取样期间,地下水的排泄速率从4.75×10-5m·h-1(13:00)减小到0(17:00),之后随着潮位的增加,交换方式转变为海水入渗(2.16×10-6—5.40×10-5m·h-1)。

图7 监测期间地下水位和地下水-地表水交换速率Figure 7 Time series of groundwater level and groundwater-surface water exchange rates during the monitoring period
2.3 沉积物-水界面重金属和DOC的交换通量
根据公式(3)、(4),计算得到的重金属和DOC在监测期内通过沉积物-水界面的交换通量如图 8所示。地下水交换携带的重金属排泄量的顺序为:Ba>Zn>As>Cu>Cr>Pb>Hg,其中地下水中大部分重金属表现为向地表水净排泄,即潮滩沉积物为重金属的源;而Cu和Pb的净排泄量小于0,表现为汇。扩散通量大小顺序为:Ba>Zn>Pb>As>Hg>Cr>Cu,其中Cr、Cu、Hg表现为由地表水向地下水扩散,而其他重金属表现出向地表水扩散。除了Pb的扩散通量约为地下水排泄携带的通量的20%外,其他重金属通过地下水排泄携带的对流通量是扩散通量的20—200倍。因此,除了Pb外,其他重金属的扩散通量相比于对流通量可以忽略不计。此外,地下水中 DOC 的 SGD 通量为 0.11 mg·m-2·h-1,扩散通量为 3.45×10-3mg·m-2·h-1,相差 31 倍,同样可以忽略。

图8 重金属和DOC在沉积物-水界面的对流和扩散通量Figure 8 Calculated connective and diffusive fluxes for heavy metals and DOC
2.4 重金属污染评价
根据单因子污染指数法(Pi),漳江口的潮滩水体现出了一定程度的污染(除 Cr、Cu和 Pb外)(图9)。由于缺乏Ba相应的水质标准,且其生态危害性较小,因此不考虑Ba的污染状况。其中,Hg的污染最严重,地表水和地下水中Hg的平均Pi值分别达到了中度和轻度污染水平,地表水中的最大值甚至达到了重度污染水平。此外,Zn和As也表现出了潜在的污染风险。除As和Hg在地表水和地下水中污染情况差距较大外,其他重金属在两种水体中的污染水平相当。但依据综合污染指数法(Psyn),地表水和地下水中的 Psyn分别为 3.90和1.98,属于重度污染和轻度污染水平。总体上,地表水中7种重金属的污染程度大于地下水,说明潮滩具有潜在的净化重金属污染物的作用。

图9 地下水和地表水中重金属的污染指数Figure 9 The pollution index of heavy metals in the groundwater and surface water
3 讨论
3.1 重金属的潮汐变化的影响因素
本研究基于Mantel测试检验了潮汐因素1(潮位和盐度)和化学因素2(pH和DO)对水体中重金属和有机质的影响(图10)。结果表明:除因素2与As具有显著相关性外(P<0.05),因素1和2对其他重金属的影响均较小。但是,随着潮位的升高,地表水和地下水中的大部分重金属均表现出显著的变化(图5),这是因为在地表水与地下水交换过程中,其中的重金属与有机质含量的变化并非受单因素控制,而是物理混合、一系列复杂的水岩相互作用和生物地球化学反应共同作用的结果(李海龙等,2015)。

图10 环境因子的相关性Figure 10 Correlations between environmental factors
在地表水中,Cr、Cu、Zn、Ba和Hg的质量浓度最大值通常出现在低潮期间,这表明其可能来源于地下水的排泄或者上游河水的输入。地表水中的Cu和Ba的质量浓度明显大于地下水,但监测期间发生海水-地下水交换时地下水中这两种重金属的变化较小,且Cu和Ba与潮位、盐度、pH和DO均不相关,这可能是因为地表水与地下水交换所凭借的环境介质——潮滩沉积物具有一定程度的阻隔地表水中的Cu和Ba侵入地下水的能力。先前研究表明,沉积物具有接受、储存和循环水、营养物质及能量的能力(Anderson et al.,1984),此外,还具有保留、分散和转化化学物质和生物的能力,从而起到环境过滤器或缓冲区的作用(Gregorich et al.,1994)。潮滩是由陆地生态系统向海洋生态系统的陆海交界过渡地带,可作为陆源性物质进入海洋之前的过滤器(Ferreira et al.,2017)。因此,地表水与地下水中溶质质量浓度差别较大,且随着地表水和地下水混合其含量变化不明显时,地表水与地下水交换的环境介质——潮滩沉积物在其中发挥了重要的作用。此外,Cr和 Cu呈极显著正相关(r=0.775),表明二者可能为同一来源。特别是上游红树林地下水中重金属的输入,Cr、Zn、Cu和Pb在上游的红树林区具有较高的含量(Hong et al.,2021;Wang et al.,2022)。因此,上游河水的输入将对Cr、Zn、Cu、Pb和Ba的含量产生重要的影响。在相同的取样时刻,特别是在最低潮的取样,地下水中的Zn、As和Hg通常高于地表水中的质量浓度。因此,地下水排放携带的Zn、As和Hg将对地表水中的重金属动态产生重要影响。地表水中Pb在高潮时达到最大值,也可能受到海水输入的影响。
随着潮位的增加,地表水中的重金属(除 Pb外)与地下水中Cr、As和Hg的质量浓度呈现先增大后减小的趋势,这与涨潮期间先发生地下水排泄后发生地表水入渗的两个时期(图7)相对应。在地下水排泄时期,地下水中的Cr、As和Hg的质量浓度增大可能是因为地下水的扰动使沉积动力环境更活跃,使沉积物中的Cr、As和Hg暴露在氧化或次氧化环境中,从而促进其释放到水体中,质量浓度增大。而在海水入渗期间,金属质量浓度减小则主要是因为稀释作用。图4中DO的质量浓度变化趋势证实了这一点,随着潮位的升高,地表水中的DO质量浓度增大,但地下水中的DO持续且迅速下降,表明地下水中具有较多的氧化还原反应、有机物质再矿化和金属氧化物等消耗DO的反应发生。已有大量研究表明,潮间带地下水中Fe和Mn的氧化还原循环会对其他重金属产生重要的影响(O′Connor et al.,2018;Liu et al.,2019)。特别是漳江口沉积物中Fe和Mn元素含量远高于其他重金属(Yang et al.,2020)。例如,铁(氢)氧化物可以有效地清除地下水中的Cr、As和Hg(Bone et al.,2006;Richard et al.,2016)。当地下水变为还原环境时,铁(氢)氧化物溶解释放沉积物附着的重金属,这可能是地下水中Cr、As和Hg质量浓度增加的原因。在15:00之后,随着地表水的入渗,Cr、Cu、As和Hg的质量浓度开始减少,这主要可能是地表水的稀释引起的(图5)。
3.2 有机质的潮汐变化及影响因素
如图10所示,根据Mantel’s测试的结果,DOC和DOM的光谱特征参数受潮汐因素1(盐度和潮位)的影响较低,但是DOM的光谱特征参数受化学因素2(pH和DO)的影响较明显,这表明水体中的DOM含量受生物和化学反应作用(因素2)的影响更强烈,物理作用(因素1)影响较小。
地表水中DOC在最低潮时达到最大值,并随着潮位的增加而逐渐降低(图6)。这表明地下水排泄是地表水中 DOC的重要来源。此外,DOC与CDOM、CDOM与SUVA254具有相似的变化趋势,且具有显著的正相关(DOC与CDOM:r=0.646;CDOM与SUVA254:r=0.914),表明地下水中高芳香性有机质在有机质中占比较高。但随着潮位的上升,DOM 的分子量趋于稳定,这是因为海水中含有较多的小分子量有机质(Richard et al.,2016)。在地下水中,DOC、CDOM、SUVA254和E2/E3随着潮位的上升表现出增加的趋势。pH、DO与CDOM和SUVA254表现出了显著的负相关(pH与CDOM:r= -0.603;pH与SUVA254:r= -0.692;DO与CDOM:r= -0.696;DO与CDOM:r= -0.801;),这表明高芳香性DOM主要来源于地下水,并随着咸淡水混合、潮汐波流等因素使沉积物频繁地再悬浮、移动和干扰生物活动等,已沉积的有机质会不断地从沉积物释放到水体中。新产生的DOM具有高芳香化程度和低分子量的特点,与低潮时地表水中 DOM的特征相同,更加证明了地下水的排泄对地表水中DOM的影响。
3.3 重金属和DOC的排泄通量和环境效应
相较于国内外其他的研究场地,漳江口泥质潮滩 SGD携带的重金属通量通常处于较低的水平,但对于毒性较强的As和Pb,其通量分别是中国胶州湾盐沼和河口湿地的34倍和21倍,而Zn和Pb通量最高分别可达地中海西北部的100倍和20倍(表2)。此外,Cu和Pb的净通量小于0,表明其会在沉积物中不断累积。因此,漳江口红树林湿地淤泥质潮滩是Cu和Pb的汇,是其他重金属和有机质的源。地下水中的DOC质量浓度(3.32 mg·L-1)明显高于茅尾海(1.44 mg·L-1)和珍珠湾红树林生态系统(0.72—2.28 mg·L-1)中的,但SGD输送的DOC通量却远远小于这两个研究场地(王亚丽,2020)。较小的重金属和DOC通量主要是由于较小的SGD速率引起的。

表2 世界范围内对流和扩散输送的重金属通量的对比Table 2 Comparisons of heavy metal fluxes transported by convection and diffusion globally
从污染水平看,漳江口淤泥质潮滩地表水和地下水分别处于重度污染和轻度污染水平,其中 Hg的污染最严重,Zn和As表现出潜在的污染风险。并且,上游SGD输送的重金属及DOM可能对潮滩和海洋中重金属及碳均衡产生重要的影响,在相同的时间,Wang et al.,(2022)计算了泥质潮滩上游的红树林和盐沼区的SGD速率分别为0.18 m·d-1和0.04 m·d-1,分别是本研究的23、5倍,这是因为淤泥质潮滩的渗透系数(Kv)远小于红树林和盐沼区的渗透系数。淤泥质潮滩渗透性差,同时受不同植被类型的影响。此外,红树林区具有富含有机质的特征,重金属Cr、Zn、Cu和Pb的含量也最高(Wang et al.,2022)。
4 结论
本研究详细调查和分析了漳江口淤泥质潮滩地下水和地表水中重金属和有机质在潮汐尺度的变化特征、重金属和有机质在沉积物-水界面的交换通量、重金属污染评价,得到的主要结论如下:
(1)地表水中的重金属最大值通常出现在低潮期间,并随着潮位的增加而减小。其动态主要受上游河水输入或地下水排泄控制。地下水中Cr、Zn、As和 Hg受生物地球化学反应和地表水稀释的共同影响。地表水中DOC和DOM特征参数随潮位的增加而减少,在地下水中相反。地下水中的DOM,具有大分子量和高芳香性的特点,主要受pH和DO的影响。统计分析表明,由于潮滩复杂的环境和水文过程,地表水和地下水中有机质与重金属的相关性较低。
(2)相较于对流通量,重金属和DOC的扩散通量可以忽略不计。SGD携带的重金属和DOC的通量范围分别是 0.19—155 μg·m-2·d-1和 0—2.56 mg·m-2·d-1,而扩散通量范围分别为-8.30×10-4—1.72 μg·m-2·d-1和 0—8.30×10-2mg·m-2·d-1。除 As和Pb外,其余重金属和DOC的交换通量较小,但这主要是由于较低的SGD速率引起的。
(3)重金属污染评价结果表明,漳江口淤泥质潮滩地表水和地下水中重金属的综合污染程度分别处于重度污染和轻度污染水平。其中,地表水中的Hg处于中度污染水平,是地表水污染的最主要因素;地下水中的Hg和As处于轻度污染水平,是地下水污染的主要因素;其余重金属均处于清洁水平;As表现出潜在的污染风险。

