一步法核酸扩增检测技术在原发性乳腺癌新辅助化疗后前哨淋巴结活检中的应用*
郭绍文, 鄂裘恺, 李双双, 叶曼娜, 汪成, 叶辉
上海交通大学医学院附属第九人民医院黄浦分院病理科(上海 200011)
乳腺癌发生腋窝淋巴结(ALN)转移是患者预后不良的最重要的指标,腋窝淋巴结清扫术(ALND)在提高患者生存率的同时还可能会导致上肢淋巴结水肿等并发症,准确评估ALN转移的风险,对制定治疗方案至关重要[1]。前哨淋巴结活检(SLNB)是目前早期乳腺癌患者的标准诊断方法和临床观察疗效的标准[2-3],而用于术中诊断SLN转移状况的手段主要是冷冻切片(FS)和印片细胞学检查(TIC),这两种手段虽然具有较高的敏感度和特异度,但均依赖病理医师的主观观察,且结果受组织切片的选取影响大,未能实现标准化,因此探索操作简便、结果准确的新型诊断手段仍是临床迫切需求[4]。一步法核酸扩增(OSNA)是一种新型的分子诊断方法,自Tsujimoto等于2007年首次报道采用OSNA技术诊断SLN转移情况以来,国内外相关的研究报道普遍认为OSNA可作为病理法的辅助方法,具有简便、快速、敏感度高等特点[5-6]。另一方面,新辅助化疗(NAC)对于局部进展期不可手术的患者可降低肿瘤分期,使之成为可手术治疗,从而提高手术的切除率,部分原本不具备保乳手术的患者还可获得保乳手术切除的机会[7],但NAC前后行SLNB 的手术时机仍存在不同意见,主要是对NAC后SLNB的应用价值存在着争议[8-9]。因此,本研究拟对原发性乳腺癌患者行NAC后行SLNB,并比较OSNA 检测与FS、TIC检测结果的差异,旨在探讨NAC对乳腺癌SLNB的影响和OSNA对检测乳腺癌SLN转移的临床意义。
1 资料与方法
1.1 一般资料 选取2020年12月至2022年2月我院收治的原发性乳腺癌患者125例作为研究对象。
纳入标准:(1)均为原发单一病灶的女性患者,且腋窝淋巴结无肿大;(2)肿瘤T分期为 T1~T3期;(3)患者对本研究均知情同意。
排除标准:(1)非浸润性乳腺癌;(2)术前接受过放疗。
根据患者最终选取的治疗方案分为NAC组(n=48)和手术组(n=77),两组患者的年龄、月经状态、肿瘤大小、肿瘤T分期、肿瘤位置等一般资料比较差异均无统计学意义(P>0.05),具有可比性,见表1。本研究经我院医学伦理委员会批准(SC2020-S-06)。

表1 两组患者一般资料
1.2 治疗方法 NAC组采用TEC(多烯紫杉醇+表柔比星+环磷酰胺)方案或 CEF(表柔比星+环磷酰胺+5-氟尿嘧啶)方案行2~3周期辅助化疗后1周内完成手术。NAC疗效判断采用UICC实体瘤通用疗效判断标准。两组患者均由同一组医师完成手术,完成SLNB后行改良根治术,常规腋窝淋巴结清扫。
1.3 检测方法
1.3.1 前哨淋巴结(SLN)组织样本处理 根据采集的SLN组织样本的质量和短轴长度情况进行切分,100 mg以下的样本不切分,当SLN短轴<4 mm时,切分为2块;4 mm以上者切分为4块。术中均行FS、TIC及OSNA 检测,任一方法结果阳性者,即转行ALND[10]。术后行常规病理检测。
1.3.2 OSNA 检测CK19 mRNA通过逆转录环体系进行扩增(RT-LAMP),通过测定SLN组织中CK-19的含量,可以检测出SLN中是否存在>0.2 mm的转移病灶。采集前哨淋巴结样本予以冷藏(2~8℃)或储存在冰上(0~4℃),不干燥,以避免RNA降解。尽快进行处理,并将用于检测的淋巴结的重量控制在25~600 mg之间。检测操作主要步骤:首先将SLN组织块进行匀浆,使用Lynorhag裂解缓冲液(Sysmex,日本神户)在冰(0~4℃)上裂解淋巴结;然后使用试剂盒(Lynoamp;Sysmex)创建标准曲线,然后分别将引物、CK-19、酶、CK-19阴性及阳性质控、淋巴结原倍及稀释的样本分别加入检测系统(RD-100i OSNA Assay)中进行核酸扩增。结果判定:CK19-mRNA水平>5×103copies/μL为OSNA(++)、2.5×102~5×103copies/μL为OSNA(+)、<2.5×102copies/μL为OSNA(-)。OSNA检测从开始到完成只需要大约30~40 min,与常规病理检测所需时间几乎相同[11]。
1.3.3 常规病理检测 病理检测是诊断SLN转移状况的金标准。每块SLN组织样本取4张切片进行病理染色观察,切片厚约4~6 μm。H&E染色与OSNA检测结果不一致时,将采用免疫组化方法对同一淋巴结蜡块块进行CK19染色并进行分析。淋巴结块用于组织病理学检查,每隔200 μm制作一对系列切片(H&E染色和CK19免疫染色)。当观察到假阴性结果时,也需要通过CK19检测观察其在原癌组织中的表达[12]。
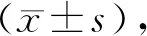
2 结果
2.1 SLNB对判断腋窝淋巴结转移的诊断价值 所有患者均检出SLN。其中NAC组共检出83枚,平均(1.72±0.48)枚,发生ALN转移27例(转移率56.25%,其中4例SLN阴性);手术组共检出135枚,平均(1.79±0.53)枚,发生ALN转移44例(转移率57.14%,其中6例SLN阴性)。在两组患者中,SLNB对判断ALN转移的敏感度、特异度、准确率、阳性预测值、阴性预测值以及假阴性率的差异均无统计学意义(P>0.05),见表2。
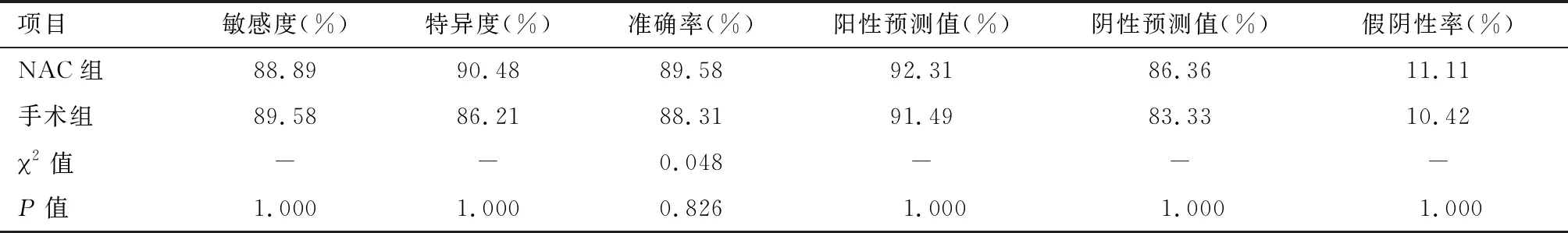
表2 两组SLNB 判断腋窝淋巴结转移的价值比较
2.2 不同检测方法的诊断效率比较 125例患者中,常规病理检测阳性43例。OSNA 检测阳性48例(假阳性12例)、阴性77例(假阴性7例),FS检测阳性37例(假阳性2例)、阴性80例(假阴性8例),TIC检测阳性46例(假阳性8例)、阴性79例(假阴性5例)。典型病例染色及OSNA定量检测结果见图1~4。3种方法的敏感度、阳性预测值、阴性预测值以及假阴性率的差异均无统计学意义(P>0.05),OSNA的特异度和准确率低于FS和TIC,差异有统计学意义(P<0.05)。见表3。
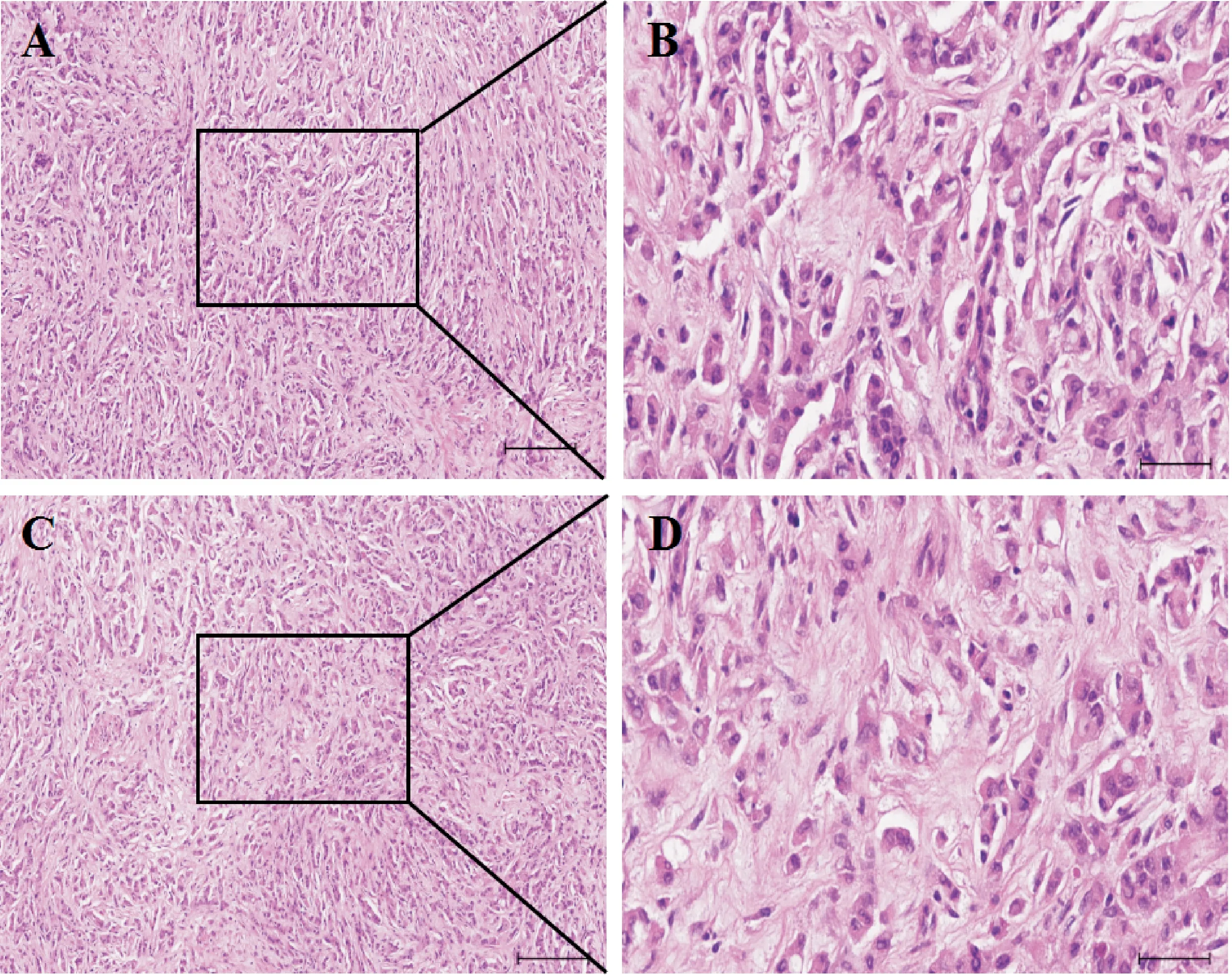
注:A、B为术中SLN冰冻切片,C、D为术后SLN石蜡切片; A、C:×50倍,B、D:×200倍
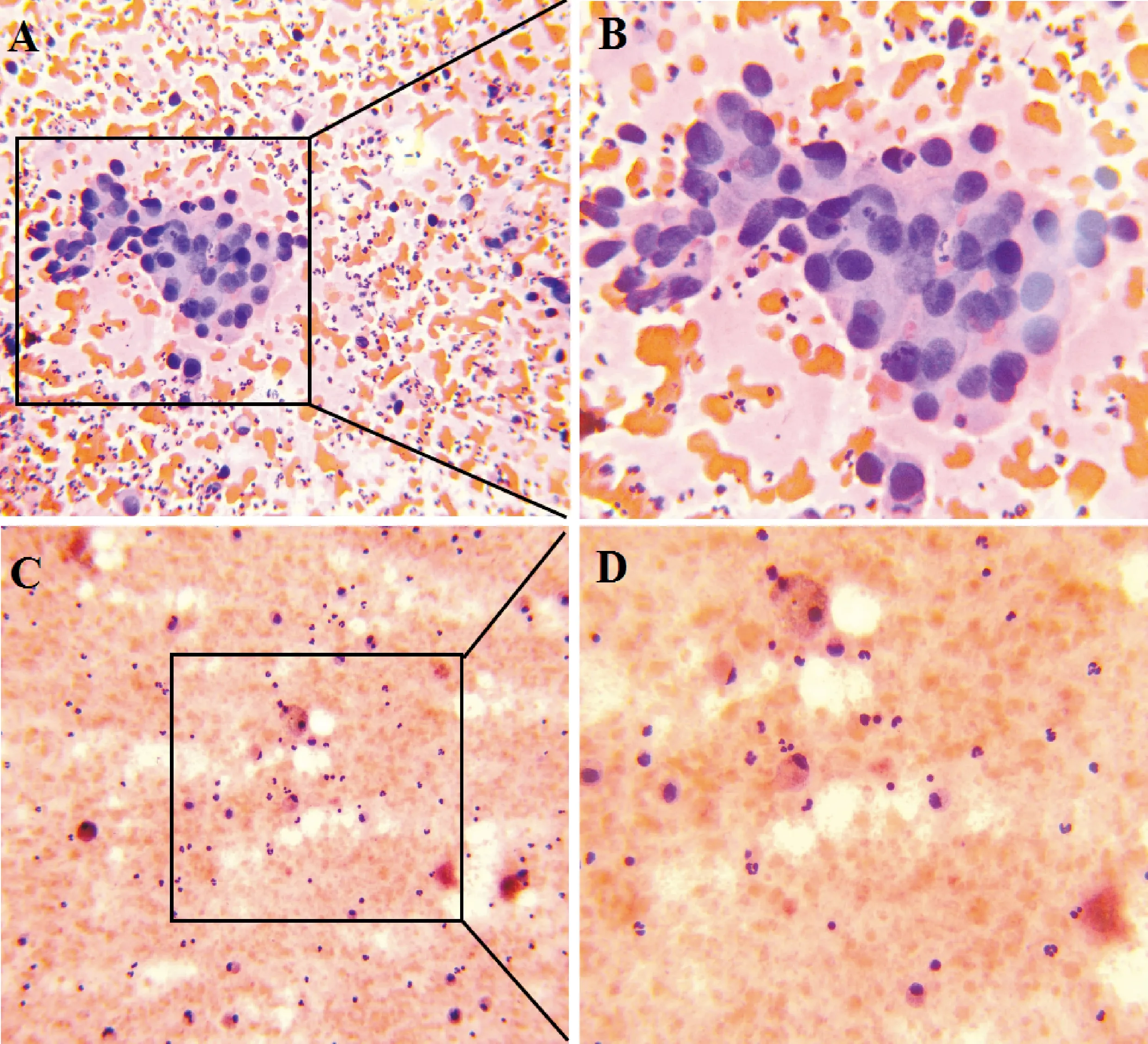
注:A、B为阳性病例,C、D为阴性病例;A、C:×200倍,B、D:×400倍

(++)、(+)、(-)表示CK19-mRNA水平分别为>5×103、2.5×102 ~ 5×103、<2.5×102 copies/μL

表3 3种不同检测方法对SLN转移的诊断价值比较
3 讨论
由于ALN转移是评估乳腺癌患者预后的一个重要独立危险因素,准确评估乳腺癌发生ALN转移情况是制定治疗方案的关键依据,而癌细胞通过淋巴系统转移,最先在SLN出现症状,即原发肿瘤区域淋巴结汇流的第一站。研究显示,若SLN未发生癌细胞转移,原发肿瘤区域其他淋巴结也就不会有肿瘤转移,因而SLN的转移情况可以作为同一淋巴汇流区域其他淋巴转移状况的判断指标[2]。而SLNB具有高检出率、低阴性率且创伤较小等特点,在评价肿瘤临床分期和判断是否发生ALN转移中具有重要应用价值。同时,SLNB现已取代ALND成为许多早期乳腺癌患者的标准方案,SLN阴性患者可避免行ALND,从而让患者避免遭受因ALND而引起的上肢水肿、关节功能障碍等并发症,让患者获益良多。另一方面,NAC是目前治疗乳腺癌的重要手段,对局部晚期患者疗效确切,对临床分期为Ⅰ期和Ⅱ期患者也具有良好效果,通过NAC可使肿瘤肿瘤降期从而提高了手术切除率[5]。已有诸多研究报道指出了在NAC前行SLNB对NAC方案的选择及制定的重要价值,但考虑到因化疗可能会对流入SLN的淋巴管起到破坏作用或改变淋巴的汇流途径,因此研究者对于在NAC后行SLNB对于预测淋巴结转移的准确性仍存在争议[13]。另一方面,术中对SLN的转移状况进行快速、准确的诊断,可以避免SLN阴性患者行ALND,SLN阳性患者则可在术中同时行ALND,从而避免二次手术。因此,进一步探讨NAC是否会影响SLNB的诊断效率,为临床选择SLNB的时机具有重要意义。
基于此,本研究根据患者采取的治疗方案,观察比较了直接手术治疗和NAC治疗后患者的SLNB的诊断效率情况,结果发现在纳入研究的125例患者中均检出了SLN,其中NAC组48例患者共检出83枚,平均(1.72±0.48)枚,发生ALN转移27例(转移率56.25%,其中4例SLN阴性);手术组77例患者共检出135枚,平均(1.79±0.53)枚,发生ALN转移44例(转移率57.14%,其中6例SLN阴性)。在两组患者中,SLNB对判断ALN转移的敏感度、特异度、准确率、阳性预测值、阴性预测值以及假阴性率的差异均无统计学意义(P>0.05),这说明NAC并不会影响乳腺癌患者SLNB的结果,因而可以认为在NAC后行SLNB同样也能让患者获益,而且在NAC后通过SLNB评估患者ALN转移状态,患者在避免第2次手术的同时,还为更快开始NAC治疗节约了时间;还有助于了解化疗对ALN的效应情况,对ALN转移可能还具有更好的预后评估价值[14-15]。
另一方面,快速、准确评估SLN的转移状态是发挥术中SLNB价值的关键。虽然传统的FS诊断SLN的敏感度和特异度较高,但假阴性率约为 10%~20%,TIC特异度高但敏感度不理想,且FS和TIC还都存在主观性、非标准化、检测的组织量少等缺点,因此探寻更为准确、快速、简便的诊断技术一直是该领域研究的重点。随着分子生物学的快速发展,OSNA技术应运而生,该技术运用分子生物学分析方法检测淋巴结转移,具备高精确度与客观性[16]。通过核酸扩增法精准检测样本组织中肿瘤靶向细胞角蛋白19mRNA的含量来判断肿瘤的转移情况,具有简便、快速、敏感度高等特点,适合于 SLN 转移的术中检测[9]。OSNA通过乳腺癌SLN中的特异性分子标志物CK19,OSNA技术可以在没有进行RNA纯化的情况下进行基因扩增,并且可以用引物和DNA聚合酶的混合物在恒温条件下孵育样品,一步完成,耗时短,且操作较为简便,准确性高[17]。为了进一步验证OSNA对SLNB的应用价值,本研究以术后病理诊断为金标准,比较了OSNA与FS和TIC三种检测方法的诊断效率。结果显示,虽然OSNA的特异度(85.37%)和准确率(84.80%)略低于FS和TIC(特异度分别为:97.56%、90.24%,准确度分别为:92.00%、90.40%)(P<0.05),但3种方法的敏感度、阳性预测值、阴性预测值以及假阴性率的差异均无统计学意义(P>0.05)。需要注意的是,在传统的FS和TIC检测中,是将SLN标本一切为二进行检测,而在本研究中为了配合ONSA检测,统一将蜡块切分为了4块,因而使得本研究FS和TIC的敏感性显著提高。结合本研究分析结果,可以认为OSNA对SLNB诊断的特异度和准确率是可接受的,且具有较高的灵敏度,且操作更简单、更标准化,结果更为客观,可以作为乳腺SLNB诊断的一种新手段进行推广使用。
综上所述,本研究借鉴国内外同类研究的基本方法,以NAC后的患者为主要观察对象,重点探讨了NAC是否会影响SLNB结果,同时还分析了OSNA的诊断价值。研究发现NAC不会影响SLNB的结果,OSNA具有较高的敏感度,特异度和准确率可接受。笔者认为本研究结果对临床在NAC前后选择SLNB的时机具有重要参考价值,NAC后行SLNB或许可让患者获益更多;OSNA可作为乳腺癌SLNB术中诊断的一种新手段推广使用。但本研究对象未能做到随机分组,且样本量较少,仍需要进行更大样本量的随机对照研究结果以进一步证实。
利益相关声明:所有作者无利益冲突。
作者贡献说明:郭绍文负责课题设计和论文撰写;鄂裘恺、李双双、叶曼娜、汪成负责病历资料、样本及素材等收集整理、数据统计分析,叶辉负责课题总体把关和论文审核。

