电针耳迷走神经对断奶前母本隔离模型小鼠焦虑、抑郁样行为的影响
吴 楠,王 强,2,3,李永丰,2,3,吴宇蔚,2,3,乔海法,2,3,李国徽,4*,袁 伟,2,3*
1 陕西中医药大学针灸推拿学院,陕西 咸阳 712046;
2 陕西省针药结合重点实验室,陕西 咸阳 712046;
3 咸阳市神经生物学(针灸)重点实验室,陕西 咸阳 712046;
4 宁夏医科大学附属银川市中医医院,宁夏 银川 750010
抑郁症是以持续的情绪低落、兴趣减退、失眠等为主要临床表现的疾病[1]。世界卫生组织调查数据显示,近年来抑郁症的患病率呈上升趋势,抑郁症已经成为危害人类健康的主要疾病之一[2]。有研究发现,抑郁症在发病年龄上呈现出年轻化趋势,青少年抑郁症的患病率为5%~8%[3],成为威胁青少年身心健康的主要疾病之一,其高患病率给患者及其家庭、社会都带来了巨大的影响。由于儿童或青少年正处于生长发育的特殊阶段,传统单胺神经递质类药物以及选择性5-羟色胺(5-hydroxytryptamine,5-HT)再摄取抑制剂类药物的疗效欠佳且具有一定的局限性。研究显示,电针治疗抑郁症具有良好疗效[4],且具有安全、经济、毒副作用小等优势,在情志类疾病的治疗中应用较为广泛。迷走神经耳支主要分布于耳甲区,治疗抑郁症时常将其作为针刺部位[5],但其具体作用机制尚不完全清楚。
有研究表明,5-HT和抑郁症关系密切[6],而色氨酸羟化酶(tryptophan hydroxylase,TPH)是合成神经递质5-HT过程中重要的酶,其中TPH2主要表达于脑干中缝神经元和肠道肌肠层神经元,是5-HT神经元的特异性标志物之一。中缝背核(dorsal raphe nucleus,DRN)中有大量5-HT神经元的表达[7],其活性水平降低会影响5-HT系统的稳定性,导致个体情绪的异常[8]。此外,压力能显著影响前额叶皮层(prefrontal cortex,PFC)的神经元活性,特别是早期生活压力能显著影响个体的行为及神经发育,严重影响其情绪,甚至可能诱发抑郁症[9-10]。但是,电针耳迷走神经是否能改变DRN、PFC的脑区活性和DRN脑区的5-HT神经元数量,从而缓解焦虑、抑郁样行为尚不清楚。本研究采取断奶前母本隔离(preweaning maternal separation,PMS)C57BL/6小鼠模型模拟儿童抑郁症,观察电针耳迷走神经对PMS诱发的焦虑、抑郁样行为的影响及其可能的作用机制,为电针耳迷走神经治疗青少年抑郁症提供理论依据。
1 材料与方法
1.1 实验动物
本实验采用SPF级C57BL/6小鼠的繁殖子代鼠,繁殖鼠购自西安交通大学医学院动物中心,鼠龄7~8周,体质量(20±2)g,实验动物生产许可证号:SCXK(陕)2018-001。饲养环境均为恒定湿度(50±10)%,恒定温度(22±2) ℃,12 h昼夜交替照明(光照时间8:00—20:00),自由获取食物和水。实验过程严格按照科技部《关于善待实验动物的指导性意见》《陕西省实验动物管理办法》执行。
1.2 主要试剂与设备
原癌基因蛋白(c-fos)抗体(美国Cell Signaling Technology公 司,生 产批 号:2250S);TPH2抗 体(美国Cell Signaling Technology公司,生产批号:33113ES60);Alexa Fluor 647山羊抗兔荧光二抗(上海翊圣生物科技有限公司,生产批号:33113ES60);多聚甲醛(国药集团化学试剂有限公司,生产批号:30625-89);旷场实验箱、高架十字迷宫、悬尾测试箱(深圳市瑞沃德生命科技有限公司);行为学记录分析系统(荷兰Noldus公司,型号:EthoVision);韩氏电针仪(南京济生医疗科技有限公司,型号:HANS-200A);冰冻切片机(美国Thermo Scientific公司,型号:HM525NX);荧光显微镜(德国徕卡公司,型号:
S220)。
1.3 实验动物分组和模型制备
将3只成年C57BL/6雄鼠与9只成年C57BL/6雌鼠随机合笼(雄雌比1∶3),待雌鼠受孕后采用随机数字表法分为对照组和母本隔离组,对照组常规饲养,正常提供食物和饮水。母本隔离组在造模完成后,其子代采用随机数字表法分为模型组和电针组,每组10只。母本隔离组的母鼠生产后,母本正常照顾至出生第13天,从第14天开始每天将母鼠移出居住笼4 h,留幼仔单独居住,4 h后将母鼠移回居住笼,直至21 d断奶,通过旷场、高架十字迷宫测试来确定母本隔离模型制备是否成功[11]。
1.4 干预方法
模型建立后,电针组在异氟烷麻醉下进行电针干预。采用0.25 mm×13 mm不锈钢针灸针进行针刺,平刺2 mm,针刺穴位参照《常用实验动物针灸穴位图谱及穴位》取双侧耳甲区,电针过程采用连续波,频率2 Hz,强度1 mA,1次/d,10 min/次,6 d/疗程,共干预2个疗程。对照组、模型组参照电针组进行麻醉束缚,但不进行电针干预。
1.5 观察指标
1.5.1行为学检测 干预完成后采用旷场测试、高架十字迷宫测试、悬尾测试等方法对各组小鼠进行行为学测试。
1.5.1.1旷场测试 在旷场测试前2 h将小鼠放在行为测试房中适应环境,此后,将小鼠置于旷场实验箱(40 cm×40 cm×40 cm)中进行旷场测试。小鼠头部固定朝向同1个方向,自由活动10 min并记录小鼠总移动距离及中心区域时间百分比。
1.5.1.2高架十字迷宫测试 在高架十字迷宫测试前2 h将小鼠放在行为测试房中适应环境,此后,将小鼠置于高架十字迷宫[2条开臂(30 cm×8 cm)、2条闭臂(30 cm×6 cm×15 cm)、中心区域(8 cm×8 cm)、距地面高度55 cm]中进行高架十字迷宫测试。小鼠头部正对一侧开臂方向,自由活动10 min,记录小鼠在开臂花费时间、开臂总移动距离及进入开臂次数。
1.5.1.3悬尾测试 在悬尾测试前2 h将小鼠放在行为测试房中适应环境,此后,将小鼠置于悬尾实验箱(30 cm×30 cm×50 cm)进行悬尾测试。将医用胶带粘贴在距离小鼠尾尖1 cm处并将小鼠悬挂在悬尾支架上,使小鼠鼻尖与设备台面距离约35 cm。使用摄像机记录小鼠6 min活动情况,对每只小鼠的活动时间进行统计分析。
每只小鼠完成以上3项测试后,均喷洒30%酒精去除小鼠在活动箱遗留的气味,防止对下1只小鼠实验结果造成干扰。
1.5.2脑组织c-fos及5-HT表达水平检测 在行为学测试结束后,将小鼠单独置于安静环境90 min后取材。通过腹腔注射过量乌来糖致小鼠安乐死,使用0.9% NaCl溶液对小鼠心脏进行灌注,灌注至肝脏和四肢发白,右心耳无血液流出,将输液管与4%多聚甲醛溶液连接。灌注完成后迅速将脑组织取出,置于4 %多聚甲醛溶液中固定24 h。将固定好的脑组织取出依次放入20%、30%蔗糖溶液中脱水,随后将脑组织放入包埋盒中,滴入包埋剂用冰冻切片机连续切片(40 μm),收集 PFC、DRN脑区备用。切片用磷酸盐缓冲液(phosphate buffered saline,PBS)洗3次,每次10 min。使用含3‰ triton X-100的山羊血清封闭1 h,滴加c-fos(1∶1 000)和TPH2(1∶1 000)一抗4 ℃冰箱孵育过夜,孵育完成后使用PBS溶液洗3次,10 min/次,滴加Alexa Fluor 647荧光二抗(1∶400)室温孵育2 h,孵育完毕后使用PBS洗3次,10 min/次。4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)中孵育10 min,使用抗荧光淬灭封片剂封片,用荧光显微镜观察PFC、DRN脑区c-fos和DRN脑区5-HT的表达,并在相应脑区选择相同位置的典型区域(200 μm×200 μm)进行细胞数量统计。
1.6 统计学方法
采用SPSS 22.0统计软件进行数据分析。计量资料符合正态分布者,数据以(xˉ±s)表示;组间比较采用单因素方差分析,组间两两比较采用Turky法。P<0.05表示差异具有统计学意义。
2 结 果
2.1 3组小鼠行为学指标比较
2.1.13组旷场实验行为比较 3组总移动距离和中心区域时间百分比比较,差异均具有统计学意义(P<0.05);与对照组比较,模型组总移动距离和中心区域时间百分比均明显降低,差异均具有统计学意义(P<0.05);与模型组比较,电针组总移动距离和中心区域时间百分比均明显更高,差异均具有统计学意义(P<0.05)。见图1、表1。

图 1 3组小鼠旷场活动轨迹图Figure 1 Representative tracing of movement in the open field in three groups

表1 3组旷场测试检测指标比较(xˉ±s)Table 1 Comparison of detection indicators in open field in three groups (xˉ±s)
2.1.23组高架十字迷宫行为比较 3组开臂花费时间、开臂总移动距离及进入开臂次数比较,差异均具有统计学意义(P<0.05);与对照组比较,模型组开臂花费时间、开臂总移动距离及进入开臂次数均明显降低,差异均具有统计学意义(P<0.05);与模型组比较,电针组开臂花费时间、开臂总移动距离及进入开臂次数均明显更高,差异均具有统计学意义(P<0.05)。见图2、表2。

表2 3组高架测试检测指标比较(xˉ±s)Table 2 Comparison of test indexes in the elevated maze in three groups (xˉ±s)

图2 3组高架十字迷宫活动轨迹图Figure 2 Representative tracing of movement in the elevated maze in three groups
2.1.33组悬尾测试行为比较 3组小鼠悬尾静止时间比较,差异具有统计学意义(P<0.05);与对照组比较,模型组悬尾静止时间明显增加,差异具有统计学意义(P<0.05);与模型组比较,电针组悬尾静止时间明显更低,差异具有统计学意义(P<0.05)。见图3、表3。

图 3 3组悬尾测试热区图Figure 3 Heat maps in the tail suspension test in three groups

表3 3组悬尾测试指标比较(xˉ±s)Table 3 Comparison of suspension tail test indexes in three groups (xˉ±s)
2.2 3组DRN、PFC脑区c-fos表达水平比较
3组DRN、PFC脑区c-fos阳性神经元数量比较,差异均具有统计学意义(P<0.05);与对照组比较,模型组DRN、PFC脑区c-fos神经元数量均明显降低,差异均具有统计学意义(P<0.05);与模型组比较,电针组DRN、PFC脑区c-fos神经元数量均明显更高,差异均具有统计学意义(P<0.05)。见表4、图4~5。

图4 3组小鼠DRN脑区c-fos表达(×20)Figure 4 Expression of c-fos in the DRN in three groups (×20)

表4 3组DRN、PFC脑区c-fos阳性细胞数量比较(xˉ±s)Table 4 Comparison of the number of c-fos positive cells in the DRN,PFC in three groups (xˉ±s)
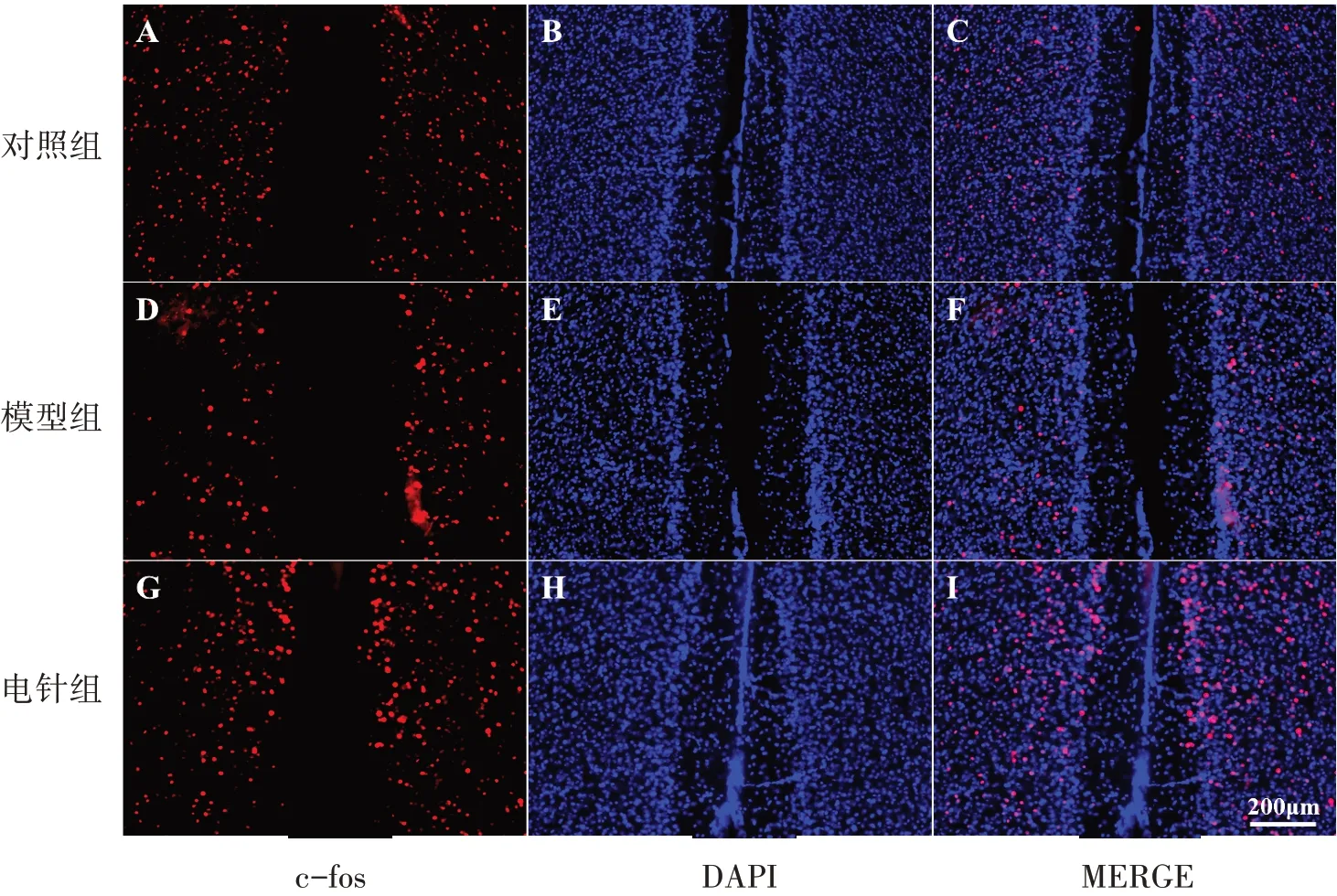
图5 3组小鼠PFC脑区c-fos表达(×20)Figure 5 Expression of c-fos in the PFC in three groups (×20)
2.3 3组5-HT神经元数量比较
3组小鼠DRN脑区5-HT阳性神经元数量比较(P<0.05);与对照组比较,模型组DRN脑区5-HT神经元数量明显降低(P<0.05);与模型组比较,电针组DRN脑区5-HT神经元数量明显更高,差异具有统计学意义(P<0.05)。见图6、表5。
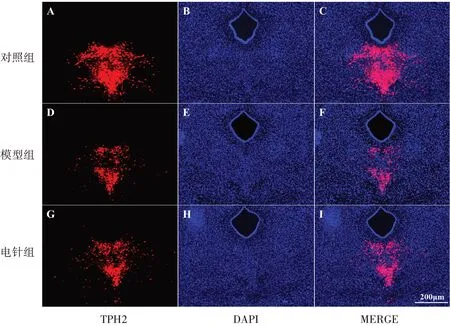
图6 3组DRN脑区5-HT神经元表达(×20)Figure 6 Expression of 5-HT neurons in the DRN in three groups (×20)

表5 3组DRN脑区5-HT神经元数比较(xˉ±s)Table 5 Comparison of the number of 5-HT neurons in DRN in three groups(xˉ±s)
3 讨 论
3.1 电针耳迷走神经可改善PMS模型小鼠焦虑、抑郁样行为
通过旷场和高架十字迷宫测试可以检测小鼠的焦虑样行为[12],悬尾测试反映小鼠的抑郁样行为[13]。本研究结果显示,PMS可以减少C57BL/6小鼠在旷场测试中总移动距离、中心区域时间百分比;减少高架十字迷宫测试中开臂花费时间、开臂总移动距离及进入开臂次数;增加悬尾测试中悬尾静止时间。通过电针耳迷走神经干预后,电针组中心区域时间百分比和开臂花费时间均高于模型组,悬尾静止时间低于模型组,这提示电针迷走神经干预可改善PMS所致小鼠焦虑、抑郁样行为。这可能与以下因素有关:① 早期的生活经历与个体的行为及神经发育密切相关[14],PMS可引起个体焦虑及抑郁样行为的发生,其作为一种慢性应激压力,诱发了小鼠焦虑、抑郁样行为的产生。抑郁症在中医学中属于“郁证”的范畴,情思忧虑会导致气行不畅,进而导致抑郁症的出现[15]。耳穴中心、神门穴等位于耳甲区,刺激以上穴位分区可改善气机郁滞,调整相应的脏腑功能。② 耳甲区分布着丰富的迷走神经,电针刺激耳甲区迷走神经,可影响迷走神经所属的副交感神经系统,令其与交感神经系统共同调节机体内分泌系统的功能,从而改善个体情志状态。
3.2 电针耳迷走神经改善PMS所致焦虑、抑郁样行为可能与调节c-fos及5-HT的表达有关
本研究结果显示,PMS可使小鼠PFC、DRN脑区的c-fos表达水平降低,DRN脑区5-HT神经元数量明显降低。电针耳迷走神经后,电针组PFC、DRN脑区c-fos表达水平明显上升,DRN脑区5-HT神经元数量明显升高,这提示电针耳迷走神经改善PMS所致焦虑、抑郁样行为可能与调节c-fos和5-HT的表达有关。这可能与以下因素有关:① 亲本照顾缺失作为一种早期生活压力对PFC、DRN脑区可产生持续性影响[16-17],PMS小鼠PFC脑区活性、体积和厚度均明显减少[18]。电针刺激耳甲区可激活PFC脑区,促进神经元c-fos的表达,有利于受损神经元的修复,从而改善PMS小鼠抑郁样行为。这与FUCHIKAMI等[19-21]研究结果一致。② PMS小鼠DRN脑区5-HT神经元数量明显减少[22-24],DRN脑区5-HT神经元可投射到前脑边缘区及大脑皮层,其神经元功能低下是抑郁症的病理、生理基础[25-26]。电针耳迷走神经干预后,TPH2的神经元表达水平提高,这提示电针刺激耳迷走神经使PMS小鼠5-HT神经元数量明显增加,DRN脑区5-HT系统趋于稳定,从而改善其焦虑、抑郁样情绪,这一改善可能依赖于调整5-HT相关受体的功能。其中,5-HT1A型受体(serotonin1Areceptor,5-HT1AR)是与抑郁症关系最密切的受体之一,在PFC脑区大量表达[27-28]。但其是否通过调控5-HT1A型受体以改善PMS诱发的焦虑、抑郁样行为尚不清楚,还需要下一步继续深入研究。
4 小 结
电针耳迷走神经可以改善PMS小鼠焦虑、抑郁样行为,其作用机制可能与改善c-fos表达水平,增加DRN脑区5-HT神经元的数量相关。

