慢性脑缺血模型大鼠学习记忆障碍与脑白质神经纤维、周细胞变化相关性分析
黄 佳,王梦雪,倪静蕾,梁胜祥,林冰冰
1 福建中医药大学康复医学院,福建 福州 350122;
2 福建中医药大学康复产业研究院,福建 福州 350122
血管性认知障碍(vascular cognitive impairment,VCI)是脑血管病变及其危险因素导致的血管性脑损伤[1],是除了阿尔茨海默病外最常见的痴呆症亚型[2]。VCI患者常伴有记忆功能下降,这将影响患者日常生活活动能力[3]。在血管性疾病发生时,如何及时预测或诊断认知障碍的发生是临床亟需解决的问题。研究显示,髓鞘丢失和血管周围间隙扩张等病理变化可在一定程度上预测血管性认知障碍[4],但新的预测靶标及其作用机制仍然是目前研究的热点。
研究显示,持续脑血流的慢性下降是VCI发展的主要机制[5],脑血流灌注减少与痴呆症的严重程度密切相关[6]。多项临床研究显示,慢性脑缺血导致弥漫性白质纤维的改变与认知障碍密切相关[7-8],但其分子机制尚未完全明确。双侧颈总动脉阻断建立的慢性脑缺血模型已被广泛用于研究VCI[9-13]。本研究采用慢性脑缺血模型模拟血管性认知障碍损害,通过弥散张量成像(diffusion tensor imaging,DTI)观察海马脑区和胼胝体白质神经纤维结构病理变化,分析学习记忆障碍中与白质神经纤维损害相关的髓鞘碱性蛋白和周细胞血小板衍生生长因子受体β(platelet-derived growth factor receptor beta,PDGFR-β)变化,旨在阐明慢性脑缺血所致认知障碍与白质神经纤维损伤的相关性,探讨VCI的预测分子靶标。
1 材料与方法
1.1 实验动物
选择24只SPF级Sprague Dawley雄性大鼠,体质量(280±30)g,实验动物购自上海斯莱克公司。实验动物生产许可证号:SCXK(沪)2017-0005。实验动物由福建中医药大学实验动物中心饲养[许可证号:SCXK(闽)2020-0002],每笼≤5只,给予充足、自由饮食。所有实验程序均严格按照动物实验伦理规章进行。
1.2 主要实验试剂与设备
动物用青霉素钠(山东鲁抗医药股份有限公司,规格:160万单位);异氟烷(深圳瑞沃德生命科技有限公司,批号:R510-22);戊巴比妥钠(美国默克Sigma公司,批号:CQ6125000);坚牢蓝(luxol fast blue,LFB)染色液(北京索莱宝科技有限公司,批号:G3245);Bicinchoninic acid蛋白浓度测定试剂盒(美国Thermo Fisher Scientific公司);1∶3 000兔抗髓鞘碱性蛋白(myelin basic protein,MBP)抗体(美国Proteintech公司,批号:10458-1-AP);1∶600兔抗PDGFR-β抗体(英国Abcam公司,批号:ab32570);1∶5 000山羊抗兔抗体(英国Abcam公司,批号:ab6721);Morris水迷宫(上海欣软信息科技有限公司,型号:XR-XM101);小动物核磁共振成像仪(德国BRUKER公司,型号:MiniMR-60 MRI system 7.0 T);小动物呼吸麻醉机(深圳瑞沃德生命科技有限公司);小动物生理检测仪(美国型号:Smiths Medical公司,SurgiVet V3395TPR);Western blot系统(美国Bio-Rad公司)。
1.3 实验动物模型制备
24只大鼠按照随机数字表法分为假手术组、术后28 d组、术后56 d组,每组8只。参考FARKAS[14]双侧颈总动脉结扎造模方法模拟VCI慢性脑缺血病理状态进行实验动物模型构建。所有大鼠术前均禁食12 h,随后对大鼠称取体质量,用2%戊巴比妥钠(0.2 mL/100 g)进行腹腔注射麻醉,医用胶带固定大鼠四肢,使其在手术保温垫上处于仰卧位,进行颈部酒精消毒、剃毛备皮,沿大鼠颈正中线切开,分离浅表组织,分别从左、右两边的胸骨舌骨肌、胸锁乳突肌和肩胛舌骨肌交叉点处向下找到两侧颈总动脉,分离颈总动脉与其旁边伴行的迷走神经。假手术组大鼠仅分离双侧颈总动脉,不进行结扎。术后28 d组和术后56 d组大鼠在双侧颈总动脉充分暴露后,先用不可吸收的外科缝合线结扎左侧颈总动脉,5 min后再结扎右侧颈总动脉,随后缝皮、清洁创口。所有大鼠在缝皮后腹腔注射20万单位/mL动物用青霉素钠溶液(0.05 mL/100 g)。
1.4 观察指标
分别在造模成功后第28、56天进行以下指标评价。
1.4.1学习记忆能力 采用Morris水迷宫空间探索实验评估3组大鼠的学习记忆能力。在Morris水迷宫(直径150 cm×高50 cm)中,充满适宜温度(25±3)℃ 的水,水迷宫分为4个象限,在第3象限放入平台(直径10 cm×高30 cm),高出水平面5 cm;大鼠头部朝向池壁,从4个不同的象限中点放入水中,让大鼠在水中自由游动,大鼠自行登上平台或实验者引导大鼠至平台后,让大鼠在平台上停留30 s,共训练4 d。实验第5天进行空间探索测验,移走平台,大鼠在90 s内寻找原平台置放的目标区域,记录大鼠进入目标区域(第3象限)的次数、在目标区域(第3象限)停留时间以及逃避潜伏期、路径、平均速度。将摄像机与Super Maze动物行为学视频采集分析系统连接,摄像机安装在水迷宫上方监测大鼠游泳动态。实验后将大鼠用吸水纸吸干体表的水分,必要时采用白炽灯烘干后,放回笼中。
1.4.2大鼠胼胝体和海马脑区的白质神经纤维的变化 采用DTI检测3组大鼠胼胝体和海马脑区的白质神经纤维的变化情况。3组大鼠用3%异氟烷在氧气和空气混合气体(1∶4)中诱导麻醉,并用100 μg/mL的盐酸美托嘧啶(0.15 mL/300 g)经下肢肌内注射以诱导大鼠深度麻醉。扫描时,大鼠置于核磁共振扫描床上呈俯卧位,头部置于大鼠专用头部表面线圈(扫描架内径16 cm,使用内径38 mm)内,以牙钩和双侧耳杆固定其头部,扫描过程中维持2%异氟烷气体麻醉,水循环加热系统维持大鼠体温相对恒定。整个过程中通过小动物生理检测仪实时监测大鼠体温、呼吸频率、心率。DTI扫描参数如下:回波时间(time of echo,TE)=32.25 ms,重复时间(time of repetition,TR)=12 000 ms,视野(field of view,FOV)=32 mm×32 mm,分割(segment)=4,平均次数(averages)=1,图像大小(image size)=128×128,层数(slices)=48,弥散敏感系数b=1 000 s/mm2,层厚(slice thickness)=0.56 mm,无层间隙(no slice gap),时间(time)=28 min。
采用FMRIB's Software Library(http://fmrib.ox.ac.uk/fsl)和ITK-SNAP软件进行数据分析。首先,进行涡流校正、颅骨剥离,得到全脑掩膜图像;然后,计算大鼠全脑各向异性分数(fractional anisotropy,FA)和平均弥散率(mean diffusivity,MD)参数图,手动确定胼胝体和海马脑区感兴趣区,提取感兴趣区FA和MD平均值。
1.4.3大鼠胼胝体白质髓鞘脱失情况 采用坚牢蓝(luxol fast blue,LFB)染色法检测大鼠胼胝体白质髓鞘脱失情况。用2%戊巴比妥钠(0.2 mL/100 g)腹腔注射麻醉大鼠,0.9% NaCl溶液和4%多聚甲醛经心内灌注,脑组织行石蜡包埋,冠状位切片,切片厚度为5 μm;经脱蜡脱水后,加入0.1% LFB溶液,于室温密封浸染24 h;脑片经蒸馏水清洗后,由95%乙醇、0.05%碳酸锂水溶液、70%乙醇分色,直至显微镜下观察灰质和白质部位区分清晰,背景无色为止;中性树胶封片。每组随机选择3只大鼠,在正置显微镜下观察并拍照,每只大鼠取2张脑片,通过LFB染色法评价大鼠胼胝体白质髓鞘脱失情况。评分标准如下,① 0级:正常;② 1级:神经纤维结构紊乱;③ 2级:明显空泡形成;④ 3级:有髓神经纤维消失。
1.4.4大鼠胼胝体和海马脑区的髓鞘碱性蛋白MBP和周细胞标志物PDGFR-β蛋白表达 采用免疫印迹法检测大鼠胼胝体和海马脑区的髓鞘碱性蛋白MBP和周细胞标志物PDGFR-β蛋白表达。用2%戊巴比妥钠(0.2 mL/100 g)腹腔注射麻醉大鼠,0.9% NaCl溶液经心内灌注,闸刀斩断大鼠颈椎,在冰面上钝性剥离脑组织,分别剥离胼胝体和海马脑区,并迅速放入液氮中冷冻,用组织剪将其剪碎放入匀浆机,加入等同于组织体积10倍的裂解液,充分裂解后离心30 min,取上清液,Bicinchoninic acid定量调齐浓度(5 μg/μL)并高温变性(95~100 ℃,5 min)。配制分离胶,经上样、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳、聚偏二氟乙烯膜湿转进行转膜后,Tris盐酸缓冲盐溶液加吐温漂洗5 min,用5%脱脂乳在室温下封闭膜1 h,在4 ℃的环境下分别加入相应的一抗孵化过夜。Tris盐缓冲液洗膜4次(5 min/次),37 ℃环境下用二抗避光孵育1 h。最后用红外成像系统对曝光后的胶片扫描存档,利用Image J软件对目标带灰度值进行定量分析。
1.5 统计学方法
采用SPSS 26.0统计软件进行数据分析。计量资料符合正态分布者,数据以(xˉ±s)表示,组内不同时间点数据比较采用重复测量方差分析;组间比较采用单因素方差分析,两两比较方差齐时采用LSD-t法,方差不齐时采用Tamhane'sT2法;采用Pearson相关性分析MD与穿越平台次数的相关性。P<0.05为差异具有统计学意义。
DTI数据分析步骤如下:① 使用MRIcroN软件将DICOM格式的数据转换为NIFTI格式;② 对DTI图像进行涡流校正处理;③ 提取颅内掩模图像,计算b0像和全脑FA像;④ 基于一般线性模型,采用单因素方差分析,对平滑后数据进行统计分析。P<0.005,团簇>10为差异具有统计学意义。
2 结 果
2.1 3组学习记忆能力比较
Morris水迷宫定位航行实验结果显示,与假手术组比较,术后28 d组第2~4天逃避潜伏期均明显延长,术后56 d组第3天逃避潜伏期明显延长,差异均具有统计学意义(P<0.05)。空间探索实验结果显示,与假手术组比较,术后28 d组和术后56 d组大鼠穿越平台次数、目标象限时间占比均明显减少,差异具有统计学意义(P<0.05)。见表1~2及图1。

图1 3组大鼠水迷宫测试期游行轨迹图Figure 1 The trajectories of rats during probe test in the Morris water maze

表1 3组逃避潜伏期比较(xˉ±s) sTable 1 Comparison of escape latency in three groups (xˉ±s) s

表2 3组穿越平台次数、目标象限时间占比和速度比较(xˉ±s)Table 2 Comparison of crossing platforms times,target quadrant time ratio and speed in three groups (xˉ±s)
2.2 3组胼胝体和海马脑区白质神经纤维变化比较
与假手术组比较,术后28 d组、术后56 d组左、右侧胼胝体和左、右侧海马脑区白质神经纤维变化的MD值均明显降低(P<0.05)。与术后28 d组比较,术后56 d组MD值有下降趋势,但差异均无统计学意义(P>0.05)。见表3。

表3 3组胼胝体和海马FA、MD值比较(xˉ±s)Table 3 Comparison of FA,MD values of the callous corpus and hippocampus in three groups (xˉ±s)
2.3 3组胼胝体和海马脑区MD值与学习记忆能力的相关性分析
Pearson相关性分析结果显示,3组双侧胼胝体、海马脑区MD值与穿越平台次数均呈正相关关系,差异均具有统计学意义(r=0.832,P<0.01;r=0.777,P<0.01)。见图2。

图2 3组胼胝体、海马脑区MD值与穿越平台次数相关性分析Figure 2 Correlation analysis between MD values of the callous corpus and hippocampus and the number of crossing platforms in three groups
2.4 3组胼胝体髓鞘改变比较
研究结果显示,与假手术组比较,术后28 d组、术后56 d组大鼠胼胝体部位着色程度均较浅,髓鞘结构紊乱明显,甚至出现空洞。见图3。通过对髓鞘紊乱分级进行统计分析发现,与假手术组比较,术后28 d组和术后56 d组髓鞘紊乱分级均明显升高(P<0.05);与术后28 d组比较,术后56 d组大鼠髓鞘紊乱分级差异无统计学意义(P>0.05)。见图4。

图3 3组大鼠胼胝体LFB染色图(×100)Figure 3 LFB staining figure of the callous corpus of rats in three groups (×100)

图4 髓鞘紊乱分级值统计图Figure 4 Statistical plot of graded values of myelin sheath disorders
2.5 3组胼胝体和海马脑区MBP和PDGFR-β蛋白表达含量变化比较
研究结果表明,与假手术组比较,术后28 d组、术后56 d组大鼠胼胝体、海马脑区的髓鞘碱性蛋白MBP蛋白表达水平均明显下降,差异均具有统计学意义(P<0.05);术后28 d组胼胝体PDGFR-β表达水平明显升高(P<0.05),术后28 d组、术后56 d组海马脑区PDGFR-β表达水平均明显下降,差异均具有统计学意义(P<0.05)。与术后28 d组比较,术后56 d组胼胝体PDGFR-β表达水平明显下降,差异具有统计学意义(P<0.05)。见图5、表4。
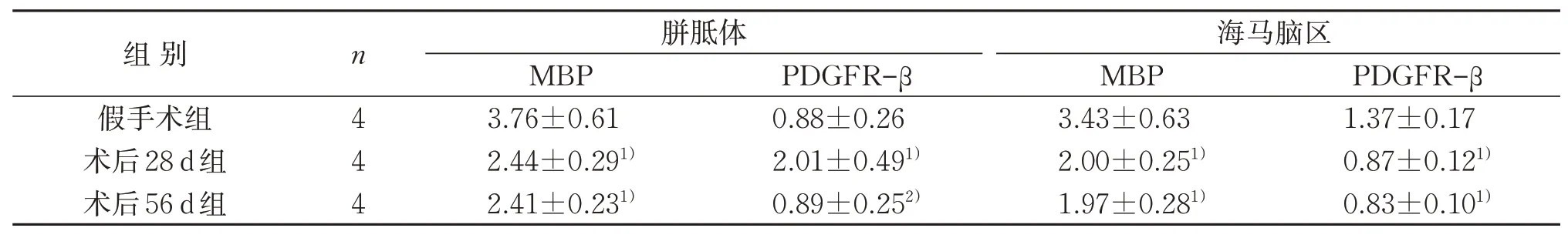
表4 3组胼胝体和海马脑区MBP、PDGFR-β蛋白表达比较(xˉ±s)Table 4 Comparison of MBP,PDGFR-β proteins expression of the callous corpus and hippocampus in three groups (xˉ±s)

图5 胼胝体和海马脑区MBP、PDGFR-β蛋白条带图Figure 5 Bands of MBP, PDGFR-β proteins in the corpus callosum and hippocampus
3 讨 论
3.1 慢性脑缺血模型大鼠学习记忆障碍与胼胝体、海马脑区白质神经纤维及微结构破坏有关
慢性脑缺血所致VCI会出现学习记忆功能下降和日常生活活动能力减退等症状[12-13]。本研究Morris水迷宫结果显示,与假手术组比较,术后28 d组、术后56 d组大鼠逃避潜伏期均明显延长,穿越平台次数和目标象限时间占比均明显减少,提示慢性脑缺血模型大鼠出现学习记忆功能障碍。这与FANG等[9-11,14]研究结果一致。
白质纤维完整性的丧失是慢性脑缺血所致脑损伤的突出病理特征[15-16]。既往研究发现,DTI参数变化(FA、MD)是能够反映白质神经纤维的影像学指标,轻度认知障碍患者胼胝体、穹隆等脑区FA、MD发生明显变化[17-18],胼胝体作为沟通两侧半球的重要信息通道,其功能降低会直接影响双侧海马脑区的信息交流[19-20]。本研究结果显示,与假手术组比较,术后28 d组、术后56 d组大鼠胼胝体、海马脑区MD值均明显下降;双侧胼胝体和双侧海马脑区MD值均与穿越平台次数呈正相关关系。这提示慢性脑缺血模型大鼠学习记忆障碍与胼胝体、海马脑区白质神经纤维破坏有关。此外,本研究结果显示,与假手术组比较,术后28 d组、术后56 d组大鼠胼胝体、海马脑区FA值差异均无统计学意义。这可能是由于体素中交叉纤维的存在导致各向异性降低,限制了FA检测白质神经纤维损伤的能力。这与既往研究发现海马脑区和胼胝体内的微结构改变可以预测认知功能的恢复情况,MD是相对于FA更可靠的检测微结构变化参数的观点相似[21]。
本研究采用LFB染色法和免疫印迹法验证慢性脑缺血对白质神经纤维微结构损伤的影响。研究结果显示,慢性脑缺血会导致胼胝体白质神经纤维结构紊乱,髓鞘排列疏松,随着时间进展,出现白质神经纤维松解和空泡,胼胝体和海马脑区中髓鞘碱性蛋白的减少。这提示慢性脑缺血导致白质纤维完整性发生改变与学习记忆功能下降密切相关。这与既往研究结果一致[12]。
3.2 PDGFR-β可能是反映慢性脑缺血模型大鼠胼胝体和海马脑区白质神经纤维破坏的关键分子
本研究结果显示,与假手术组比较,术后28 d组胼胝体PDGFR-β明显升高,术后28 d组、术后56 d组海马脑区PDGFR-β均明显降低;与术后28 d组比较,术后56 d组胼胝体PDGFR-β明显降低,海马脑区PDGFR-β虽有所降低,但差异无统计学意义。这提示PDGFR-β可能是反映慢性脑缺血模型大鼠胼胝体和海马脑区白质神经纤维破坏的关键分子。这可能与以下因素有关:① 当出现慢性脑缺血时,胼胝体会出现应激反应,术后28 d组胼胝体PDGFR-β应激性增加。这与既往研究发现“PDGFR-β在脑缺血应激性增加”的结果一致[22]。② PDGFRβ蛋白是周细胞重要的标志物,周细胞体数量和PDGFR-β反应性存在强相关性[23]。周细胞作为血脑屏障和中枢神经系统毛细血管的重要组成部分,在调节脑血流低灌注和白质微结构的关联中起着重要作用[24-25]。
4 小 结
慢性脑缺血会导致胼胝体和海马脑区白质神经纤维结构损伤,其中胼胝体PDGFR-β变化可能是预测慢性脑缺血所致认知障碍的关键靶标,这将有助于阐明VCI病情进展的相关神经机制。但本研究仍存在一些局限性:① 实验对象仅涉及慢性脑缺血大鼠,啮齿类动物双侧颈总结扎模型与人类VCI仍有一定差距;② 仅观察了双侧颈总结扎大鼠造模成功后28、56 d的部分病理变化。下一步研究仍需延长观察时间,以探讨慢性脑缺血后胼胝体和海马脑区白质神经纤维结构损伤的连续性变化情况,为VCI治疗最佳时机选择相关研究奠定基础。

