基于TLR4/NF-κB通路探讨藏红花素对局灶性脑缺血再灌注损伤大鼠的神经保护作用
李晓蕾,朱海生,麻瑞娟,胡 科,冯丽娜,王旭东
邯郸市中心医院,河北 邯郸 056000
缺血性脑卒中约占脑卒中患者的72%,具有起病急、进展快的特点,是导致我国居民残疾和死亡的首位病因[1]。通过静脉溶栓或介入治疗及时恢复血流再灌注,挽救缺血半暗带神经元是临床治疗缺血性脑卒中的首选方案。但血流再通后常导致脑功能缺损进一步加重,即脑缺血再灌注损伤,炎症反应、细胞凋亡等是其发生、发展的重要病理机制[2-4]。研究显示,Toll样受体4/核因子-κB(tolllike receptor 4/nuclear factor-κB,TLR4/NF-κB)是调控炎症反应和细胞凋亡的关键信号通路[5],抑制TLR4/NF-κB通路可减轻大鼠脑缺血再灌注损伤[6]。
藏红花素提取自鸢尾科植物藏红花,具有良好的抗炎、抗凋亡等作用[7-8],通过抑制TLR4/NF-κB通路可减轻心衰大鼠炎症反应、心肌细胞凋亡[9]和动脉粥样硬化小鼠神经炎症[10]。有研究报道,藏红花素能够改善脑缺血再灌注损伤大鼠脑功能[11],但其作用机制尚不明确。本研究旨在探讨藏红花素对局灶性脑缺血再灌注(focal cerebral ischemia-reperfusion,FCIR)大鼠神经元的影响及可能的机制,以期为临床防治脑缺血再灌注损伤提供新的思路。
1 材料与方法
1.1 实验动物
选择SPF级雄性SD大鼠128只,7~8周龄,体质量230~260 g,由河北伊维沃生物科技有限公司提供,实验动物生产许可证号:SCXK(冀)2020-002。于室温25 ℃、湿度55%~65%的控制环境中饲养,自由饮水进食。所有实验动物操作均严格遵循动物实验减少、替代、优化原则,本实验方案通过河北省邯郸市中心医院伦理委员会审批通过[批准号:
HDZXLL(K)2021-014]。
1.2 主要实验药物、试剂与仪器
1.2.1实验药物、试剂 藏红花素(纯度≥98%)(美国Sigma公司,批号:E190513b);脂多糖(TLR4激活剂)(美国Invivogen公司,批号:511219ps);氯化三苯四氮唑(triphenyltetrazolium chloride,TTC)染色液、HE染色试剂盒、TUNEL染色试剂盒购自南京建成生物工程研究所(批号分别为201227、210105、201124);ELISA法肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、白细胞介素1β(interleukin-1β,IL-1β)、IL-6检测试剂盒购自北京索莱宝生物科技有限公司(批号分别为SEKR-0009、SEKR-0002、SEKR-0005);TLR4抗体、NF-κB p65抗体、p-NF-κB p65抗体、IκBα抗体、p-IκBα抗体购自美国Affinity公司(批号分别为AF7017、AF5006、AF5019、AF6428、AF5281);Cleved Caspase-3抗体、B淋巴细胞瘤-2基因(Bcl-2)抗体、Bcl-2相关X蛋白(Bax)抗体购自英国Abcam公司(批号分别为ab54426、ab28517、ab31005);BCA蛋白浓度检测试剂盒、β-actin抗体、二抗、ECL发光液购自北京博奥森生物技术有限公司(批号分别为C05-07004、bs-0061R、bs-0295G、C05-07004)。
1.2.2实验仪器 BS224S型电子天平(德国Sartouris公司);synergy H1型酶标仪(德国Biotec公司);RM2015型切片机(德国Leica公司);Tetra型电泳仪、Blot SD型转膜仪(美国Bio-Rad公司);BX53型显微镜(日本日立公司);KZ-Ⅱ型匀浆仪(北京Servicebio公司)。
1.3 实验动物分组与模型制备
1.3.1实验动物分组 将128只SD大鼠按照随机数字表法分为假手术组、模型组、藏红花素组、藏红花素+脂多糖组[12],每组32只。
1.3.2模型制备方法
1.3.2.1药物溶液配制 精确称量400 mg藏红花素溶解于100 mL生理盐水中制备浓度为4 mg/mL的藏红花素溶液;精确称量10 mg脂多糖溶解于100 mL生理盐水中制备浓度为0.1 mg/mL的脂多糖溶液,每天给药前配制。
1.3.2.2模型制备前干预 模型制备前7 d开始,藏红花素组通过腹腔注射藏红花素溶液;藏红花素+脂多糖组通过腹腔注射藏红花素溶液、脂多糖溶液;假手术组和模型组通过腹腔注射生理盐水。参照“人和动物体表面积折算的等效剂量比率表”进行换算,各组注射剂量均为5 mL/(kg·d),1次/d,连续干预7 d。
1.3.2.3动物模型制备 末次给药12 h后,模型组、藏红花素组、藏红花素+脂多糖组采用线栓法复制FCIR大鼠模型。该方法制备FCIR动物模型病理生理特征与人临床接近,并且不开颅、操作简便、重复性好,是缺血性脑卒中动物实验研究的常用造模方法[13]。通过腹腔注射3%浓度的戊巴比妥钠溶液(40 mg/kg)实施麻醉,取仰卧位固定,沿颈正中线切口、钝性分离肌肉和结缔组织,游离右侧颈总动脉和颈内、颈外动脉,动脉夹夹闭颈总动脉,结扎颈外动脉,在颈外动脉剪1个小口并插入线栓,绕过分叉处进入颈内动脉至大脑中动脉处,插入深度约18 mm,2 h后拔出线栓恢复血流再灌注,然后逐层缝合;假手术组暴露颈总、颈内、颈外动脉后,即逐层缝合。根据LONGA等[14]神经功能评分评定造模是否成功。标准如下:无症状为0分;左侧前肢弯曲、不能完全伸展为1分;行走时向左侧转圈为2分;行走时向左侧跌倒为3分;不能行走或翻正反射消失为4分。Longa评分2~3分即可认定造模成功。
1.4 观察指标
1.4.1神经功能缺失评分和脑梗死率测定 再灌注24 h后,各组分别采用随机数字表法选择8只大鼠,根据改良神经功能缺损评分(modified neurological severity score,mNSS)评价大鼠神经功能缺失程度[15]。评分越高表示神经受损越严重。此外,通过腹腔注射3%浓度的戊巴比妥钠溶液(40 mg/kg)实施麻醉,颈椎脱臼处死,取脑组织并去除小脑、低位脑干,沿冠状面切成6片,置于2% TTC溶液中37 ℃避光染色30 min,每5 min翻转切片1次。通过Image-Pro Plus 6.0图像分析软件计算梗死区域面积。

1.4.2脑含水量测定 再灌注24 h后,各组分别随机另取8只大鼠,通过腹腔注射3%浓度的戊巴比妥钠溶液(40 mg/kg)实施麻醉,颈椎脱臼处死,取脑组织并去除小脑、低位脑干后,称质量为湿质量;置于110 ℃烘箱中烘干至恒质量,即为干质量。

1.4.3皮质神经元病理学改变和凋亡状况观察 各组分别随机另取8只大鼠,通过腹腔注射3%浓度的戊巴比妥钠溶液(40 mg/kg)实施麻醉,颈椎脱臼处死,取脑组织并去除小脑、低位脑干,置于4%多聚甲醛溶液中固定,经脱水、石蜡包埋后制作5 μm厚度的石蜡切片。① 取部分切片经脱蜡、透明处理后,按照试剂盒说明进行苏木精-伊红染色法(hematoxylin-eosin staining,HE)染色,中性树胶封片后通过显微镜观察皮质神经元病理学改变。② 取部分切片,按试剂盒说明进行TUNEL染色,50%甘油封片后通过显微镜观察皮质神经元凋亡状况(细胞核着黄褐色为凋亡细胞),每张切片取5个视野计算凋亡细胞数,各组取平均值后计算凋亡细胞百分比,即为凋亡指数(apoptosis index,AI)。
1.4.4脑组织TNF-α、IL-1β、IL-6水平检测 分别取各组剩余的8只大鼠,通过腹腔注射3%浓度的戊巴比妥钠溶液(40 mg/kg)实施麻醉,颈椎脱臼处死,取脑组织并去除小脑、低位脑干,剪碎后加入裂解液,冰上研磨匀浆,3 500 r/min离心10 min取上清液,按照ELISA试剂盒说明进行处理后,通过酶标仪检测TNF-α、IL-1β、IL-6水平。
1.4.5脑组织TLR4、NF-κB p65、p-NF-κB p65、IκBα、p-IκBα、Cleved Caspase-3、Bcl-2、Bax蛋白表达检测 取“1.4.4”项制备的脑组织匀浆液,4 ℃,12 000 r/min离心30 min取上清液,通过BCA试剂盒检测总蛋白浓度后,沸水浴10 min使蛋白变性,然后采用Western blot法检测蛋白相对表达量。SDS-PAGE电泳分离蛋白、转膜、5%脱脂奶粉封闭后,目标蛋白和内参(β-actin)一抗4 ℃孵育过夜,洗膜后加入二抗室温孵育1 h,洗膜后加入ECL显影,通过Image-Pro Plus 6.0图像分析软件分析条带灰度值。
1.5 统计学方法
采用SPSS 22.0统计软件进行数据分析。计量资料符合正态分布,数据采用(xˉ±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05为差异具有统计学意义。
2 结 果
2.1 4组大鼠mNSS评分、脑梗死率、脑含水量比较
与假手术组比较,模型组大鼠mNSS评分、脑梗死率、脑含水量均明显升高,差异均具有统计学意义(P<0.05);与模型组比较,藏红花素组和藏红花素+脂多糖组mNSS评分、脑梗死率、脑含水量均明显降低,差异均具有统计学意义(P<0.05);与藏红花素组比较,藏红花素+脂多糖组mNSS评分、脑梗死率、脑含水量均明显升高(P<0.05)。见图1、表1。

表1 4组mNSS评分、脑梗死率和脑含水量比较(xˉ±s)Table 1 Comparison of mNSS score,cerebral infarction rate and brain water content in four groups (xˉ±s)
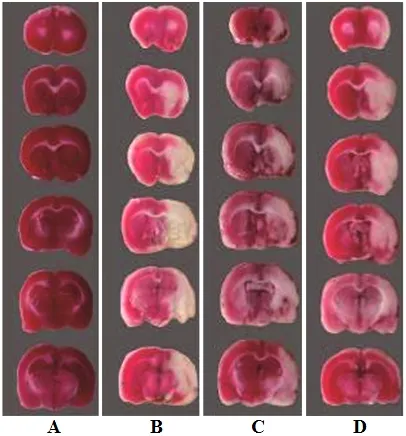
图1 4组FCIR大鼠脑梗死情况比较Figure 1 Comparison of cerebral infarction of FCIR rats in four groups
2.2 4组大鼠皮质神经元病理学改变比较
假手术组大鼠皮质神经元形态正常、结构完整;模型组大鼠皮质神经元可见排列紊乱、数量减少、空泡变性、胞浆固缩深染、核膜边界不清、炎性细胞浸润等病理学改变。与模型组比较,藏红花素组大鼠皮质神经元上述病理学改变明显减轻;与藏红花素组比较,藏红花素+脂多糖组大鼠皮质神经元病理学改变明显加重。见图2。
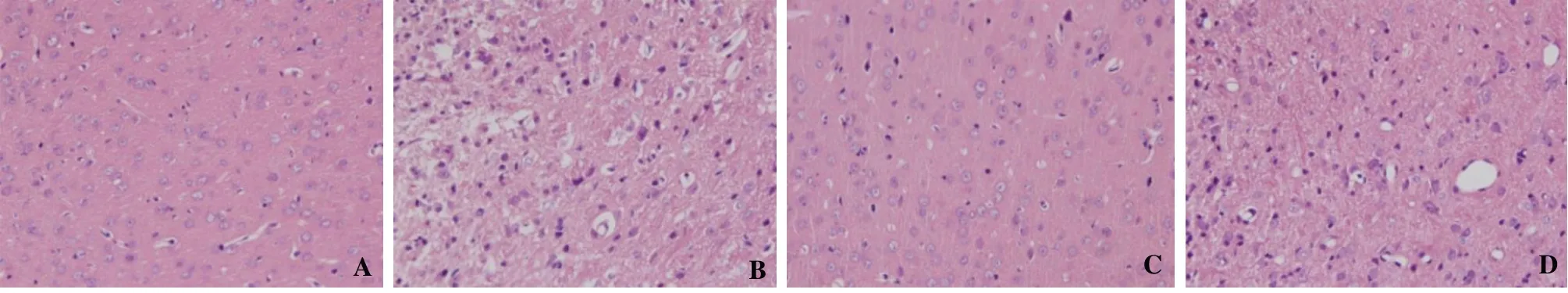
图2 4组皮质神经元病理学改变比较(HE,×200)Figure 2 Comparison of pathological changes of cortical neurons in four groups (HE, ×200)
2.3 4组大鼠皮质神经元凋亡比较
与假手术组比较,模型组皮质神经元凋亡指数明显升高(P<0.05);与模型组比较,藏红花素组和藏红花素+脂多糖组凋亡指数明显降低(P<0.05);与藏红花素组比较,藏红花素+脂多糖组凋亡指数明显升高(P<0.05)。见图3、表2。

表2 4组皮质神经元AI比较(xˉ±s)Table 2 Comparison of AI of cortical neurons in four groups (xˉ±s)

图3 4组皮质神经元凋亡比较(TUNEL,×200)Figure 3 Comparison of apoptosis of cortical neurons in four groups (TUNEL, ×200)
2.4 4组大鼠脑组织TNF-α、IL-1β、IL-6水平比较
与假手术组比较,模型组TNF-α、IL-1β、IL-6水平明显升高,差异均具有统计学意义(P<0.05);与模型组比较,藏红花素组和藏红花素+脂多糖组TNF-α、IL-1β、IL-6水平均明显降低,差异均具有统计学意义(P<0.05);与藏红花素组比较,藏红花素+脂多糖组TNF-α、IL-1β、IL-6水平均明显升高,差异均具有统计学意义(P<0.05)。见表3。

表3 4组脑组织TNF-α、IL-1β和IL-6水平比较(xˉ±s)Table 3 Comparison of levels of TNF-α,IL-1β and IL-6 in brain tissue in four groups (xˉ±s)
2.5 4组大鼠脑组织TLR4、NF-κB p65、p-NFκB p65、IκBα、p-IκBα蛋白表达比较
与假手术组比较,模型组TLR4、p-NF-κB p65、p-IκBα相对表达量及p-NF-κB p65/NF-κB p65、p-IκBα/IκBα表达比值均明显升高(P<0.05);与模型组比较,藏红花素组和藏红花素+脂多糖组TLR4、p-NF-κB p65、p-IκBα相对表达量及p-NF-κB p65/NF-κB p65、p-IκBα/IκBα表达比值均明显降低(P<0.05);与藏红花素组比较,藏红花素+脂多糖组TLR4、p-NF-κB p65、p-IκBα相对表达量及p-NFκB p65/NF-κB p65、p-IκBα/IκBα表达比值均明显升高(P<0.05)。见图4、表4。
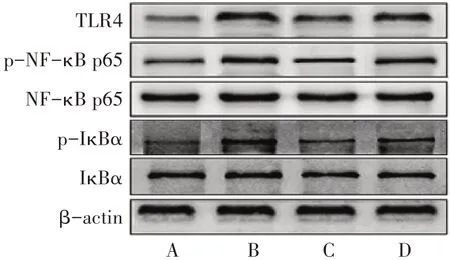
图4 4组大鼠脑组织TLR4、NF-κB p65、p-NF-κB p65、IκBα和p-IκBα蛋白表达比较Figure 4 Comparison of the expression of TLR4, NF-κB p65, p-NF-κB p65, IκBα and p-IκBα proteins in the brain tissue in four groups

表4 4组大鼠脑组织TLR4、NF-κB p65、p-NF-κB p65、IκBα、p-IκBα蛋白表达及p-NF-κB p65/NF-κB p65、p-IκBα/IκBα表达比值比较(xˉ±s)Table 4 Comparison of the expressions of TLR4,NF-κB p65,p-NF-κB p65,IκBα,p-IκBα proteins and the ratio of p-NF-κB p65/NF-κB p65,p-IκBα/IκBα in the brain tissue in four groups (xˉ±s)
2.6 4组大鼠脑组织Cleved Caspase-3、Bcl-2、Bax蛋白表达比较
与假手术组比较,模型组Cleved Caspase-3、Bax相对表达量和Bax/Bcl-2表达比值明显升高,Bcl-2相对表达量明显降低(P<0.05);与模型组比较,藏红花素组和藏红花素+脂多糖组Cleved Caspase-3、Bax相对表达量和Bax/Bcl-2表达比值明显降低,Bcl-2相对表达量明显升高(P<0.05);与藏红花素组比较,藏红花素+脂多糖组Cleved Caspase-3、Bax相对表达量和Bax/Bcl-2表达比值明显升高,Bcl-2相对表达量明显降低(P<0.05)。见图5、表5。

图5 4组脑组织Cleved Caspase-3、Bcl-2和Bax蛋白表达比较Figure 5 Comparison of the expression of Cleved Caspase-3, Bcl-2 and Bax proteins in the brain tissue in four groups

表5 4组脑组织Cleved Caspase-3、Bcl-2、Bax蛋白表达及Bax/Bcl-2表达比值比较(xˉ±s)Table 5 Comparison of the expression of Cleved Caspase-3,Bcl-2,Bax proteins and the ratio of Bax/Bcl-2 in the brain tissue in four groups (xˉ±s)
3 讨 论
3.1 藏红花素可保护FCIR大鼠神经功能,减轻皮质神经元病理学改变
本研究结果显示,FCIR模型大鼠mNSS评分、脑梗死率、脑含水量较假手术组明显升高,皮质神经元呈现排列紊乱、数量减少、空泡变性、胞浆固缩深染、核膜边界不清、炎细胞浸润等病理学改变,这与巩子汉等[16]研究结果相似。这提示FCIR过程导致神经功能受损和皮质神经元病理改变。与模型组比较,藏红花素预处理能够明显降低FCIR大鼠mNSS评分、脑梗死率和脑含水量,明显改善皮质神经元病理学改变,这提示藏红花素对FCIR大鼠神经功能和皮质神经元具有保护作用,与温彬等[11]研究显示藏红花素能够减轻全脑缺血再灌注大鼠神经功能和脑组织病理改变的结果相似。这可能与以下因素有关:① FCIR可激活小胶质细胞分泌TNFα、IL-1β、IL-6等炎症因子,从而诱发炎症反应,并且TNF-α趋化其他炎症因子释放而加重炎症反应损伤,IL-1β则能够刺激内皮细胞上调表达黏附分子而促进炎细胞浸润[17-18]。藏红花素具有较好的抗炎活性[8-9],能够明显降低FCIR大鼠脑组织TNF-α、IL-1β、IL-6水平,抑制FCIR大鼠脑炎症反应,从而改善FCIR大鼠神经功能。② FCIR可诱发神经元凋亡,皮质神经元凋亡是FCIR损伤进行性加重的重要因素。Bcl-2和Bax定位于线粒体膜,Cleaved Caspase-3通过破坏结构蛋白、膜蛋白、核酸等分子结构而诱导细胞凋亡[19]。藏红花素预处理能够抑制FCIR大鼠脑组织Bcl-2表达下调和Bax、Cleaved Caspase-3表达上调,使Bax/Bcl-2比值降低。Bax能够激发线粒体膜通透性转变孔道开放促使细胞色素C(Cyt C)进入细胞质,诱导Caspase-3活化;Bcl-2与Bax形成无活性的异源二聚体,从而对FCIR大鼠皮质神经元凋亡起到抑制作用。这与江冉冉等[20-22]研究结果相似。
3.2 藏红花素对FCIR大鼠神经保护作用可能与调节TLR4/NF-κB通路有关
本研究结果显示,与假手术组比较,模型组脑组织TLR4表达量和NF-κB p65、IκBα磷酸化(p-NF-κB p65/NF-κB p65、p-IκBα/IκBα)水平明显升高,这提示FCIR诱导TLR4表达上调和NF-κB p65、IκBα磷酸化。与模型组比较,藏红花素组脑组织TLR4表达量和NF-κB p65、IκBα磷酸化水平明显降低,这提示藏红花素对FCIR大鼠神经保护作用可能与调节TLR4/NF-κB通路有关。这可能与以下因素有关:TLR4是一种模式识别受体,主要在脑神经系统小胶质细胞表达。NF-κB在生理状态下以无活性的“p65/p50-IκBα”聚合态形式存在。研究表明,TLR4能够诱导IκBα和NF-κB p65亚基磷酸化,促使“p65/p50-IκBα”聚合态解离,游离态p-NFκB p65核转位后能够与DNA结合而诱导TNF-α、IL-1β、IL-6等炎症因子转录表达[23-24],p-NF-κB p65能够调控Bcl-2、Bax表达而促进细胞凋亡[25]。藏红花素抑制FCIR大鼠脑炎症反应和神经元凋亡的作用机制可能与抑制TLR4/NF-κB通路活化有关。这与CHEN等[6]研究结论相似。为了验证上述推论,本实验设置了藏红花素+脂多糖(TLR4激活剂)组,研究结果显示,脂多糖能够明显逆转藏红花素对FCIR大鼠脑组织TLR4表达和NF-κB p65、IκBα磷酸化的调控作用,逆转藏红花素对FCIR大鼠神经功能、脑炎症反应、皮质神经元病理变化和凋亡的影响,进一步证实了藏红花素对FCIR大鼠的保护作用与其抑制TLR4/NF-κB通路活化有关。
4 小 结
藏红花素能够抑制FCIR大鼠炎症反应和皮质神经元凋亡,减轻皮质神经元损伤,作用机制可能与抑制TLR4/NF-κB通路活化有关。本研究结果为藏红花素防治FCIR损伤提供了理论支持。

