硫改性铁基材料活化过硫酸盐降解盐酸四环素
张楠,刘祺,陈蕾
(南京林业大学 土木工程学院,江苏 南京 210037)
目前抗生素的滥用引起了严重的环境污染问题,常规的水处理技术去除效果一般[1-4]。活化过硫酸盐是近年发展起来的一种新兴的高级氧化技术,是一种绿色高效的处理技术[5-7]。过硫酸盐的活化方法包括热活化、活性炭活化、超声活化、铁基材料活化等[8-10],其中铁基材料的活化效率高、易获得、环境友好,并且对铁基材料进行改性处理可获得更好的催化效果[11-13]。
本研究采用共沉-高温烧制法制备硫改性的铁基催化剂S-Fe,并研究其活化过硫酸盐对水中盐酸四环素(TCH)的去除效果,研究结果可以为含四环素类抗生素废水的高效处理提供一定的理论参考。
1 实验部分
1.1 试剂与仪器
盐酸四环素(TCH,96%纯度),由上海阿拉丁生化科技股份有限公司提供;叔丁醇(TBA)、过硫酸钠(Na2S2O8)、硫代硫酸钠(Na2S2O3)、硫酸(H2SO4)、七水合硫酸亚铁(FeSO4)、氯化钠(NaCl)、硫酸钠(Na2SO4)、碳酸钠(Na2CO3)、甲醇、氢氧化钠(NaOH)、盐酸(HCl)均为分析纯。
752N型紫外-可见光分光光度计;SXZ-8-10NP型马弗炉;SHZ-82型恒温振荡摇床;蔡司Sigma 300型扫描电子显微镜;AXIS UltraDLD型X-射线光电子能谱仪;Ultima IV型X-射线分析仪;LTQ Orbitrap XL型液质联用仪。
1.2 硫改性催化剂的制备
按照硫和铁摩尔比为1∶2称取相应的硫代硫酸钠(Na2S2O3)以及硫酸亚铁(FeSO4),并将其用 100 mL 去离子水进行溶解,为了防止亚铁离子被氧化,在溶解的过程中向其中滴加几滴10%的稀硫酸。溶液利用磁力搅拌器搅拌30 min,并在此过程中用滴管缓慢加入40 mL浓度为1 mol/L的NaOH溶液,将pH控制在7左右。搅拌结束后,用真空抽滤装置过滤溶液,并用超纯水反复冲洗过滤,直至过滤出的液体清澈。将过滤后得到的固体放入烘箱中,设定温度为70 ℃直至材料干燥。将烘干后的固体研磨成较小颗粒及粉末,最后将其装入有盖坩埚中,设定马弗炉温度为400 ℃,将其煅烧1 h。标记所得催化剂为S-Fe。
1.3 S-Fe催化剂结构表征
SEM测试采用扫描电子显微镜;XRD测试采用X-射线分析衍射仪,扫描衍射角为2θ,衍射的射线源采用Cu-Ka;XPS测试采用X-射线光电子能谱分析仪,采用hv=1 486.6 eV的AL-Ka 射线作为激发源,工作电流16 mA,工作电压12.5 kV,使用氩离子枪刻蚀样品,刻蚀电压3 000 eV,刻蚀光斑尺寸为1.5 mm。
1.4 S-Fe活化过硫酸盐催化降解TCH
S-Fe活化过硫酸盐体系(S-Fe/PS)降解TCH的反应均在250 mL的锥形瓶中进行,取提前配制好的一定浓度的TCH溶液于250 mL的锥形瓶中,向其中加入一定浓度的Na2S2O8溶液以及催化剂 S-Fe。设置恒温振荡箱的反应温度为25 ℃,将锥形瓶放于提前开启并预热好的恒温振荡箱中,同时设定其振荡速度为160 r/min,开启振荡后开始记录反应时间,之后每隔一定的时间取2 mL水样,经过 0.45 μm 滤膜过滤后取其滤液,加入2 mL乙醇猝灭残余的自由基,通过紫外-可见分光光度计在358 nm 处测量其吸光度测定反应体系中TCH的浓度,并计算TCH的去除率。
采用液相色谱-质谱联用方法分析TCH的降解产物。实验条件如下:色谱柱为Agilent HC C18 反相柱(4.6 mm×150 mm,5 μm);流动相选择乙腈和0.1%甲酸的混合相,二者体积比为10%∶90%,流速为0.5 mL/min;选用紫外灯检测器,其中UV的波长设为315 nm,在30 ℃下进行检测。设置 4.0 kV 的喷雾离子阱电压,质荷比(m/z)的扫描幅度为 200~800,扫描的速度为10 kDa/s。
设置反应体系中S-Fe投加量为1 g/L,过硫酸盐浓度为2 g/L,盐酸四环素浓度为20 mg/L,pH为7,向反应体系中分别加入10 mL的甲醇以及叔丁醇,并设置空白对照组,反应一定时间间隔取样测定TCH浓度,研究S-Fe/PS体系中起主导作用的自由基。
2 结果与讨论
2.1 S-Fe催化剂的表征和分析
2.1.1 扫描电子显微镜(SEM)表征 在10 k,50 k,80 k和100 k的放大倍数下对S-Fe进行了电子显微镜的扫描,所得的扫描SEM 图见图1。 S-Fe经过高温煅烧后,尺寸100 nm左右,电镜下的S-Fe主要以柱状或块状聚集在一起,同时孔隙比较丰富,比表面积较大,说明制备的S-Fe催化剂具有良好的吸附性能和较大的催化表面。

图1 S-Fe 的扫描电镜(SEM)图Fig.1 Scanning electron microscope(SEM)of S-Fe
2.1.2 X-射线衍射(XRD)表征 对S-Fe进行了X-射线衍射表征,结果见图2。
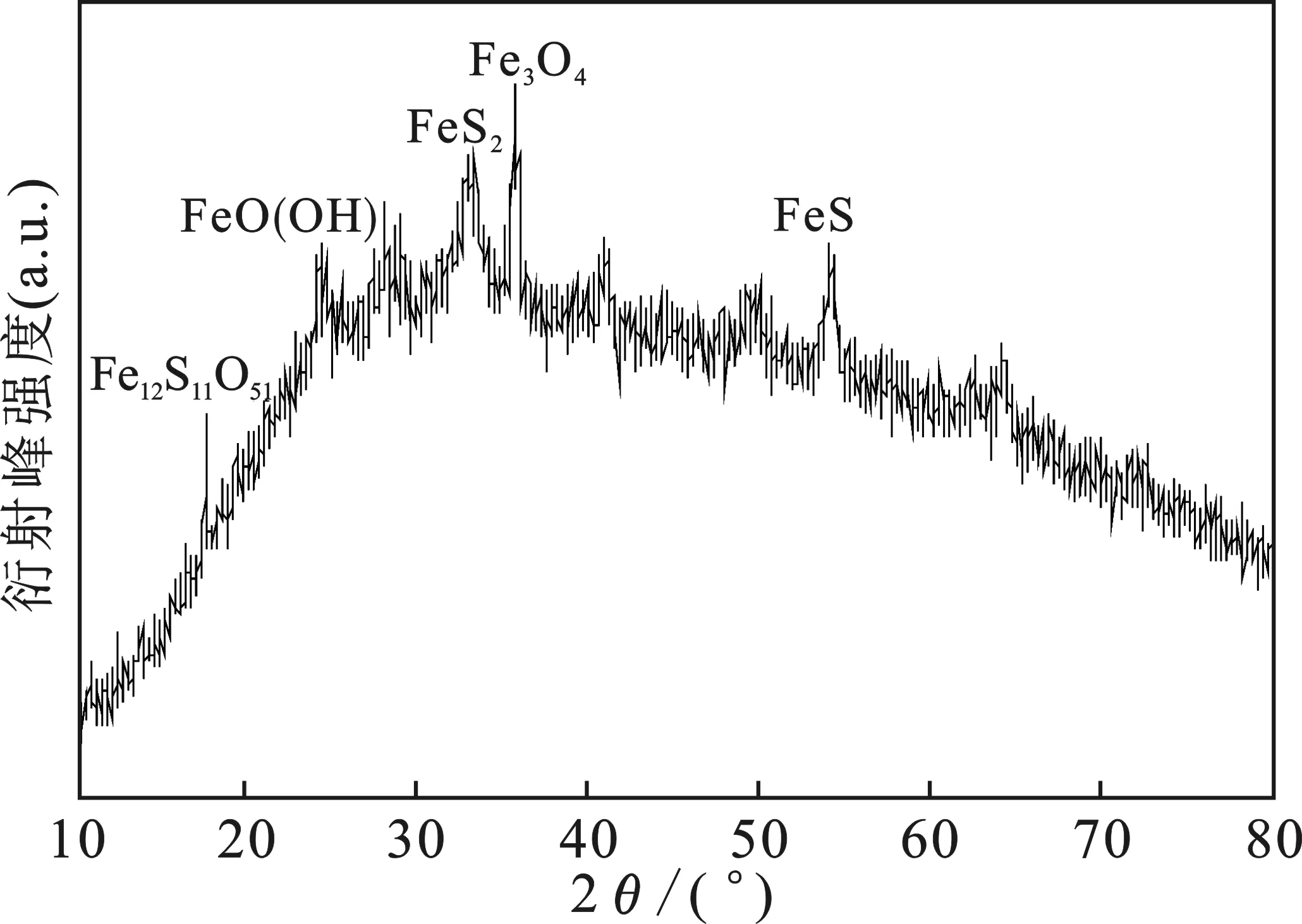
图2 S-Fe 的XRD图Fig.2 XRD pattern of S-Fe
由图2可知,在2θ=17.72,24.3,33.02,35.68,53.98°时有比较明显的衍射峰出现,将上述峰值与α-FeO/S(JCPDS-33-0664)标准卡片上的铁基物质进行对应,可以发现,17.72°对应的是Fe12S11O51;24.3°对应的是FeO(OH);33.02°对应的是FeS2;35.68°对应的是Fe3O4;53.98°对应的是 FeS。上述结果表明,硫元素在材料的制备过程中,很好地负载在了材料的表面。
2.1.3 X-射线光电子能谱(XPS)表征 实验制备的改性材料S-Fe经过XPS表征分析后的全谱图以及各分峰见图3。
根据全谱扫描图3a可知,制备的S-Fe材料中含有氧(O 1s)、碳(C 1s)、铁(Fe 2p)以及硫(S 2p)的特征峰,其元素原子的组成成分为 62.04,26.81,2.15,2.6。与在制备催化剂的过程中所添加的原材料的量相比,S-Fe中各种元素的组成成分存在一定程度的损失,这可能是由于制备过程中研磨、加热或润洗过程中产生了一定的损失。利用 Avantage对铁(Fe 2p)及氧(O 1s)的峰值进行处理,所得结果见图3b、图3c。根据Fe 2p的窄谱图可以发现Fe 2p的典型电子层双峰,分别与Fe的2p1/2以及2p3/2轨道相对应,其结合能为711.9 eV以及724.6 eV。此外,Fe 2p的双峰中间存在的峰表明,所制备的S-Fe中还可能有零价铁的存在。由图3b还可知,在709.9 eV处有较弱的峰存在,这表明其中可能有FeS2,这也与XRD图中存在的FeS2衍射峰的结果相同。图3c是O 1s的分峰结果图,由图可知,O 1s 在结合能为 529.3 eV 的峰对应的是O2-,而 531.9 eV 的峰则对应于OH-。除此之外,由图3d中结合能位于 168.8 eV的峰,可知所制备的该催化剂中含有硫元素,查阅XPS的电子结合能对照表可知,S 2p在168.8 eV处的特征峰有可能是硫酸盐类以及金属硫化物[14],这一推测结论在XRD的表征结果中也可以得到验证。

图3 S-Fe 催化剂的全谱扫描图(a)、Fe 2p(b)、O 1s(c)和 S 2p(d)Fig.3 XPS spectrum of survey(a),Fe 2p(b),O 1s(c) and S 2p(d) of S-Fe catalyst
2.1.4 改性材料的磁性 将制备得到的改性材料取一部分置于桌面上,用吸铁石在上方对其进行吸引,发现大部分的S-Fe材料吸附于吸铁石表面,说明改性材料S-Fe具有一定的磁性,有利于回收及循环使用。
2.2 S-Fe/PS对TCH的去除效果
当反应体系中S-Fe投加量为1 g/L,过硫酸盐浓度为2 g/L,pH值为7,盐酸四环素浓度为 20 mg/L,同时设置对照实验,对照实验中投加的零价铁的摩尔量与S-Fe中的铁摩尔量相等。图4为不同的反应体系降解TCH的结果。
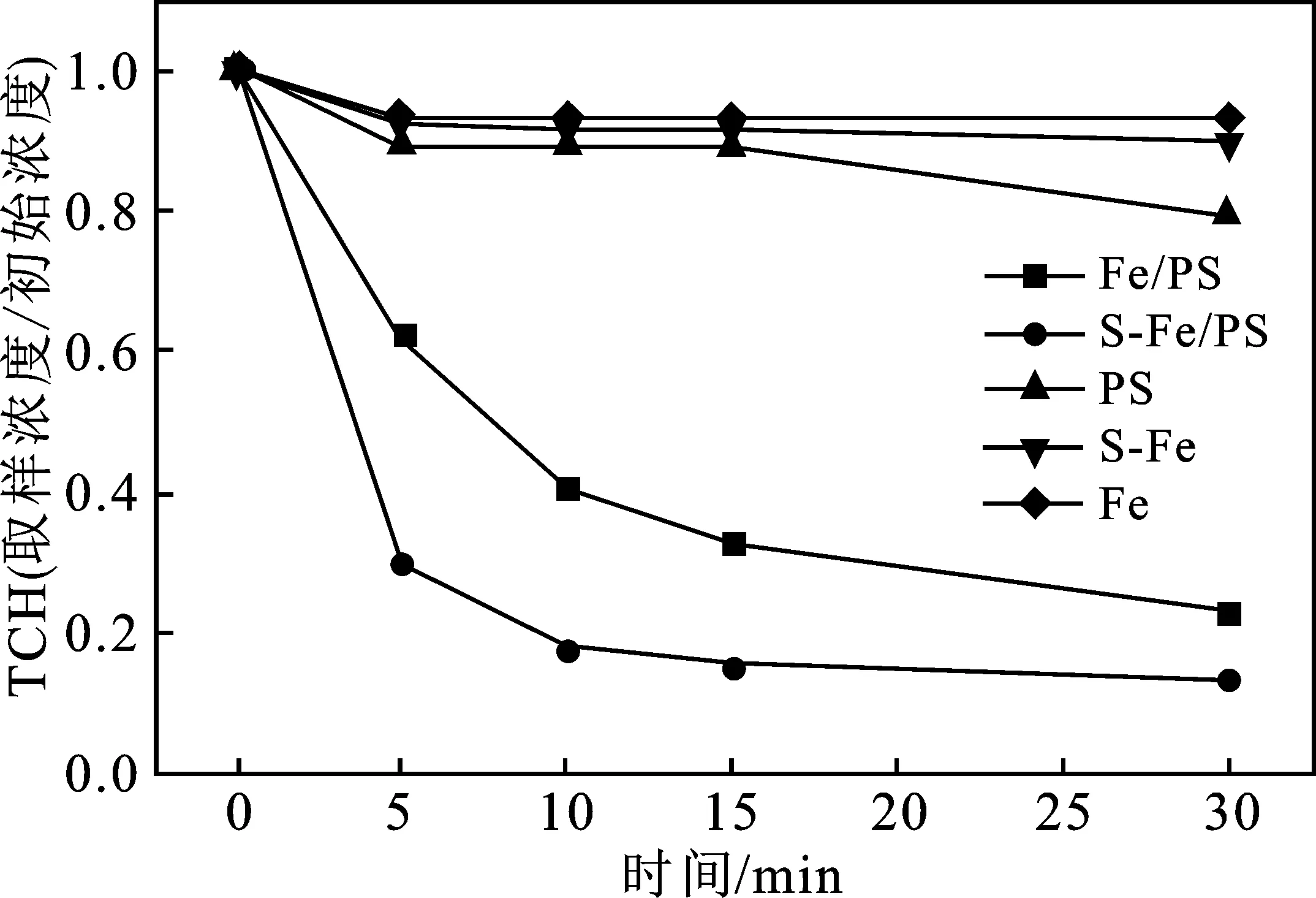
图4 不同体系对TCH的降解效果Fig.4 Degradation effects of different systems on TCH
由图4可知,单独加入零价铁、过硫酸盐、S-Fe催化剂时,体系中的TCH降解率低于20%,在Fe/PS体系中,反应30 min后76.99%的TCH可以被去除,而在S-Fe/PS的降解体系下,15 min后TCH的去除率则可以达到86.40%。说明改性S-Fe催化剂可以显著提高过硫酸盐体系对TCH的去除效率。对S-Fe/PS体系降解TCH的反应动力学进行拟合,即以ln(初始浓度/取样浓度)为纵坐标,反应时间为横坐标,进行线性拟合,发现反应均符合准一级反应动力学,y=0.157 6x(R2=0.952 2),并由此计算出反应速率常数(Kobs)为0.157 6 min-1,半衰期(t1/2)为 6.345 2 min。
2.3 S-Fe/PS降解TCH的影响因素
2.3.1 初始TCH浓度对反应体系的影响 当S-Fe的投加量为1 g/L,过硫酸盐浓度为2 g/L,初始pH值为7时,TCH初始浓度对S-Fe/PS体系降解TCH的影响见图5。
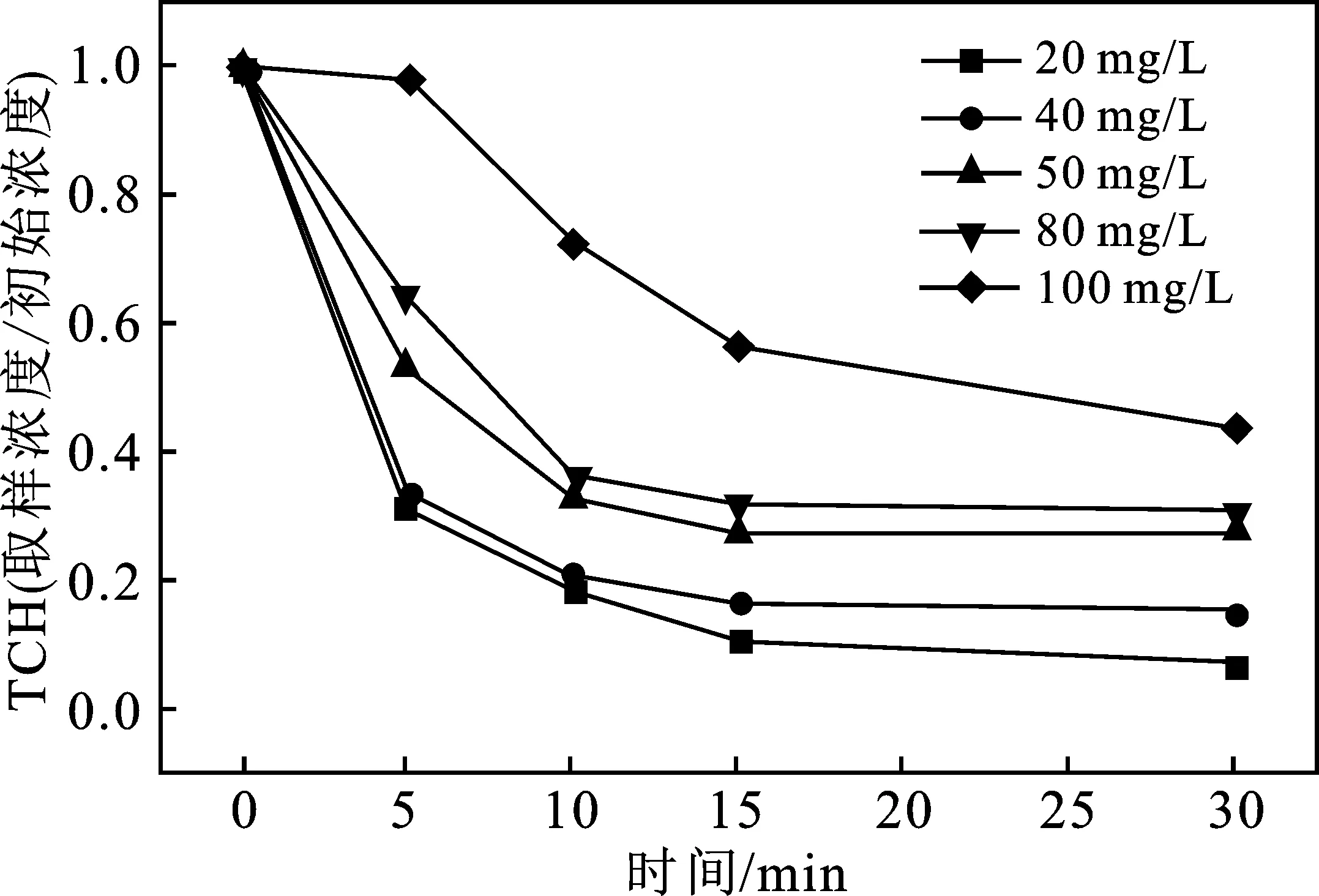
图5 初始TCH浓度对S-Fe/PS体系降解TCH的影响Fig.5 Effect of initial TCH concentration on degradationof TCH in S-Fe/PS system

2.3.2 S-Fe催化剂投加量对反应体系的影响 当TCH初始浓度为20 mg/L,过硫酸盐浓度为2 g/L,初始pH为7时,S-Fe催化剂的投加量对TCH降解的影响见图6。
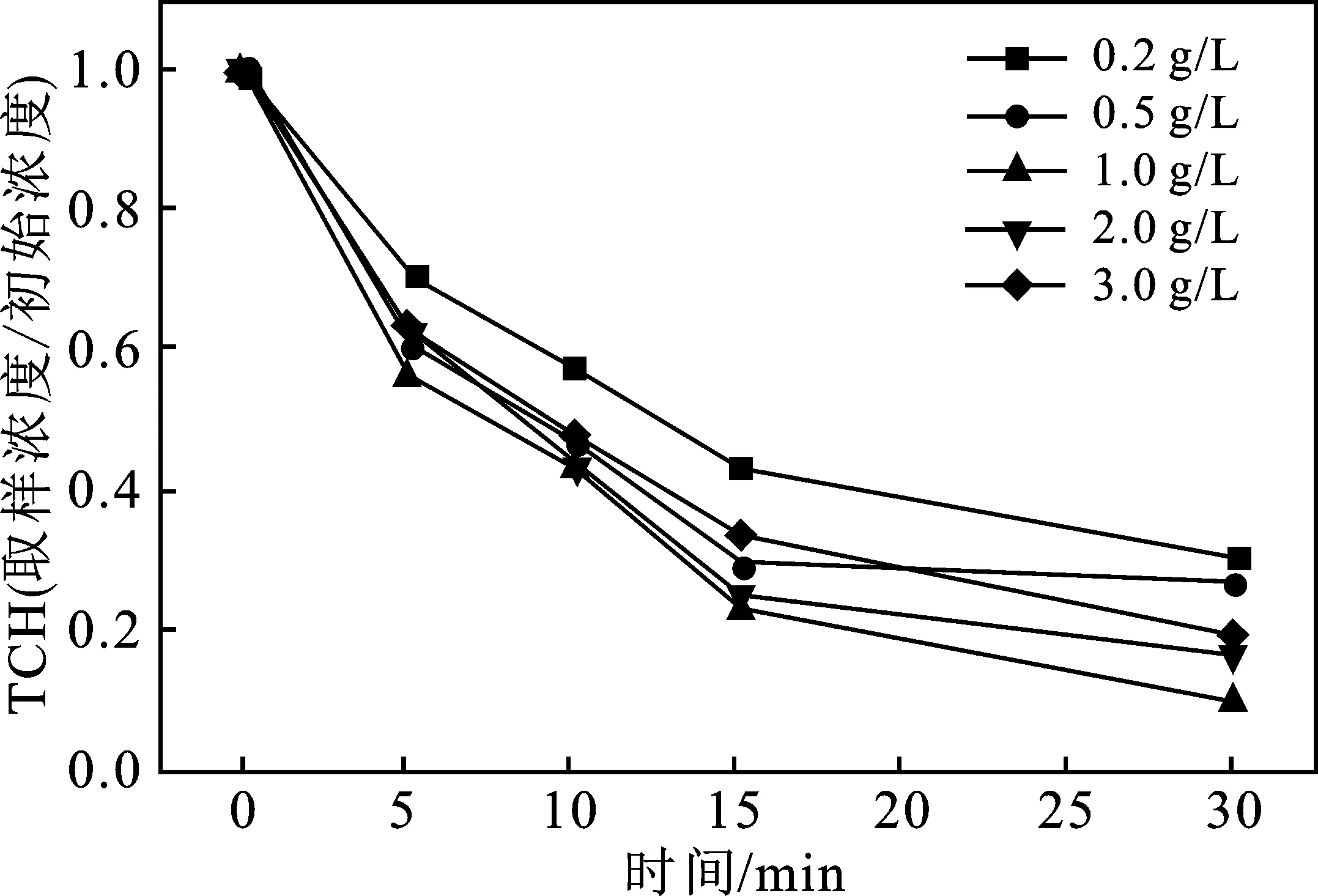
图6 催化剂投加量对S-Fe/PS体系降解TCH的影响Fig.6 Effect of catalyst dosage on degradation ofTCH in S-Fe/PS system
由图6可知,随着反应时间的延长,S-Fe/PS体系中TCH的去除效率先逐渐增高,反应进行了 30 min 左右,降解曲线逐渐趋于平缓,TCH的去除效率无明显的变化。当S-Fe投加量分别为0.2,0.5,1.0 g/L时,反应30 min后,TCH的去除率分别为 68.93%,72.94%,89.76%,随着S-Fe投加量的增加,TCH的去除率逐渐增加。但当S-Fe投加量增大到2.0 g/L和3.0 g/L时,TCH的去除率则为 82.98% 和79.91%,稍有下降。
这与张荣荣等通过湿法纺丝技术制备FeS/碳纤维作为催化剂活化过硫酸盐去除水中四环素中的研究结果一致,在FeS/碳纤维投加量增加至 500 mg/L 时,四环素的降解率增加到了72%,但当其增加到1 000 mg/L时,四环素的降解率则降低到了70%[17]。这可能是由于当活化剂的投加量增加时,更多的活化剂则能够提供更多的催化活性位点,从而能够产生更多的氧化自由基,促进降解反应的发生,使得TCH的去除率增加,而继续增加活化剂投加量时,可能由于体系中过硫酸盐的浓度到达一定值时,PS已经被全部活化,再继续投加过硫酸盐产生的自由基会发生式(1)~式(3)的副反应,从而淬灭已有的自由基,从而使得反应达到最佳值后,降解率不再增加,甚至会有所降低[18]。
OH·+OH·→ H2O2
(1)
(2)
(3)
2.3.3 PS投加量对反应体系的影响 当S-Fe投加量以及TCH浓度分别为1 g/L以及20 mg/L、初始pH为7时,过硫酸盐的投加量对TCH降解的影响见图7。
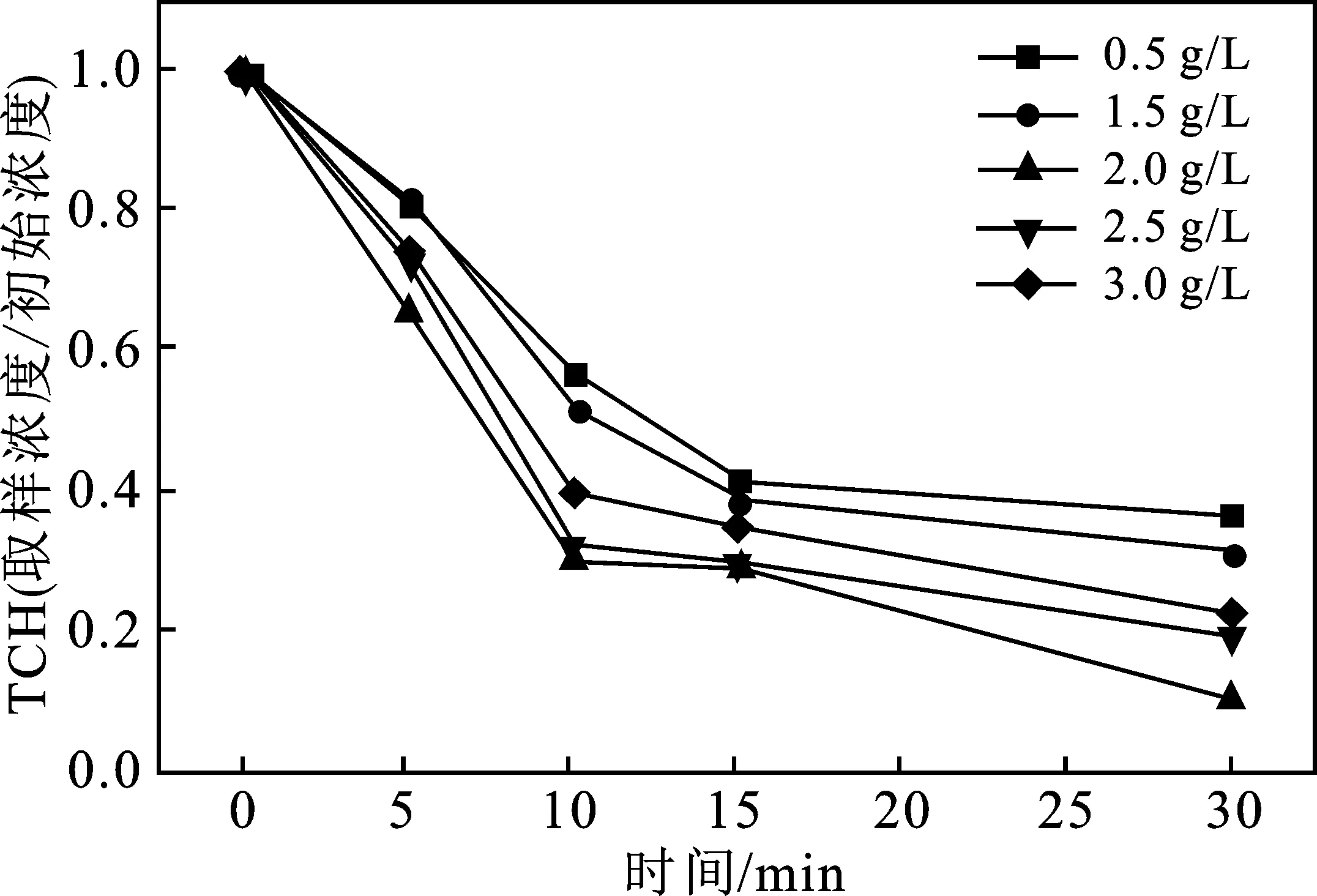
图7 PS投加量对S-Fe/PS体系降解TCH的影响Fig.7 Effect of PS dosage on degradation ofTCH in S-Fe/PS system
由图7可知,在过硫酸盐投加量从 0.5 g/L增加至2.0 g/L时,反应经过30 min后,TCH的降解率由63.4%提高至89.4%,可见,随着过硫酸盐投加量的增加,TCH的去除率也逐渐增加。然而,继续提高过硫酸盐投加量时,去除率不再继续增加,反而有所下降。反应30 min后,投加2.5 g/L PS的反应体系对TCH的去除率为80.9%,而投加3 g/L的体系降解率则为77.7%。结果表明,当过硫酸盐的投加量增加至某一个临界点后,其对污染物的降解率就不再增加了。
这种现象在已有的活化过硫酸盐降解有机污染物的研究中经常被报道,可能的原因一方面是活化剂的催化活性位点有限,无法继续对多余的过硫酸盐进行活化;另一方面可能是由于投加过硫酸盐过量后,过量的过硫酸根离子与PS被活化后生成的硫酸根自由基发生了式(4)所示的淬灭反应,与有机污染物竞争自由基,从而影响了TCH的降解[19-21]。
(4)
2.3.4 初始pH对反应体系的影响 当S-Fe投加量为1 g/L,初始TCH浓度为20 mg/L,过硫酸盐浓度为2 g/L,反应温度为25 ℃,初始pH值对S-Fe/PS体系降解TCH的影响见图8。
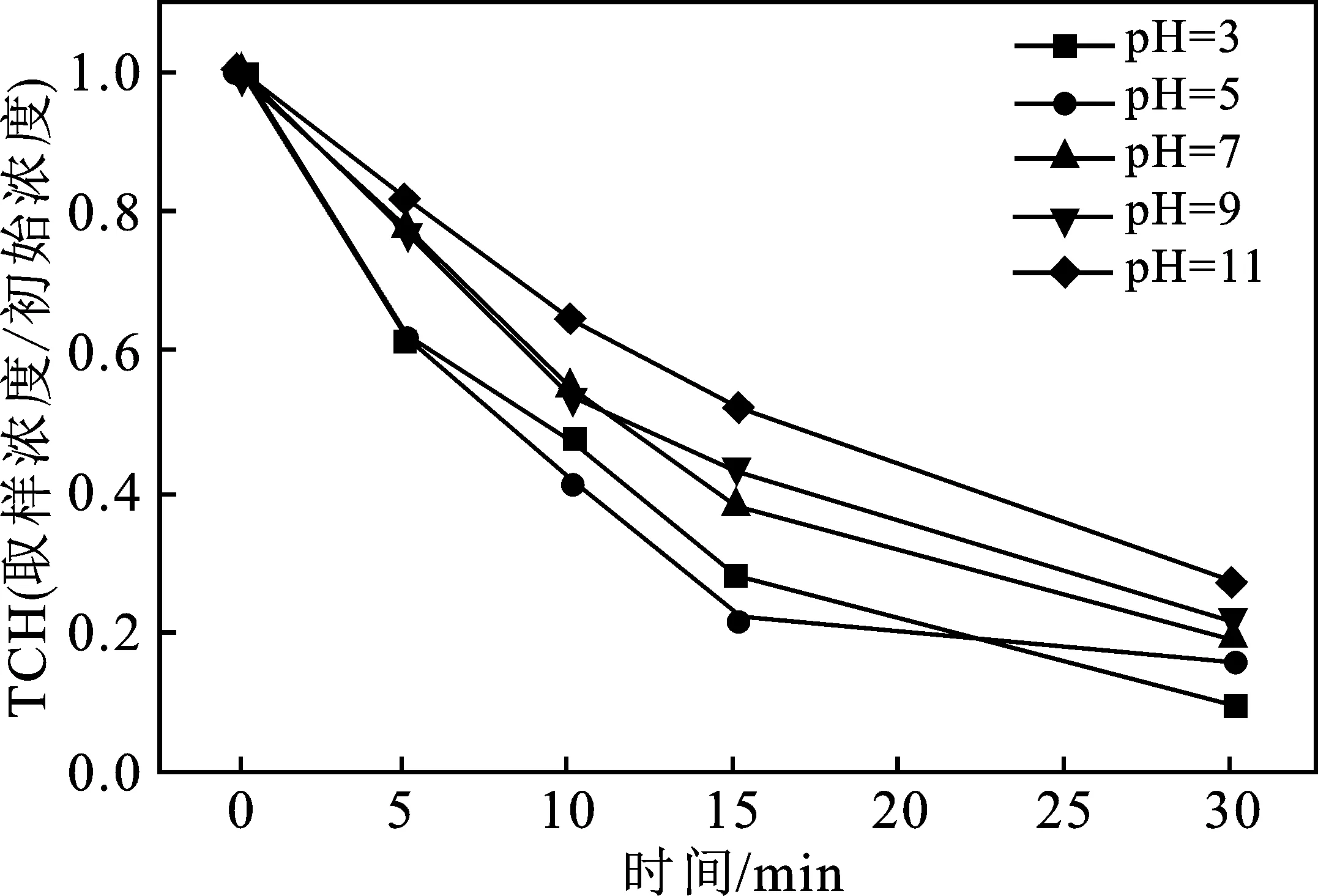
图8 初始pH对S-Fe/PS体系降解TCH的影响Fig.8 Effect of initial pH on degradation ofTCH in S-Fe/PS system
由图8可知,当反应体系的初始pH分别设置为3,5,7,9和11时,30 min 后,TCH的降解率可分别达到90.1%,87.28%,80.6%,78.1%,72.6%。可以得知,在酸性条件下TCH的降解效率更高。
导致上述结果产生的原因可能有:
①当反应体系的溶液为酸性的时候,会发生以下反应:
Fe3O4+Fe2O3+14H+→
7H2O+2Fe2++3Fe3+(5)
其中 Fe2+能够活化过硫酸盐,并且 Fe2+会与Fe3+进行转换,在此过程中产生的电子交换作用会提高活化剂的活性位点。
(6)
③此外,碱性条件中大量 的OH-容易与Fe2+以及Fe3+发生如下反应[19]:
Fe3++OH-→ Fe(OH)3
(7)
Fe2++OH-→ Fe(OH)2
(8)
因此,初始的pH值会对S-Fe/PS体系降解TCH产生一定的影响,但是pH从3增加到11,TCH的降解率从90%降低到72%,说明本研究制备的改性S-Fe材料适应的pH范围较宽。
2.4 S-Fe/PS体系降解TCH的机理研究

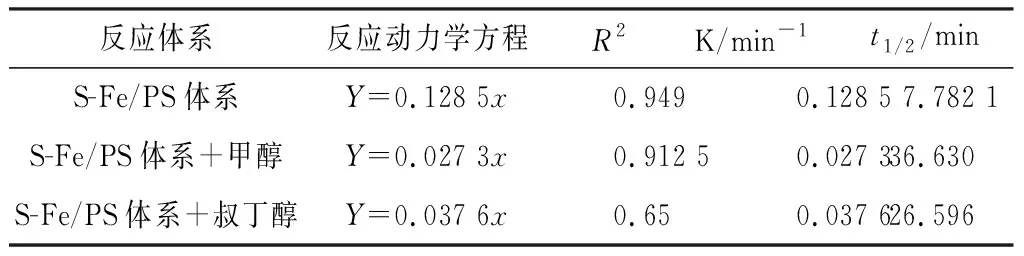
表1 不同反应体系中TCH的降解反应动力学Table 1 Degradation kinetics of TCH in different reaction systems

2.5 S-Fe催化剂循环及稳定性的研究
通常在含铁催化剂催化的反应体系中,催化剂的回收及大量铁泥的生成一直是限制实际工程应用的问题。本研究针对所制备的硫改性催化剂S-Fe,通过实验对其循环及稳定性进行了研究。催化剂投加量为1.0 g/L、过硫酸盐投加量为2.0 g/L,TCH浓度为20 mg/L,pH为7的反应条件下,进行循环实验研究,每次使用后收集催化剂,并用超纯水以及无水乙醇反复清洗,并放入真空干燥箱中烘干2 h。
实验结果表明,与最初的反应相比,S-Fe循环了第一次、第二次过后,TCH降解率的变化不大,分别可达到93.52%和91.39%。但是经过第三次循环之后,S-Fe催化剂的催化效率明显有所下降,对TCH的降解率降为72.23%。可能是因为随着循环反应次数的不断增加,在过滤、润洗、烘干等回收过程中,催化剂存在一定的损失,此外也会存在一些反应污染物吸附于催化材料的表面,使得反应活性位点的数量降低。但是总体看来,改性后的S-Fe材料易于回收与循环使用。
3 结论
(1)将硫代硫酸钠以及硫酸亚铁铵按照1∶2的摩尔比例共沉,并经过高温煅烧制备出硫改性的铁基催化材料S-Fe。S-Fe催化剂孔隙丰富,比表面积较大,具有良好的吸附性能和较大的催化表面。其主要组成成分为 Fe12S11O51、FeO(OH)、FeS2、Fe3O4以及 FeS 等物质,并且具有很好的磁性。
(2)当反应温度为25 ℃、S-Fe投加量为1 g/L、初始TCH浓度为20 mg/L、过硫酸盐浓度为2 g/L、初始pH值为3时,反应30 min 后,TCH的降解率可达到90.1%,并且制备的S-Fe催化剂在宽泛的pH条件下均有良好的催化性能。

(4)与零价铁相比,改性S-Fe催化剂能显著提高过硫酸盐降解四环素的效率,并且更易于回收,稳定性和重复使用性能良好,具有很好的应用前景。未来将开展S-Fe/PS体系对含抗生素实际废水的处理研究。

