醋酸铜梯度法制备阿霉素脂质体
马 佳,赵 艺,刘诗文,苏海莹,陈玉姣,徐 晖,王绍宁*
(1. 沈阳药科大学 制药工程学院,辽宁 沈阳 110016;2. 沈阳药科大学 药学院,辽宁 沈阳 110016)
蒽环类抗生素阿霉素(Doxorubicin, DOX)在许多肿瘤(如造血系统恶性肿瘤,乳腺、卵巢、甲状腺和骨骼的晚期实体瘤)的治疗中起着关键作用,但严重的毒性限制了其在临床中的应用。脂质体生物相容性好,可改变药物的体内分布,降低毒副作用,改善治疗指数,成为迄今为止最成功的纳米粒子平台之一[1]。主动载药法的应用使 DOX 成功载入脂质体,成为全球首个上市的脂质体(1995 Doxil®),重新焕发活力。目前已上市脂质体所应用的主动载药法主要为 pH 梯度法和铵梯度法,这两种方法均利用了 DOX 的弱氨基团(见图 1),外水相的 DOX 中性分子可穿过双分子膜进入脂质体内部,在内部弱氨基发生质子化进而与阴离子形成沉淀(如硫酸根离子、磷酸根离子等),从而滞留在脂质体内部,实现药物装载[1-2]。DOX 中的羟基蒽醌基团可与金属离子形成配合物,利用此特性人们建立了金属离子梯度[3-4]制备 DOX 脂质体。
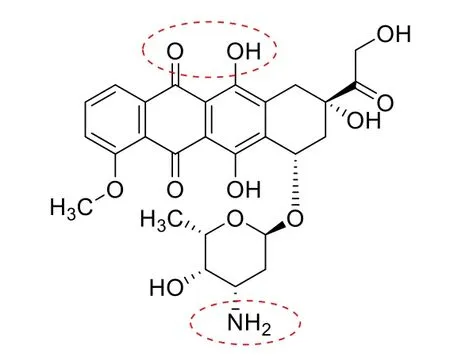
Fig. 1 The structure of doxorubicin图1 阿霉素的结构
铜离子是人体必需的微量元素,人体许多的生化反应都离不开铜离子的参与。很多研究发现铜离子载体及铜离子复合物可以通过抑制蛋白酶体、诱导产生 ROS、与 DNA 相互作用等方式抑制肿瘤[5-6]。Cu-DOX 复合物可提高 DOX 的抗肿瘤活性[7],降低心脏毒性[8],使用 Cu2+梯度装载 DOX 脂质体引起人们的关注[9]。本课题组探究含铜的不同无机盐对 DOX 脂质体包封率的影响,并对其释药行为进行考察。
1 仪器与材料
UV-480 紫外扫描仪(日本 Shimadzu);SONICS 超声波破碎仪 VCX150(美国 SONICS公司);UV-1801 型紫外—可见分光光度计(瑞利分析仪器有限公司);BS124s 电子分析天平(德国赛多利斯公司);RE-52A 旋转蒸发器(上海亚荣生化仪器厂);Anke TDL80-2B 离心机(上海安亭科学仪器厂);水浴恒温培养摇床(上海智城分析仪器制造有限公司);IS09001 往返式水浴恒温摇床(上海智诚分析仪器制造有限公司);马尔文粒度测定仪(英国 Malvern 公司)。
盐酸阿霉素(DOX·HCl,纯度 > 99%,北京华奉联博科技有限公司);氢化大豆磷脂(HSPC,上海艾伟拓医药科技有限公司);胆固醇(CH,南京新百药业有限公司);聚乙二醇单甲醚 2000-二硬脂酰磷脂酰乙醇胺(DSPE-mPEG2000,上海艾伟拓医药科技有限公司);一水合醋酸铜(Cu(OAc)2·H2O,上海阿拉丁试剂有限公司);无水氯化铜(CuCl2,上海阿拉丁试剂有限公司);五水硫酸铜(CuSO4·5H2O,上海阿拉丁试剂有限公司);732 型阳离子交换树脂(国药集团化学试剂有限公司);其他试剂(分析纯,市售)。
2 方法与结果
2.1 阿霉素—铜复合物的紫外光谱确证
精密称取适量 Cu(OAc)2·H2O、CuCl2和 CuSO4·5H2O,用 Tris-HCl 缓冲液 (pH = 7.0) 配置成浓度为 25、50、100、150、200 和 250 μmol·L-1的 Cu2+溶液。精密称取一定量的 DOX·HCl,用 Tris-HCl 缓冲液 (pH = 7.0) 配置成浓度为 100 μmol·L-1的 DOX 溶液。将上述不同浓度的 Cu2+溶液分别与 DOX 溶液等体积混合,37 ℃水浴震荡反应 72 h,在 350~650 nm 波长下扫描。
由图 2 a-c 可以看出 Cu2+的加入引起 DOX 紫外光谱发生红移,图 2 d-f 表明随着 Cu2+浓度的增大 DOX 的吸收光谱最大吸收波长(480 nm)处的吸光度值显著降低,当c(Cu2+) :c(DOX)= 1 : 2 时达到极值,由此可以推测 DOX 与 Cu2+按 2 : 1 方式复合。实验同时考察了阴离子(OAc-、Cl-、SO42-)对光谱学特征的影响,由图 2 可知,阴离子对复合物的形成无影响。
2.2 阿霉素—铜脂质体的制备
将 HSPC、CH 和 DSPE-mPEG2000按照3 : 1 : 0.3 (w / w / w)的比例置于 250 mL 茄形瓶,加入适量氯仿充分溶解,35 ℃ 条件下旋转蒸干溶剂,避光放置一夜,除尽残留的氯仿,得到均匀的脂质薄膜。加入浓度为 250 mmol·L-1的 Cu(OAc)2溶液,65 ℃ 下旋转水化 30 min。冰水浴超声分散(45 W, 2 min; 60 W, 2 min; 75 W, 2 min),依次通过 0.80、0.45 及 0.22 μm 的微孔滤膜,反复过膜三次,即得 Cu(OAc)2脂质体混悬液。吸取 5 mL Cu(OAc)2脂质体混悬液于柱高为 8 cm 的阳离子树脂交换柱,2000 r·min-1离心 5 min。重复上述操作三次,得到铜梯度脂质体(Cu-L)。
将 Cu-L 与 DOX 溶液混合,在水浴条件下持续搅拌数分钟,取出置于冰水浴中 5 min 终止载药。得到 Cu-DOX 脂质体。
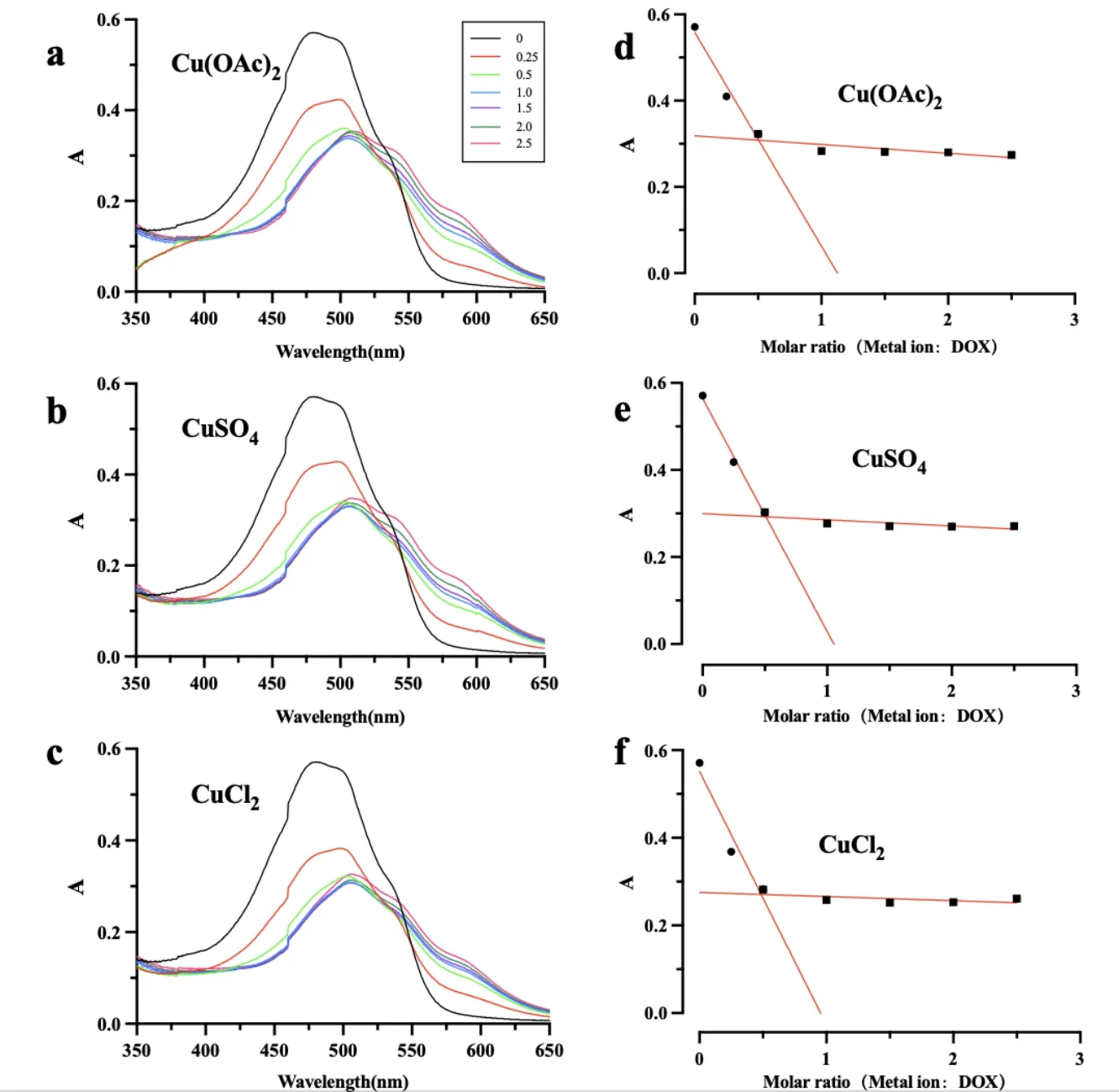
Fig. 2 UV absorption spectra of the mixed solution of Cu2+-DOX with different proportions (a-c) and absorbance of the solution at 480 nm (d-f)图2 Cu2+-DOX 不同配比的混合溶液紫外吸收光谱图 (a-c) 和溶液在 480 nm 的吸光度 (d-f)
2.3 脂质体中 DOX 含量测定方法的确定
2.3.1 检测波长的选择
分别取 Cu-L、Cu(OAc)2、DOX、Cu-DOX 复合物(2 : 1)以及 Cu-L 与 DOX 混合物,以体积分数为 90% 的异丙醇溶液(含 0.75 mol·L-1HCl)溶解配置成 DOX 浓度为 50 μg·L-1或 Cu2+浓度为 2.5 mmol·L-1的溶液。在波长 350~650 nm 内进行扫描,结果如图 3 所示,最终选择510 nm 为检测波长,在此条件下 Cu-L 和 Cu2+均对 DOX 的测定无影响。

Fig. 3 UV absorption spectra of Cu-L, DOX solution, Cu2+ solution, Cu-DOX complexes and mixed solution of Cu-L and DOX图3 铜梯度脂质体、阿霉素溶液、铜离子溶液、铜-阿霉素复合物、铜梯度脂质体与阿霉素混合溶液紫外光谱图
2.4 线性关系考察
准确配制质量浓度为 1 mg·mL-1的 DOX 储备液 5 mL。精密量取 1 mL 于 10 mL 量瓶中,用体积分数为 90% 的异丙醇溶液(含 0.75 mol·L-1HCl)稀释至刻度,摇匀,从中依次吸取 2.0、2.5、3.0、3.5、4.0 mL 于 10 mL 量瓶,用体积分数为 90% 的异丙醇溶液(含 0.75 mol·L-1HCl)稀释至刻度,摇匀,得到浓度分别为 20.0、25.0、30.0、35.0、40.0 mg·L-1的 DOX 标准溶液,于510 nm 波长下测定吸光度,以 DOX 浓度C(mg·L-1) 为横坐标,吸光度A为纵坐标绘制标准曲线,得到回归方程A= 0.022 26C- 0.033 6 (10~30 mg·L-1,r= 0.999 9)。
2.5 脂质体包封率的测定
精密量取两份 Cu-DOX 脂质体 100 μL,一份上样于阳离子交换树脂柱顶端,2 000 r·min-1离心5 min,加入 200 μL 重蒸水于树脂柱顶端,2 000 r·min-1离心 5 min,重复洗脱 2 次,收集洗脱液转移至 10 mL 量瓶中,以体积分数 90% 异丙醇(含 0.75 mol·L-1HCl)破乳稀释至刻度,于510 nm 波长处测定吸光度,代入标准曲线方程计算脂质体内部 DOX 浓度(记为Cencapsulation);另一份直接加入 10 mL 量瓶中,重复上述操作破乳,测定总的 DOX 浓度(记为Ctotal)。包封率根据公式EE(%)= Cencapsulation/Ctotal×100% 进行计算。
2.6 包封率影响因素的考察
以包封率为评价指标,考察药脂比、铜盐种类、铜离子浓度、和外水相 pH 值等对脂质体包封率的影响,得到最优制剂。
2.6.1 铜盐种类对 Cu-DOX-L 包封率的影响
以 HSPC/CH/DSPE-mPEG2000(3 : 1 : 0.3,w / w / w)为基本处方,以浓度为 250 mmol·L-1的CuCl2、CuSO4和 Cu(OAc)2溶液为水化介质,制备 Cu-DOX-L,结果如图 4a 所示。以 CuCl2、CuSO4为水化介质装载的 Cu-DOX-L包封率相近,仅为 30% 和 40%;而以 Cu(OAc)2为水化介质制备的 Cu-DOX-L 包封率达到可达到(65.03 ± 1.37)%。因此选择 Cu(OAc)2溶液作为水化介质,进行后续处方和工艺研究。
2.6.2 铜离子浓度对 Cu-DOX-L 包封率的影响
固定其他条件不变,分别以浓度为 150、200、250 和 300 mmol·L-1的 Cu(OAc)2溶液为水化介质,制备脂质体,结果如图 4b 所示,浓度为 250 mmol·L-1时包封率最高为(78.46 ± 1.68)%。
2.6.3 药脂比对 Cu-DOX-L 包封率的影响
固定其他条件不变,分别按药脂比为 1 : 5、1 : 10 和1 : 20 载药,结果如图 4c 所示,当药脂比达到 1 : 10 和 1 : 20 时包封率均超过 80%,且无显著性差异。因此确定药脂比为 1 : 10。
2.6.4 外水相 pH 值对 Cu-DOX-L 包封率的影响
固定其他条件不变,将脂质体外水相分别调节为 pH = 5.0、6.0、7.0,结果如图 4d 所示,发现当外水相 pH 达到 7.0 时脂质体的包封率显著增加,达到(80.70 ± 1.93)%。
2.6.5 载药时间对 Cu-DOX-L 包封率的影响
固定其他条件不变,改变载药时间,结果如图 4e 所示,可以明显看出包封率并没有明显变化,因此选择 5 min 为最佳载药时间。
2.6.6 载药温度对 Cu-DOX-L 包封率的影响
固定其他条件不变,改变载药温度,结果如图 4f 所示,发现在 65 ℃ 时包封率最高为(87.43 ±2.90)%。

Fig. 4 Effect of various salt gradients (a), concentration of copper solution (b), drug/lipid ratio (c), pH of exterior aqueous phase (d), incubation time (e) and incubation temperature (f) on the encapsulation efficiency of Cu-DOX-L (n = 3)图4 铜盐种类(a)、浓度(b)、药脂比(c)、外水相 pH 值(d)、载药时间(e)和载药温度(f)对Cu-DOX-L(n = 3)包封率的影响
2.6.7 处方工艺的确定
经过单因素实验考查,最终确定了最佳处方工艺为:使用浓度为 250 mmol·L-1的 Cu(OAc)2为水化介质,将外水相调至 pH = 7,按照药脂比 1 : 10 将 Cu-L 和 DOX 混合,在 65 ℃ 下孵育 5 min后,冰水浴停止载药,得到脂质体包封率为(87.43 ± 2.90)% 。
2.7 阿霉素-铜脂质体的质量评价
2.7.1 外观
由图 5a 可见,硫酸铵梯度装载的 DOX 脂质体(图 5a 左)颜色与 DOX 溶液颜色一致,呈红色;Cu-L (图 5a 中)呈蓝色,而经 Cu(OAc)2梯度制备的 Cu-DOX-L(图 5a 右)颜色呈紫色。颜色的变化可以推测 DOX 在脂质体内部与 Cu(OAc)2形成复合物,与“2.1 阿霉素—铜复合物的紫外光谱确证”项下的结果一致。
2.7.2 脂质体的粒径及形态特征
粒径测定:取制备好的 Cu-DOX-L 适量,以水为介质进行稀释,放入样品池内,使光密度值在 (300 ± 50) kHz 之间,采用马尔文粒度测定仪测定粒径。测得脂质体的粒径为 104.3 nm,多分散性指数 PDI 为 0.184。
形态:吸取适量经水稀释的 Cu-DOX-L 样品,滴加在覆盖碳膜的铜网上,保持 10 min,用 1.0%(w/v)磷钨酸进行负染 1 min,置于透射电镜(TEM, Hitachi HT7700, 日本)下观察脂质体的形态并拍照,结果如图 5b 所示,脂质体为圆形或类圆形状囊泡,多为单室脂质体,大小较为均一,粒径约为 100 nm,与粒度测定仪所测定的数据基本吻合。
2.7.3 体外释放
取 Cu-DOX-L 2 mL 加入 8 mL 的 PBS 溶液(pH = 7.4 和 pH = 5.5)中,37 ℃恒温水浴,70 rpm·min-1避光震荡,于 0.5、1、2、4、8、12 h 取样,测定包封率,通过包封率的变化计算累计释放量。并以 DOX 的累积释放量为纵坐标,时间为横坐标绘制药物释放曲线图,由图 5c可以看出 pH 的降低导致 DOX 的累计释放量增大。

Fig. 5 The appearance (a), TEM image (b) and release (c) of Cu-DOX liposomes图5 脂质体的外观(a)、形态(b) 和释放图(c)
3 讨论
Azadeh 等[5]和 Jiang 等[10]采用葡萄糖酸铜-三乙醇胺混合梯度法制备 DOX 脂质体,三乙醇胺产生的铵梯度促进了 DOX 进入脂质体内部形成 Cu-DOX 沉淀[5]。本研究为考察 Cu2+梯度对 DOX 的载药效果的影响,回避了采用弱氨(氨水或三乙醇胺)调节内水相 pH 值,结果发现对于 Cu(OAc)2梯度而言,随 Cu2+浓度的增大,DOX 包封率逐渐增大,当浓度达到 250 mmol·L-1时,包封率最高可达到 80% 以上。人们[11-12]发现在铵梯度载药过程中,阴离子的种类对 DOX 的包封率影响显著,氨的一元酸盐(醋酸铵)梯度包封率低于氨的多元酸盐(硫酸铵、磷酸铵等)。
本研究结果发现,在 Cu2+梯度载药过程中,阴离子的种类也显著影响着 DOX 的包封率,但与之不同的是:弱酸盐(Cu(OAc)2)梯度脂质体装载的 DOX 包封率远高于强酸盐(硫酸铜、氯化铜)。研究中我们模拟脂质体内部环境,将 DOX 与不同浓度的 Cu(OAc)2、CuSO4和 CuCl2混合,发现混合后的紫外吸收广谱最大吸收波长发生了红移且吸光度急剧下降(见图 2),而阴离子的种类对光谱未发生影响。从图中我们也发现吸光度在摩尔比 1 : 2 (Cu2+: DOX)时降到最低值,由此我们判断脂质体中 Cu2+和 DOX 可按照摩尔比例为 1 : 2 形成形成络合物 Cu(DOX)2,络合物的形成与阴离子种类无关。但缘何 Cu(OAc)2梯度得到的 DOX 包封率高于 CuSO4梯度和 CuCl2梯度?这可能与 OAc-的弱酸性有关。DOX 进入脂质体内水相后,与 Cu2+络合释放出的 H+离子可被 OAc-消耗生成醋酸,使络合反应正向移动,促进 DOX 的包封(图 6)。

Fig. 6 Schematic diagram of loading drugs into liposomes using a copper gradient图6 使用铜梯度将药物加载到脂质体中的示意图
除包封率外,药物的释放也是脂质体的重要考察指标。人体内环境中的 pH 值一般为 7.4 左右,而脂质体在人体内被吞噬后所处的内环境 pH 值为 5.0~5.5。因此本实验选取了 pH = 7.4 和5.5 的 PBS 溶液为释放介质考察脂质体中 DOX 的释放特性,发现 DOX 释放具有 pH 依赖性(图 5c),在 pH = 5.5 时 DOX 释放增加,说明 H+离子浓度增大促进 Cu(DOX)2的解离,导致DOX 释放。

