SPH3261 微丸胶囊的工艺筛选
刘文君 ,王东凯,张锐峰,陈宣全
(1. 沈阳药科大学 药学院,辽宁 沈阳 110016; 2. 上海医药集团(本溪)北方药业有限公司,辽宁 本溪 117000)
人体表皮生长因子受体 2(HER2)是具有酪氨酸激酶活性的表皮生长因子受体家族中的一个成员。HER2 基因扩增/蛋白过表达(称为 HER2 阳性)为 HER2 活化的常见机制,过去 20 年的研究已经确认,HER2 蛋白的过表达,无论是通过基因扩增还是通过转录失活,其经常与各种实体肿瘤的致癌有关。在临床上,HER2 阳性的肿瘤有乳腺癌、胃癌、食道癌、卵巢癌、子宫内膜癌、结直肠癌、肺癌等。因此,HER2 是一个有价值的治疗靶点。HER2 作为一种致癌的驱动因子,是乳腺癌和胃癌中公认的治疗靶点[1]。
乳腺癌是一种威胁全世界女性健康的常见恶性肿瘤,是全球发病率第一的癌症。有研究表明,HER2 阳性的乳腺癌约占 20%~30%,其生物学特点表现为肿瘤侵袭性强、复发风险高、对传统化疗不敏感,因此被认为是乳腺癌类型中的凶险之最[2]。约 15%~20% 的患者存在 HER2 基因的扩增及其编码蛋白的过表达,与肿瘤侵袭性强、复发率高有关,其预后不良。且 HER2 过表达的患者对内分泌治疗和标准化疗治疗的效果均不佳[3]。HER2 扩增性乳腺癌具有区别于其他类型乳腺癌的生物学特征,这些包括增加对某些细胞毒性化疗药物的敏感性、对某些激素药物的耐药性以及增加转移到大脑的倾向。但耐药性及血脑屏障仍然是 HER2 阳性乳腺癌脑转移的治疗难点。因此,寻找更加安全有效的全身治疗药物对 HER2 阳性患者至关重要[4]。
国际乳腺癌研究组(IBCSG)研究显示,HER2 阳性乳腺癌患者以脑转移为进展事件的发生率显著高于 HER2 阴性患者,HER2 阳性乳腺癌患者在疾病发生发展的过程中出现脑转移的概率高达 50%[5]。SPH3261是上海医药集团自主开发的新型生物碱类 1 类新药(化学名为:N4-(4-([1,2, 4]-三唑并[4, 3-c]嘧啶-7-基氧基)-3-甲基苯基)-N6-(4, 4-二甲基-4, 5-二氢噁唑-2-基)喹唑啉-4, 6-二胺),是具有HER2选择性的小分子抑制剂。
通过已完成的临床前药效学、药代动力学和毒理学研究数据分析,SPH3261 是 HER2 选择性小分子抑制剂。通过对体外培养肿瘤细胞增殖影响的检测,可以抑制 HER2 过表达细胞增殖。可显著抑制多种类型 HER2 过表达肿瘤细胞裸小鼠皮下移植瘤生长,高剂量下引起肿瘤消退。在人源乳腺癌 BT474 细胞皮下移植瘤模型中,SPH3261 联合 Herceptin 用药组相对于 SPH3261或 Herceptin 单药组具有更好的肿瘤抑制作用。SPH3261 经口服给药后吸收迅速,分布较为广泛,血浆中清除较快。口服给药后大鼠和犬的消除半衰期均约 1.0~2.0 h。SPH3261 在人肝微粒体中的氧化代谢主要由 CYP2C8、CYP2D6、CYP3A4 和 CYP3A5 酶催化,肝细胞体外代谢试验未发现人体特有的代谢物种类。SPH3261 在多种人源肿瘤细胞裸鼠皮下移植瘤上的疗效与ONT-380 相当,而临床前 4 周重复给药毒性试验显示,SPH3261 作为抗肿瘤药物具有合适的安全窗。同时原药与其主要代谢产物在肿瘤中有较高的分布,在脑中也有一定的分布。SPH3261 作为 1 类新药,其具有良好的稳定性,经过前期调查研究,临床拟定每天连续服用;相较于其他给药方式,将 SPH3261 开发为口服制剂能够提高患者依从性,节约医疗资源;同时,对于血管受限的癌症患者而言,口服制剂能够提供更多选择。因此,综合上述原因,将 SPH3261开发为口服制剂。
1 仪器与试药
1.1 仪器
BJ8100D 电子秤(瑞士普利赛斯公司);ML4002T 电子天平(梅特勒—托利多国际贸易(上海)有限公司,百分之一);ML204T 电子天平(梅特勒—托利多国际贸易(上海)有限公司、千分之一);50 L 可倾式夹层锅(浙江温兄机械阀业有限公司);WBF-1G 多功能流化床(重庆英格造粒包衣技术有限公司);NJP-400A 全自动硬胶囊充填机(北京翰林航宇科技发展有限公司);Acquity Arc 高效液相色谱仪(沃特世科技有限公司)、FADT-801RC 自动取样溶出仪(上海富科思分析仪器有限公司)。
1.2 药品与试剂
SPH3261(上海医药集团(本溪)北方药业有限公司,批号 200301)、酒石酸微丸丸芯(杭州高成生物营养技术有限公司,批号 20191001)、滑石粉(药用)(桂林桂广滑石开发有限公司,批号 1910029)、羟丙基纤维素(HPC-SL,日本曹达株式会社,批号 NIL-3921)、羟丙甲纤维素 E5(HPMC E5,卡乐康有限公司,批号 D011JA6L02)、聚乙二醇 6000(PEG6000,南京威尔药业股份有限公司,批号 20190701B-1)、羟丙甲纤维素空心胶囊(HPMC,D0#,D3#)(Capsugel France SAS,批号 F35181471、F53607101)。
2 方法与结果
2.1 处方筛选
SPH3261 为难溶性药物,溶出度较低。在 Beagle 犬单次给药和重复给药毒性试验中(均为Naïve 动物),设置原料药片剂(湿法制粒、干燥整粒,加润滑剂压片)、原料药混悬液(原料药与水混合)和原料药胶囊(原料药直接灌胶囊)三个给药组,结果显示个体差异波动较大。前期平衡溶解度实验结果显示 SPH3261 在弱酸条件下溶解度较好。因此,增设原料药和酒石酸丸芯混合物胶囊给药组。实验结果显示该给药组个体差异小,吸收情况良好。食蟹猴在原料药和酒石酸丸芯混合物胶囊给药后,实验结果显示个体差异小,无未吸收的情况。鉴于微丸具有可以增加药物与胃肠道的接触面积、提高药物在体内的生物利用度的优点[6],结合平衡溶解度实验结果显示 SPH3261 在弱酸条件下溶解度较好,SPH3261 作为弱碱性药物,酒石酸丸芯能够提高其生物利用度。因此综合上述原因,将 SPH3261 以酒石酸丸芯制备微丸。前期调研结果结合临床需求的分析,将SPH3261 开发成规格为 50 mg 和 150 mg 的胶囊剂。
参考国内常用辅料供应情况,并结合 SPH3261 的性质进行 SPH3261 微丸胶囊辅料相容性试验,试验结果表明主药与酒石酸丸芯在光照和高湿条件下不稳定。因此,丸芯与主药之间应增加隔离层以防止降解。选用与 SPH3261 相容性良好的辅料,以溶出度、有关物质等项目为指标,进行处方筛选。两个规格的制剂处方成分和比例相同,主药占 30.3%,酒石酸丸芯占 36.4%,处方中羟丙甲纤维素、滑石粉、聚乙二醇、羟丙基纤维素在常规用量范围内(见表 1)。

Table 1 SPH3261 Formulation component of scale production(3 000 grains)表1 SPH3261生产规模处方组成(3 000 粒)
2.2 工艺筛选
依据主药与辅料的相容性研究,确定 SPH3261 微丸制备工序为:第一步,酒石酸丸芯包隔离层;第二步,进行载药层包衣;第三步,进行包衣层包衣。考虑到溶出、微丸的机械强度及胶囊填充量,隔离层目标增重为 20%~30%,因此包衣后酒石酸含量控制在 70%~80%;载药层的载药量(以 SPH3261 含量计)控制在 28%~32%;包衣层为达到防潮效果,控制包衣增重 10%。
2.2.1 隔离层参数的确定
由于酒石酸微丸丸芯与 SPH3261 直接接触可能导致药物发生降解,因此为了保证酒石酸丸芯不与 API 接触,需将丸芯包覆隔离层。通过对比包隔离层前后酒石酸丸芯中的酒石酸含量来确定隔离层对酒石酸丸芯的包覆情况,以此调整隔离层增重(F= (mb-ma) /ma× 100%,ma和mb分别是包衣前后的微丸重量)。由于隔离层的包衣过程中不涉及原料药,不会影响药物性质,因此对进风温度以及喷液速度的要求较低,可通过调节进风量来调整微丸在流化床中的状态[7],以得到合格的微丸。在控制进风温度为 40~65℃,喷液速度为 2%~12%,进风量为 65~85 m³·h-1的条件下,我们对两个规格三批小试包隔离层的中间体进行包衣增重测定,在此条件下制得的微丸均在标准限度内(结果见表 2)。

Table 2 Determination of coating weight gain in two specifications and three batches of pilot scale intermediates表2 两个规格三批小试中间体包衣增重测定
通过上述试验,确定制备隔离层的工艺参数为进风温度 40~65℃,喷液速度 2%~12%,进风量 65~85 m³·h-1。
2.2.2 载药层参数的确定
2.2.2.1 导流筒下端与空气分布板间距离的考察
调节导流筒下端与分布板的间距可控制进入导流筒的微丸数量。间距过小,进入导流筒的微丸少,会使部分包衣液雾滴经颗粒间隙逃逸,不利于均匀包衣。间距过大,进入导流筒的微丸多,增大颗粒相互粘连的概率。为使微丸在流化床内达到比较稳定的状态及流化高度,调节导流筒下端与空气分布板间的距离分别为 5 mm 及 15 mm,调节不同距离下进风量为 65、70、80 及90 m³·h-1,以微丸流化状态为评价指标(结果详见表 3)。

Table 3 Effects of distance between draft tube and air distribution board on fluidized state表3 导流筒与空气分布板间距离对流化状态的影响
结果表明,当导流筒下端与空气分布板之间的距离为 5 mm 时,不同进风量下,导流筒壁与流化床壁之间的微丸始终难以达到一个较好的流化状态,两壁之间的微丸在距空气隔板较近的部位流动,不能参与到包衣的流化循环中。调节距离为 15 mm 时,通过调节进风量,微丸在流化床内能达到较好的流化状态。
2.2.2.2 进风量的考察
在载药层的包衣过程中,通过对进风量的调整使微丸在流化床中达到相对稳定的流化状态,从而得到符合标准的微丸。

Table 4 Effects of inlet air volume on particle size distribution表4 进风量对粒径分布的影响
结果表明,当进风量 > 90 m³·h-1时,流化状态较为剧烈,最终得到的微丸破损明显增多,< 30 目筛网的细粉和颗粒也较多;进风量为 70~80 m³·h-1与 80~90 m³·h-1时,> 16 目筛网微丸稍多,多为粘连微丸,但可以借助载药层包衣结束后的筛分步骤去除。为方便后续工艺操作,控制进风量为 70~90 m³·h-1,在此范围内,根据微丸流化状态进行适当调整。
2.2.2.3 物料温度的考察
在 SPH3261 微丸的制备过程中,若物料温度保持不变,则可保证微丸在制备过程中有良好的重现性及载药的均匀度。
物料温度分别控制在 (30 ± 5) ℃、(40 ± 5) ℃ 及 (50 ± 5) ℃ ,固定包衣液用量进行包衣,计算相同包衣液用量下的微丸载药量,以相对标准偏差及微丸外观为评价指标(结果详见表 5)。
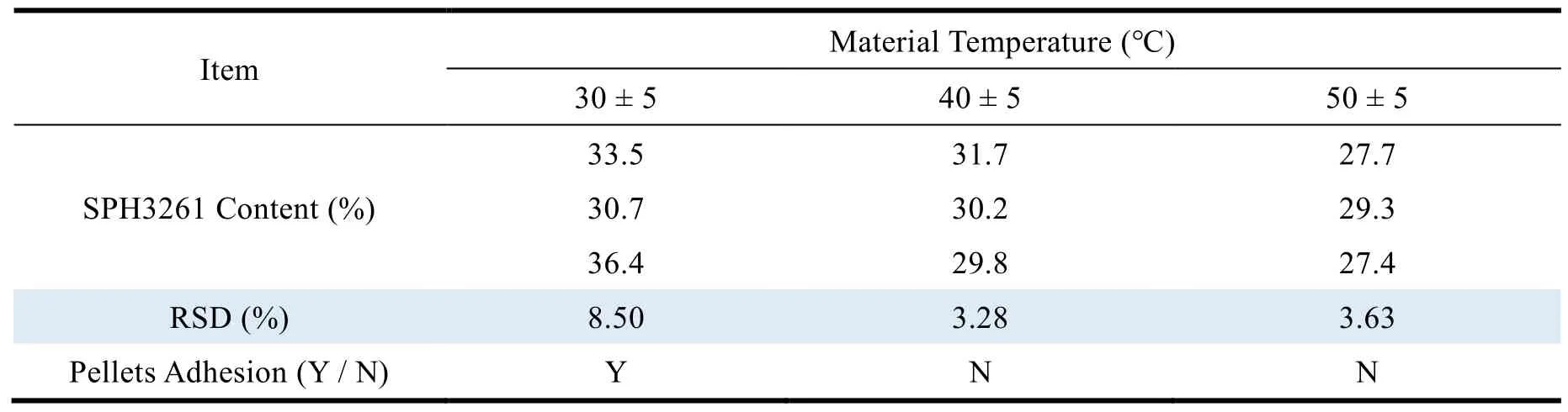
Table 5 Effects of different material temperature on SPH3261 content and reproducibility表5 不同物料温度对 SPH3261 含量及重现性的影响
结果表明,在物料温度较低时,批次间重现性较差,微丸间出现粘连现象;物料温度高时,虽然可以得到重现性较好的包衣微丸,但载药量低;而在 (40 ± 5) ℃时,重现性好,载药量合格。因此确定物料温度范围为 (40 ± 5) ℃。
流化床的进风温度及喷液速度(泵流速)影响物料的温度。在进风温度设置为 (45 ± 2) ℃、(50± 2) ℃ 及 (60 ± 2) ℃ 时,通过调节不同的喷液速度使物料温度达到 (40 ± 5) ℃(结果详见表 6)。

Table 6 Screening of inlet air temperatures and spay speeds on pellets表6 进风温度与喷液速度的筛选
结果表明,当喷液速度低时,包衣时间长;喷液速度高则需要升高进风温度,环境条件较为剧烈会造成微丸破损,收率降低。而在初始包衣时,较高的喷液速度会导致微丸的粘连,较低的进风温度不利于物料温度的升高;故在初始包衣时,设定较高的进风温度和较低的喷液速度,使微丸能够在短时间内达到规定的物料温度;待包衣至微丸具备一定机械强度后,升高进风温度及喷液速度,缩短包衣时间,提高包衣收率。最终确定载药层的工艺参数为导流筒下端与空气分布板之间的距离为 15 mm,进风量为 70~90 m³·h-1,物料温度为 (40 ± 5) ℃。在物料温度 < 35 ℃时控制进风温度 60 ℃,喷液速度为 8%~10%;当物料温度达到 35 ℃时,控制进风温度 45~55℃,喷液速度为 12%~14%;当 API 剩余三分之一时,控制进风温度 55~60℃,喷液速度为16%~18%。
2.2.3 包衣层参数的确定
他开始在清华养起了猫。小猫初次上树,不敢下来,他设法把它救下。小猫下来后,用爪子轻轻软软地在他腕上一搭,表示感谢。钱钟书常爱引用西方谚语:“地狱里尽是不知感激的人。”小猫知感激,钱钟书说它有灵性,特别宝贝。
SPH3261 包衣层增重 10% 的制备过程中,需要在保证微丸不粘连的情况下快速包衣,防止在包衣过程中,由于微丸间的碰撞导致载药量减少。
当进风量为 85~95 m³·h-1时,固定喷液量,调节喷液速度,以微丸是否粘连以及微丸载药量为评价指标(结果详见表 7)。
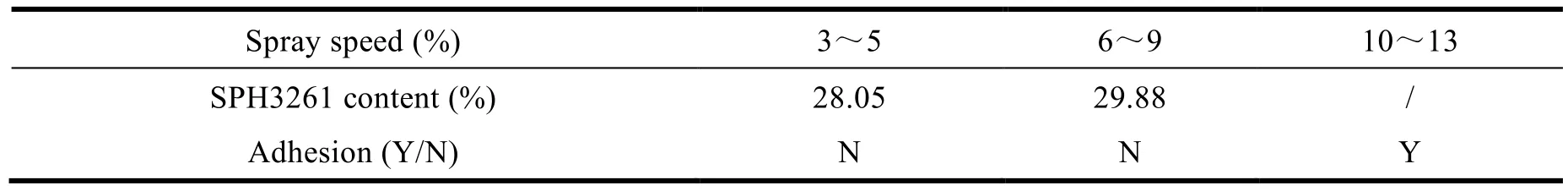
Table 7 Effects of spray speed on pellets adhesion and SPH3261 content表7 喷液速度对微丸粘连及 SPH3261 载药量的影响
结果表明,当喷液速度为 3%~9% 时,载药量合格;当喷液速度为 10%~13% 时,微丸在包衣起始阶段就出现粘连现象。因此,确定制备包衣层的工艺参数为进风量 85~95 m³·h-1,喷液速度 3%~9%。
2.3 工艺评价
为考察拟定工艺的稳定性,制备了 3 批中试样品,依据拟定的质量标准分别对 SPH3261 微丸胶囊的含量、有关物质及溶出度进行检验。
2.3.1 含量及有关物质测定
分别精密量取供试品溶液、对照溶液与杂质对照品溶液各 10 μL 分别注入液相色谱仪,在检测波长 240 nm、柱温 30℃ 下进行梯度洗脱(液相条件见表 8)记录色谱图,按照外标法进行有关物质的计算(结果详见表 9)。

Table 8 Liquid phase conditions for content and related substances determination表8 含量及有关物质测定的液相条件

Table 9 Quality inspection results of 2 specifications 3 batches of samples表9 两个规格 3 批样品质量检验结果
2.3.2 溶出度测定
取 SPH3261 微丸胶囊(n= 7),依据《中华人民共和国药典》2015 版四部溶出度与释放度测定方法,采用溶出度测定第 2 法装置,以 1 000 mL 水为溶出介质,设置转速为 75 rpm,分别在 5、10、15、20、30、45、60 min 取样 2 mL(同时补充相同温度的介质 2 mL),滤过,续滤液按照“2.3.1含量测定有关物质测定液相方法”项下液相方法进行测定(结果见图 1)。

Fig. 1 Cumulative dissolution curves of two gauge capsules图1 两种规格胶囊样品的溶出曲线(n = 7)
从两个规格各三批样品主要项目的检测结果看,各检验项均合格,溶出曲线一致。因此,确定此工艺较为稳定。
3 讨论
本试验通过单因素试验对 SPH3261 微丸胶囊制备工艺进行考察,确定了流化床包衣工艺分为三个步骤,第一步,酒石酸丸芯包隔离层防止酒石酸微丸丸芯与原料药直接接触导致原料药发生降解;第二步,包裹有隔离层的丸芯进行上药包衣;第三步,载药丸芯进行外层包衣。依据该处方工艺,以包衣增重、微丸的粒径分布、微丸载药量为指标,对微丸的制备过程中的导流筒下端与空气分布板间距离、进风温度、物料温度、喷液速度等工艺参数进行筛选,确定了流化床包衣的工艺参数。按照此工艺进行了三批中试批的制备及检验,三批中试批样品的外观、溶出度、有关物质、含量主要测定项目结果无明显差异;通过自制样品的批间溶出重现性来考察工艺稳定性,结果证明通过该工艺制得的产品各项检验项目均合格,溶出曲线一致。因此,该微丸胶囊的处方设计合理,工艺重现性良好。
- 中国药剂学杂志(网络版)的其它文章
- 醋酸铜梯度法制备阿霉素脂质体
- 磷酸特地唑胺片的制备及其初步质量评价
- 明胶胶囊交联机制与其检测方法的研究进展

