磷酸特地唑胺片的制备及其初步质量评价
陈中亚,王 群,拥青她姆
(江苏豪森药业集团有限公司,江苏 连云港 222000)
磷酸特地唑胺,化学名为[(5R)-3-{3-氟-4-[6-(2-甲基-2H-四唑-5-基)吡啶-3-基]苯基}-2-氧噁唑烷-5-基]甲基二氢磷酸酯,是一种新型噁唑烷酮类抗生素。磷酸特地唑胺是一种前药,在体内可被磷酸酶迅速转化为具有生物活性的特地唑胺,特地唑胺通过与细菌核糖体 50S 亚基结合,抑制蛋白质的合成,从而发挥抗菌作用,其作用机制不同于其他非噁唑烷酮类抗菌素,因此不大可能与其他类别的抗菌药物发生交叉耐药[1-3]。
磷酸特地唑胺片 2014 年在美国批准上市,2019 年在中国批准上市,商品名为 SIVEXTRO®(赛威乐®),用于治疗急性细菌性皮肤和皮肤软组织感染,上市规格为 200 mg,剂型为片剂,外观为椭圆形黄色薄膜衣片,空腹口服磷酸特地唑胺片时,特地唑胺的血药浓度在口服后大约3 小时内达峰。绝对生物利用度约为 91%,可以随餐或空腹服用,因为空腹和随餐(高脂高热)状态下,全身总暴露量(AUC0-∞)无变化[4]。截至 2021 年 12 月,原研制剂暂时没有在中国销售,同时国内没有仿制品种上市。本研究立足于工业化生产设计,为增大患者临床用药的选择性并降低用药成本,以 Merck Sharp & Dohme Corp 公司的 SIVEXTRO®为参比制剂,对处方工艺进行筛选优化,并采用流化床制粒技术对优化后最终处方进行工业化生产。
1 仪器与材料
1.1 仪器
HSD-10 料斗混合机(浙江迦南科技股份有限公司);FPCG2 实验性多功能流化床(富垚机电科技发展(上海)有限公司);DP30A 单冲压片机(北京国药龙立科技有限公司);GMPC I Mini-Coater 小型包衣机(德国 Glatt 公司);HTD600 柱式料斗混合机(浙江迦南科技股份有限公司);FBW60B 多功能沸腾制粒机(浙江迦南科技股份有限公司);ZLT200B 提升整粒机(浙江迦南科技股份有限公司);S250 旋转式压片机(山东新马制药装备有限公司);BGB-150D 高效包衣机(浙江小伦制药机械有限公司);MB-200 分析筛分仪(浙江美壁仪器有限公司);ZS-2E 振实仪(天津市天大天发科技有限公司)ELITE8G2 自动溶出仪(Teledyne Hanson Research CO.LTD);Agilent 1260 高效液相色谱仪(安捷伦科技(中国)有限公司)。
1.2 材料
SIVEXTRO®(规格 200 mg,批号 CDDSW, Merck Sharp & Dohme Corp.);磷酸特地唑胺(江苏豪森药业集团有限公司);微晶纤维素(DuPont Nutrition USA. Inc);甘露醇(Roquette Freres);聚维酮 K30(BASF corporation);交联聚维酮(BASF SE);硬脂酸镁(辽宁奥达制药有限公司);薄膜包衣预混剂(胃溶型)(上海卡乐康包衣技术有限公司);冰醋酸、无水乙酸钠、磷酸二氢钾、氢氧化钠均为分析纯,乙腈为色谱纯,水为纯化水。
2 方法与结果
2.1 处方组成
磷酸特地唑胺片 2014 年在美国获准上市,商品名为 SIVEXTRO®(赛威乐®),参考原研制剂的说明书和原研专利,结合常规辅料用量范围(暂定处方组成见表 1)。
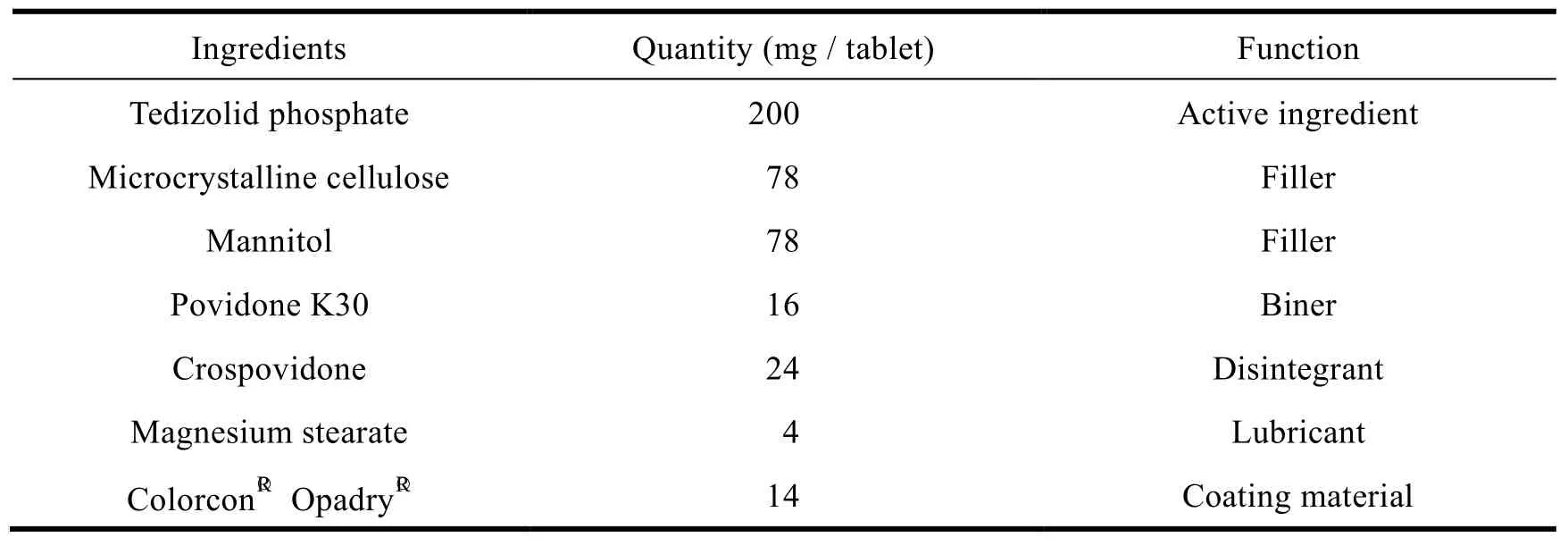
Table 1 Formulation composition of Tedizolid Phosphate Tablets表1 磷酸特地唑胺片处方组成
2.2 平衡溶解度测定
考察磷酸特地唑胺在 pH1.0~pH6.8 缓冲液中的平衡溶解度,为溶出介质的选择提供参考。
采用摇床法测定磷酸特地唑胺的平衡溶解度。称取磷酸特地唑胺原料药适量,加入到含有 30 mL介质的锥形瓶中,置于 (37 ± 2)℃ 的振荡水浴槽中,持续振荡 24 小时后,取上清液,使用 0.22 μm微孔滤膜过滤,作为供试品溶液,参照高效液相色谱法测定磷酸特地唑胺在不同 pH 条件下的平衡溶解度(具体测定结果见表 2)。
检测结果表明,磷酸特地唑胺具有明显 pH 依赖性,当 pH < 4.0 时,溶解性很差;当 pH >4.0 时,溶解度明显改善;且随着 pH 值的升高,溶解度也随之增大。

Table 2 Equilibrium solubility of Tedizolid Phosphate at different pH表2 磷酸特地唑胺在不同 pH 条件下的平衡溶解度
2.3 溶出方法
参照《中国药典》2020 版四部 0931 溶出度与释放度测定法第二法(桨法)[5],同时参考平衡溶解度测定结果,以 pH6.8 磷酸盐缓冲液为溶出介质,体积为 900 mL,转速为 60 rpm,依法操作,经5、10、15、20、30、45 和 60 min 分别取样 10 mL,经 0.22 μm 微孔滤膜过滤,同时补足 10 mL 空白介质,采用高效液相色谱法测定累积溶出度。
2.4 处方工艺优化
2.4.1 关键质量属性的评估
在产品开发初期,分析目标产品质量属性,并评估哪些质量属性归结为关键质量属性。对于该片剂,含量、含量均匀度、溶出度、有关物质、水分被评估为有可能受到处方或工艺变量影响的关键质量属性。
2.4.2 工艺的选择
张驰等[6]采用湿法制粒工艺制备磷酸特地唑胺片。但由于湿法制粒工艺对制粒时长、粘合剂用量、搅拌桨转速等比较敏感,这些参数的轻微改变都会对产品造成较大影响,同时存在过度制粒的风险。因此,本研究尝试采用流化床制粒工艺制备磷酸特地唑胺片。
2.4.3 工艺描述
由于原料药流动性较差且存在结团现象,因此,首先将原料药过 60 目筛网,然后将过筛后原料药与内加辅料混合均匀后加入到流化床制粒机中进行制粒,再将颗粒进行干燥整粒后与外加辅料混合均匀,最后对总混颗粒进行压片并包衣。
2.4.4 原料药粒度研究
由平衡溶解度测定结果可知,磷酸特地唑胺属于难溶性药物,不同粒度的原料药可能会对片剂体外溶出有一定影响。因此,通过对原料药进行微粉化处理,分别得到 d(0.9) 为 26.8~91.7 μm 范围内不同粒度的原料药,考察粒度大小对片剂溶出的影响(具体测定结果见图 1)。
研究结果显示,当原料药粒度 d (0.9) 为 91.7 μm 时,片剂溶出要慢于原研制剂;当原料药粒度 d (0.9) 在 26.8~64.4 μm 范围内时,自制制剂与原研制剂在 15 min溶出量均大于 85%,为快速释放,自制制剂与原研制剂相似[7]。因此,控制本品原料药粒度 d (0.9) ≤ 64.4 μm。
为了研究微粉处理后的原料在贮藏过程中粒度稳定性,将原料存放在低密度聚乙烯袋中并用聚酯/铝/聚乙烯复合膜袋密封,进行加速稳定性(40 ± 2 ℃/75% ± 5% RH)考察。结果显示加速条件下 3 个月原料粒度较为稳定,无明显变化,后续原料稳定性仍在进行中。

Fig. 1 Effects of API particle sizes on tablet dissolution in pH 6.8 medium图1 原料药粒度对片剂在 pH6.8 介质中溶出的影响
2.4.5 粘合剂加入方式的筛选
聚维酮 K30 在处方中作为粘合剂。在制粒过程中,粘合剂的加入方式往往会对产品质量造成较大影响,为考察粘合剂加入方式对产品的影响,分别选用粘合剂内加、粘合剂外加和粘合剂一半内加一半外加的方式进行制粒,并考察颗粒的粉体学性质、压片现象及片剂在 pH6.8 磷酸盐缓冲液中的溶出(具体测定结果见图 2和表 3)。
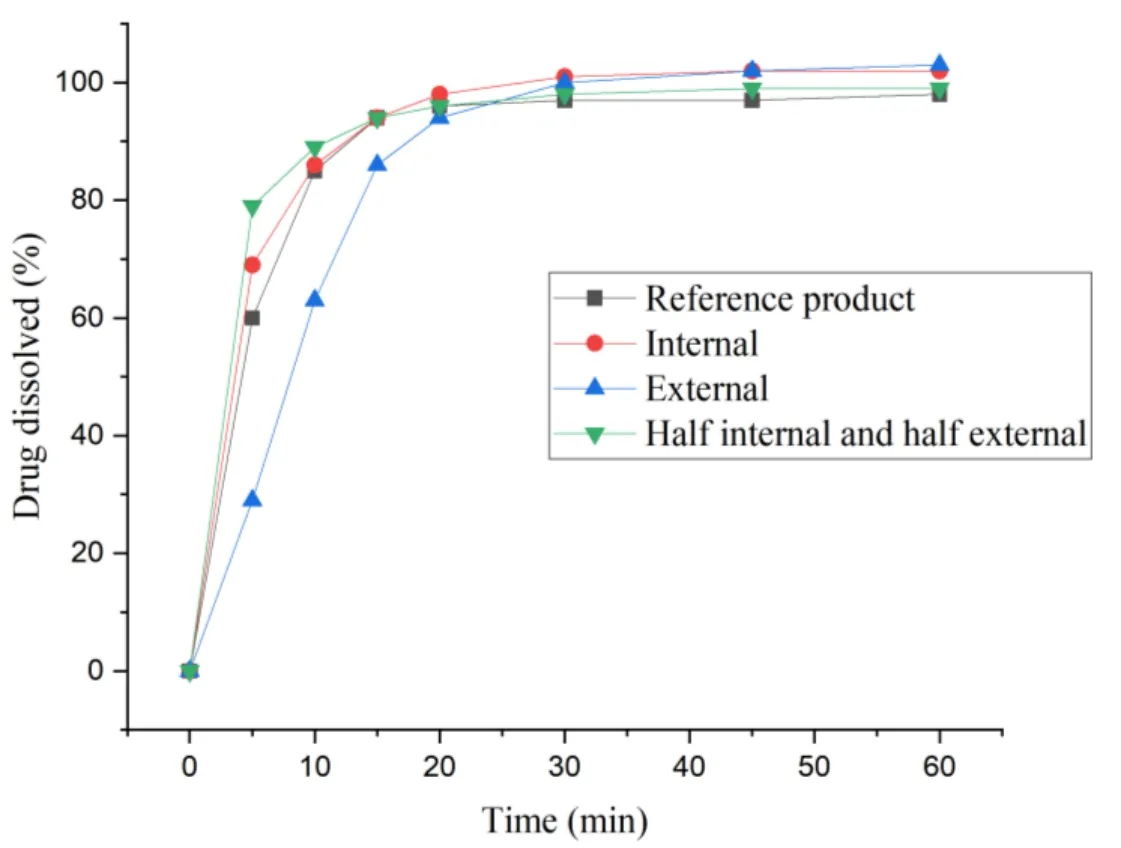
Fig. 2 The effects of binder addition on tablet dissolution in pH 6.8 medium图2 粘合剂加入方式对片剂在 pH6.8 介质中溶出的影响
研究结果显示,当聚维酮 K30 以处方量一半内加一半外加的方式进行制粒时,所制得的颗粒中 80% 以上为细粉,颗粒流动性差,导致在压片过程中存在粘冲现象;当聚维酮 K30 配制成水溶液以外加方式进行制粒时,所制得的颗粒粒度分布较为均匀,流动性较好,但片剂溶出要明显慢于原研制剂,且片剂间溶出 RSD 值较大;当聚维酮 K30 以内加方式即使用纯化水进行制粒时,所制得的颗粒粒度分布较为均匀,流动性较好,且溶出与原研制剂相似。
综合考察颗粒粉体学性质、压片现象及片剂溶出,最终选择聚维酮 K30 以内加方式进行制粒。

Table 3 Screening results for binder addition methods表3 粘合剂加入方式筛选结果
2.4.6 崩解剂加入方式的筛选
交联聚维酮在处方中作为崩解剂。崩解剂的作用主要是保证片剂在体外具有快速的崩解和溶出,进而使药物在体内具有快速的吸收。因此,以崩解时限为考察指标,考察崩解剂加入方式对片剂崩解时限的影响(具体测定结果见表 4)。

Table 4 Screening results for disintegrant addition methods表4 崩解剂加入方式筛选结果
研究结果显示,崩解剂加入方式的不同会对片剂的崩解产生一定的影响。因本品属于速释制剂,为保证片剂在体内具有快速的吸收,同时考虑到片剂崩解时限的均匀性,因此,最终确定崩解剂以一半内加一半外加的方式加入到处方中。
2.4.7 素片硬度的筛选
磷酸特地唑胺片属于速释片剂。对速释片剂来说,片剂硬度一般会对产品溶出产生一定影响。同时,由于磷酸特地唑胺片是异形片剂,在压片过程中可能会存在片剂硬度波动现象。因此,需要考察该品种在不同硬度范围内的溶出情况(具体测定结果见图 3)。
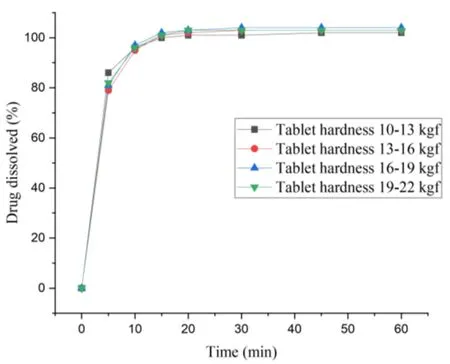
Fig. 3 Dissolution of Tablets with different hardnesses in pH 6.8 Medium图3 不同硬度的片剂在 pH6.8 介质中的溶出
研究结果显示,当素片硬度在 10~22 kgf 范围内时,不同硬度的素片在 pH6.8 介质中的溶出并没有明显差异。为控制片剂硬度在合适范围内,因此,最终确定在压片过程中,控制素片硬度为 12~20 kgf。
2.4.8 包衣增重的筛选
本品选择的包衣粉为胃溶型薄膜包衣预混剂。包衣的目的在于改善片剂外观,同时具有一定的防潮作用。在包衣过程中,由于本品包衣粉是黄色,若包衣增重较少的话,会存在片剂色差现象;若包衣增重较大,会耗时较长,同时可能会对产品溶出造成一定影响。因此,以片剂外观和溶出为考察指标,考察不同包衣增重对产品外观和溶出的影响(具体测定结果见图 4)。

Fig. 4 Dissolution of Tablets with Different Coating Weight Gains in pH 6.8 Medium图4 不同包衣增重的片剂在 pH6.8 介质中的溶出
研究结果显示,当包衣增重在 (1.62~4.74)% 范围内时,不同包衣增重的片剂在 pH6.8 介质中的溶出并没有明显差异。同时,在包衣过程中取样观察可以看出,当片剂包衣增重在 1.5% 左右时,基本不存在色差现象。因此,综合考虑,最终确定本品包衣增重为 (2.0~4.0)%。
2.4.9 拟定的处方工艺
根据上述处方工艺筛选结果,最终确定本品处方为磷酸特地唑胺 200 mg、微晶纤维素 78 mg、甘露醇 78 mg、聚维酮 K30 16 mg、交联聚维酮 12 mg(内加)、交联聚维酮 12 mg(外加)、硬脂酸镁 4 mg、薄膜包衣预混剂 16 mg,工艺为流化床制粒,润湿剂为纯化水。
2.4.10 晶型研究
根据原研专利信息[1]和 EMA 审评报告,原研制剂所使用的原料晶型为 A 晶型,自制原料晶型与原研制剂所用原料晶型保持一致。结合制剂制备工序,考察原料经制粒干燥、压片、包衣后晶型变化。结果显示经上述各工序后,原料晶型未发生变化。同时,对制剂成品进行加速稳定性(40 ± 2℃/75% ± 5% RH)考察。结果显示加速条件下 1 个月原料晶型无变化。后续的稳定性考察仍在进行中。
2.4.11 溶出方法学验证
本品最终选定 pH4.5 醋酸盐缓冲液、pH5.5 磷酸盐缓冲液和 pH6.8 磷酸盐缓冲液为溶出介质,用于自制制剂和参比制剂溶出曲线的表征。因此,开展了优选处方在三种不同 pH 条件下的溶出方法学验证。
(1)专属性
专属性研究显示空白稀释液、空白辅料均无干扰;磷酸特地唑胺与各杂质的分离度均符合规定。
(2)溶液稳定性
溶液稳定性研究结果显示,三种不同 pH 条件下的对照品溶液和供试品溶液分别在室温条件下放置 48 小时含量均无明显变化,稳定性良好。
(3)线性和范围
三种不同 pH 条件下线性范围研究结果显示,在 pH4.5 醋酸盐缓冲液中,本品在 22.394~279.926 μg·mL-1范围内线性良好;在 pH5.5 磷酸盐缓冲液中,本品在 22.322~279.029 μg·mL-1范围内线性良好;在 pH6.8 磷酸盐缓冲液中,本品在 21.940~274.249 μg·mL-1范围内线性良好。
(4)滤膜吸附
取磷酸特地唑胺片在三种不同 pH 介质中的溶出样品,均采用 PVDF、MCE 和 PES 三种不同材质滤膜过滤。结果显示,三种材质滤膜对本品均无明显吸附,弃去初滤液 1 mL 即可达到平衡。
(5)精密度
开展三种不同 pH 条件样品溶液的进样精密度研究,每种 pH 条件下分别重复测定 6 次,主峰峰面积 RSD 值均不超过 0.32%,结果表明精密度良好。
(6)准确度
开展了三种 pH 条件下回收率研究,在 pH4.5 醋酸盐缓冲液中,磷酸特地唑胺在空白全辅料中的平均回收率为 99%,RSD 为 0.97% (n= 12);在 pH5.5 磷酸盐缓冲液中,磷酸特地唑胺在空白全辅料中的平均回收率为 100%,RSD 为 0.42% (n= 12);在 pH6.8 磷酸盐缓冲液中,磷酸特地唑胺在空白全辅料中的平均回收率为 100%,RSD 为0.67% (n= 12);结果表明各 pH 条件下准确度良好。
2.4.12 工业化生产研究
为考察工艺的稳定性及放大后是否能顺利桥接,采用流化床制粒工艺进行了工业化生产,生产批次为 3 批,批量为 10 万片。以颗粒粉体学性质、颗粒混合均匀性以及成品关键质量属性(含量、含量均匀度、溶出度、有关物质、水分)为考察指标进行质量研究,考察工艺稳健性和重现性,同时考察工业化生产三批样品与原研制剂在三种不同 pH 介质的体外溶出行为比较(具体测定结果见表 5、表 6 和图 5)。

Table 5 Quality evaluation results of granules before tableting in three batches of industrial production表5 三批工业化生产批次压片前颗粒质量评价结果

Table 6 Quality evaluation results of three batches of finished products in industrial production表6 工业化生产三批次成品质量评价结果
压片前的颗粒粉体学性质测定结果显示,工业化生产三批样品在颗粒粒度分布、颗粒流动性及颗粒松密度等各方面均基本一致,三批样品的颗粒含量都在 (97~100)% 范围内;最终成品的含量都在 (99~100)% 范围内;有关物质也明显低于原研制剂。溶出结果显示,在 pH4.5、pH5.5 和pH6.8三种溶出介质中,三批样品均快速溶出,在 15 分钟内溶出量大于 85%,与原研制剂相似。
工业化生产结果表明,本品所采用的流化床制粒工艺具有很好的稳定性和重现性,且操作简单,可满足工业化生产。
Fig. 5 Dissolution profiles of three batches of samples from industrial production and reference product in different dissolution media图5 工业化生产三批次样品及参比制剂在不同溶出介质中的溶出
3 讨论
3.1 溶出介质的选择
有区分力的溶出介质用于评价自制制剂和参比制剂体外溶出的相似性,可以较大程度上提高生物等效性的成功概率,在制剂开发中具有非常重要的作用。在本课题前期研究过程中,考察了制剂产品在不同 pH 条件下的溶出情况。结果显示,该产品在 pH4.5 醋酸盐缓冲液、pH5.5 磷酸盐缓冲液和 pH6.8 磷酸盐缓冲液介质中溶出行为一致,均为快速溶出;在 0.1 mol·L-1盐酸和0.01 mol·L-1盐酸介质中几乎不溶出(累积溶出量 < 5%);在 0.01 mol·L-1盐酸介质中介入 2%十二烷基硫酸钠,60 min 累积溶出量也仅有 40%;在 0.01 mol·L-1盐酸介质中加入 2% 十二烷基硫酸钠,同时提高溶出仪桨板转速至 75 rpm,60 min 累积溶出量仍然低于 60%。最终确定选用 pH6.8 磷酸盐缓冲液作为溶出介质。前文溶出研究结果表明,在进行原料药粒度以及粘合剂加入方式考察时,选用 pH6.8 磷酸盐缓冲液具有较好的区分性。
3.2 粘合剂加入方式对溶出的影响
口服固体制剂常用的制粒工艺包括粉末直接混合、干法制粒、湿法制粒,其中湿法制粒制成的颗粒经过表面润湿,具有颗粒流动性好,压缩成型性好等优点,在制剂工业中应用最为广泛。常见的湿法制粒工艺包括高剪切湿法制粒和流化床制粒,其中高剪切湿法制粒工艺在口服固体制剂中的应用较多。但该种工艺对制粒时间、粘合剂用量、搅拌桨转速等较为敏感,这些参数的轻微改变都可能会对产品质量造成较大影响[8-9]。基于上述原因,流化床制粒工艺在制剂工业化生产中也逐渐得到了重视,Osborne 等[10]研究了流化床制粒工艺中粘合剂加入方法(内加和外加)对颗粒大小和粘合剂分布的影响,结果显示粘合剂外加方式相对粘合剂内加方式制得的颗粒粒度偏大。Kokubo 等[11]研究了流化床制粒工艺中工艺因素对颗粒性质的影响,结果显示粘合剂内加方式进行流化床制粒,对颗粒性质影响的主要工艺因素是制粒过程中的湿度。但上述文献均未研究对于口服固体制剂关键质量属性溶出的影响。本课题研究采用流化床制粒工艺筛选磷酸特地唑胺片的处方工艺,比较了粘合剂加入方式对颗粒性质以及片剂溶出的影响,结果显示粘合剂内加方式相对粘合剂外加方式制得的颗粒,颗粒密度更大,压片更加顺利,溶出更快。分析原因可能是粘合剂内加时,制粒时采用纯化水作为润湿剂,相对聚维酮 K30 水溶液粘度更小,颗粒固结性质偏低,颗粒粒度偏小,进而促使颗粒更容易吸水,片剂溶出更快。
本研究所选流化床制粒工艺操作简单,工艺稳定且重现性良好。三批放大生产样品质量评价结果进一步显示本研究生产工艺满足工业化生产要求,但其体内外相关性尚需进一步研究。
- 中国药剂学杂志(网络版)的其它文章
- 醋酸铜梯度法制备阿霉素脂质体
- SPH3261 微丸胶囊的工艺筛选
- 明胶胶囊交联机制与其检测方法的研究进展

