整联蛋白α5β1通过介导Gli1表达影响基底细胞癌的生长与放疗敏感性*
李锦意,黄小辉,范国雄
广东省惠州市第三人民医院皮肤科,广东惠州 516000
基底细胞癌(BCC)起源于表皮的最内层或毛囊外根鞘,属于源自基底细胞的常见恶性上皮肿瘤之一[1-2]。性别、年龄、紫外线辐射情况、吸烟史等都是BCC形成的影响因素[3]。BCC起病较为隐匿,因而易发生漏诊,其治疗后复发也极为常见。目前,药物和手术治疗BCC的效果欠佳[4]。放疗在手术耐受能力差且年龄较大的BCC患者中被广泛使用,然而,随着肿瘤细胞对放疗抵抗性的产生,需要增大照射剂量,但这一操作将会对正常组织造成严重损伤。整联蛋白又称为整合素,是一类黏附分子,属于异源二聚体跨膜糖蛋白,可介导细胞-细胞和细胞-细胞环境之间的相互作用,在多种类型的细胞中广泛表达,主要包括肿瘤细胞、内皮细胞、成纤维细胞和免疫细胞等[5]。整联蛋白α5β1作为整联蛋白家族的重要成员之一,由β1和α5亚基的二聚化形成,已知其在多种肿瘤中高表达,并参与调控肿瘤细胞生长、黏附、侵袭、迁移及肿瘤血管生成[6-7]。Gli家族锌指蛋白1(Gli1)是Hedgehog(Hh)信号通路远端的效应转录因子,Hh信号通路是多种生物学过程的重要介质,包括胚胎发生、成体组织稳态及肿瘤发生、发展。研究表明,Gli1的异常激活与多种恶性肿瘤的发生有关,例如乳腺癌、结肠癌、肝细胞癌及子宫内膜癌的发生等[8-9]。基于此,本研究检测了α5β1在BCC中的表达情况,并探究其对肿瘤细胞生长与放疗敏感性的影响及相关分子机制,旨在为以α5β1为靶点的BCC治疗提供实验依据。
1 资料与方法
1.1一般资料 选取2020年6月至2021年6月本院皮肤科门诊收治的32例BBC患者的皮肤BBC组织标本为研究对象,标本来源患者均经临床和病理检查确诊,其中男20例,女12例;年龄38~69岁,平均(51.40±5.16)岁。以同期32例行非肿瘤性皮瓣移植手术患者的正常皮肤组织标本作为对照。对照标本来源患者中男17例,女15例;年龄40~68岁,平均(54.35±5.32)岁。所有患者术前均未经放疗、光动力及其他手段治疗,并已排除合并其他类型肿瘤。所有患者对本研究知情同意,并签署知情同意书。
1.2仪器与试剂 A431细胞购于中国科学院基础医学研究所,Gli1抑制剂GANT61购于英国Abcam公司,胎牛血清、DMEM培养基和胰蛋白酶购于美国Gibco公司,免疫组织化学染色试剂盒购于江苏凯基生物有限公司,RNAiso Plus试剂盒、反转录试剂盒和实时荧光定量PCR试剂盒购于日本TaKaRa公司,二氨基联苯胺(DAB)显色试剂盒、4′,6-二脒基-2-苯基吲哚(DAPI)染料、二喹啉甲酸(BCA)蛋白测定试剂盒和增强化学发光法(ECL)发光液购于碧云天生物技术研究所,聚偏氟乙烯(PVDF)膜和Transwell小室购于美国BD公司,MTT试剂盒、5-乙炔基-2′-脱氧尿苷(EdU)细胞增殖检测试剂盒及Hoechst 33258细胞凋亡染色试剂盒购于上海贝博生物科技有限公司,AnnexinV-FITC/PI细胞凋亡检测试剂盒购于北京百奥莱博科技有限公司,兔抗α5β1多克隆抗体、兔抗Gli1多克隆抗体、鼠抗3-磷酸甘油醛脱氢酶(GAPDH)单克隆抗体及辣根过氧化物酶(HRP)标记二抗购于英国Abcam公司。重组慢病毒载体pLEX-MCS与pLEX-α5β1的构建、包装及滴度测定均由丰晖生物科技有限公司完成。其他实验试剂均为国产分析纯。BB150-2TCS型细胞培养箱购于美国Thermo Fisher Scientific公司,CX43型光学显微镜购于日本Olympus公司,C1Si型激光共聚焦显微镜购于日本Nikon公司,XSZ-220/20型X线深部治疗机购于丹东市康佳医用机厂,iMark型酶标仪购于美国Bio-Rad公司,DYY-16D型电泳系统购于北京六一仪器厂,FACSCanto Ⅱ型流式细胞仪购于美国BD公司。
1.3方法
1.3.1免疫组织化学染色 将皮肤BBC组织及正常皮肤组织标本在4%多聚甲醛中固定,石蜡包埋,制成4 μm厚的切片。切片脱蜡,加入柠檬酸缓冲液煮沸,在3%H2O2溶液中消除内源性过氧化物酶,山羊血清室温封闭。滴加兔抗α5β1多克隆抗体(1∶200),4 ℃孵育过夜。磷酸盐缓冲液(PBS)清洗,滴加HRP标记二抗(1∶1 000),室温孵育30 min,DAB显色,苏木素复染,反复冲洗,脱水透明,中性树胶封片,干燥。通过光学显微镜观察染色情况并摄取图片,α5β1阳性表达多呈棕黄色至棕褐色,随机选择5个视野,结果根据阳性细胞率与染色强度进行综合评定。阳性细胞率评分:<5%记0分,5%~25%记1分,>25%~50%记2分,>50%~75%记3分,>75%记4分。染色强度评分:未着色记0分,黄色记1分,棕黄色记2分,棕褐色记3分。两者分数相加<2分为阴性,≥2分为阳性。
1.3.2细胞培养与转染 取A431细胞随机分为对照A组、pLEX-MCS组、pLEX-α5β1组、pLEX-α5β1+Gli1抑制剂组。在各组A431细胞中添加含10%胎牛血清、1%青-链霉素的DMEM培养基,置于37 ℃、5%CO2培养箱中过夜培养。调整细胞水平为4×105/mL,取100 μL接种于6孔板,分别将含pLEX-MCS和pLEX-α5β1的慢病毒液加入对应组的细胞孔内进行转染,病毒转染复数(MOI)设为50∶1。pLEX-α5β1+Gli1抑制剂组细胞在转染时添加100 μmol/L Gli1抑制剂GANT61。转染培养4 h,收集细胞,换用新鲜培养液,添加1 mg/L嘌呤霉素进行筛选,获得稳定表达α5β1的A431细胞系。
1.3.3实时荧光定量PCR 采用RNAiso Plus试剂盒提取转染后的A431细胞总RNA,测定RNA纯度与浓度。将RNA反转录合成cDNA,以cDNA为模板,根据实时荧光定量PCR试剂盒说明书进行扩增,反应条件:95 ℃ 3 min,1个循环;95 ℃ 20 s,60 ℃ 15 s,72 ℃ 45 s,45个循环。以β-actin为内参基因,采用2-ΔΔCt法计算α5β1和Gli1的mRNA表达水平。α5β1上游引物:5′-CATCTTGGCATGCGCTCCA-3′,下游引物:5′-GTCTTGGTGAACTCGGCACT-3′;Gli1上游引物:5′-GGACAACCGCCATCCAGACT-3′,下游引物:5′-GCCAGGGACACCTCCA-3′;β-actin上游引物:5′-CTCGCTTCGGCAGCACA-3′,下游引物:5′-AAC GCTTCACGAATTTGCGT-3′。
1.3.4蛋白质免疫印迹法(Western blot) 收集转染后的A431细胞,使用RIPA裂解液提取细胞总蛋白,BCA法进行蛋白定量。制备10%十二烷基硫酸钠-聚丙烯酰胺凝胶,在梳孔加入标本,电泳分离蛋白,转膜、封闭,TBST缓冲液洗膜,加入一抗,4 ℃孵育过夜,次日TBST缓冲液再洗膜,加入二抗,室温孵育2 h,ECL发光液显色,凝胶成像系统扫描成像,采用Image-Pro Plus 6.0软件分析目的蛋白α5β1、Gli1蛋白表达水平。
1.3.5MTT法 收集转染后的A431细胞,每孔中加入20 μL MTT混匀,继续培养4 h,再加入200 μL二甲基亚砜(DMSO),摇床振荡至结晶物完全溶解,酶标仪检测490 nm处各孔的吸光度(A)值,计算各组细胞存活率=各组A值/对照孔A值×100%。
1.3.6EdU染色 收集转染后的A431细胞,调整水平后以1×105个/孔接种于24孔板,加入10 μmol/L EdU进行染色处理,PBS清洗,再用Apollo567避光孵育30 min,DAPI染料染核,洗涤后封片,干燥,通过激光共聚焦显微镜观察细胞染色情况并摄取图片,红色荧光为EdU阳性细胞的细胞核,随机选择5个视野,计数该视野下EdU阳性细胞数与总细胞数,两者比值为EdU阳性细胞率。
1.3.7Hoechst 33258染色 收集转染后的A431细胞,PBS清洗,4%多聚甲醛固定,加入200 μL Hoechst 33258染色液,室温避光孵育10 min,PBS再次清洗,滴加抗荧光猝灭剂封片,干燥,通过荧光显微镜观察各组细胞凋亡情况并摄取图片,细胞核呈蓝色,荧光浓染颗粒为凋亡细胞。
1.3.8Transwell实验 将Matrigel胶铺于24孔Transwell上室底部,置于37 ℃培养箱内凝胶。将转染后的A431细胞水平调整为2×104/mL,吸取200 μL移入Transwell上室,下室加入600 μL含10%胎牛血清的新鲜培养液,培养24 h后用4%多聚甲醛固定,0.1%结晶紫染色,PBS清洗,通过光学显微镜观察并拍摄图像,随机选择5个视野计数侵袭细胞数。细胞迁移检测时在Transwell上室不铺Matrigel胶,其余步骤均与上述步骤相同。
1.3.9细胞分组与放疗处理 取A431细胞随机分为对照B组、4 Gy组、pLEX-α5β1+4 Gy组。对照B组细胞正常培养,4 Gy组细胞进行4 Gy X射线照射,pLEX-α5β1+4 Gy组细胞进行转染pLEX-α5β1慢病毒处理后采用4 Gy X射线照射。将细胞按照5×104个/孔接种于6孔板,采用4 Gy X射线照射(6 mV射线垂直照射,剂量率为200 cGy/min,源皮距为100 cm)。在处理后培养24、48、72 h时采用MTT法检测各组细胞增殖活性A值。
1.3.10流式细胞术 收集经放疗处理后的A431细胞,PBS清洗,胰酶消化,离心后用PBS将沉淀重悬于100 μL染料结合缓冲液中,调整细胞水平为1×106/mL,取100 μL悬液移入干净离心管中,加入5 μL Annexin V-FITC和5 μL PI,涡旋混匀,室温避光静置20 min,随后立即通过流式细胞仪测定细胞凋亡情况。

2 结 果
2.1皮肤BBC组织及正常皮肤组织α5β1表达情况比较 相较于正常皮肤组织,皮肤BBC组织内有大量区域染色呈棕黄色至棕褐色,见图1;皮肤BBC组织α5β1阳性表达率为84.38%(27/32),明显高于正常皮肤组织的α5β1阳性表达率[12.50%(4/32)],差异有统计学意义(P<0.05)。
2.2各组A431细胞中α5β1与Gli1表达情况比较 与对照A组和pLEX-MCS组比较,pLEX-α5β1组细胞中α5β1 mRNA和蛋白表达水平均明显升高(P<0.05);pLEX-α5β1+Gli1抑制剂组α5β1 mRNA和蛋白表达水平与pLEX-α5β1组比较,差异无统计学意义(P>0.05),见图2A、2B。pLEX-α5β1组细胞中Gli1 mRNA和蛋白表达水平均明显高于对照A组和pLEX-MCS组(P<0.05);而与pLEX-α5β1组比较,pLEX-α5β1+Gli1抑制剂组Gli1 mRNA和蛋白表达水平均明显下降(P<0.05),见图2C、2D。
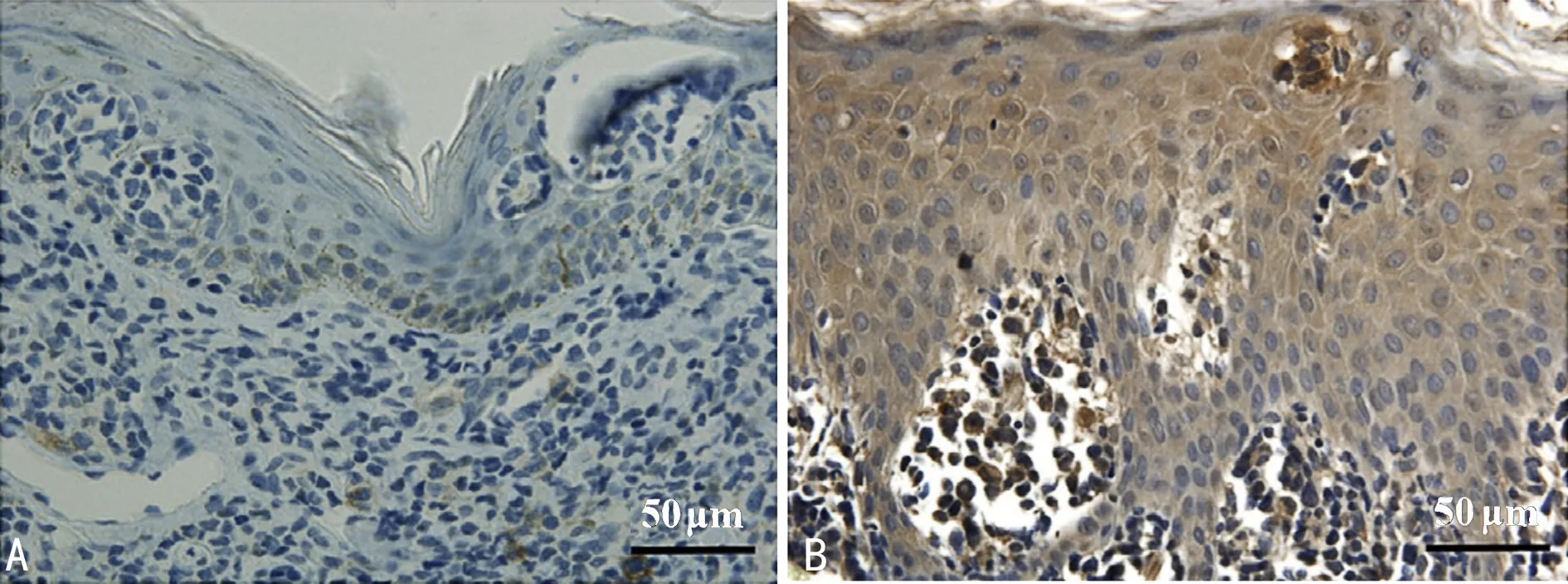
注:A为正常皮肤组织;B为皮肤BBC组织。图1 免疫组织化学染色检测皮肤BBC组织及正常皮肤组织中α5β1的表达(×200)

注:A为实时荧光定量PCR检测的各组A431细胞中α5β1 mRNA表达水平比较;B为Western blot检测的各组A431细胞中α5β1蛋白条带图及表达水平比较;C为实时荧光定量PCR检测的各组A431细胞中Gli1 mRNA表达水平比较;D为Western blot检测的各组A431细胞中Gli1蛋白条带图及表达水平比较;与对照A组比较,*P<0.05;与pLEX-MCS组比较,#P<0.05;与pLEX-α5β1组比较,△P<0.05。图2 各组A431细胞中α5β1与Gli1表达情况比较
2.3各组A431细胞增殖能力比较 MTT法检测结果显示,与对照A组和pLEX-MCS组比较,pLEX-α5β1组细胞存活率明显升高(P<0.05);与pLEX-α5β1组比较,pLEX-α5β1+Gli1抑制剂组细胞存活率明显降低(P<0.05),见图3A。EdU染色结果显示,与对照A组和pLEX-MCS组比较,pLEX-α5β1组EdU阳性细胞率明显升高(P<0.05);与pLEX-α5β1组比较,pLEX-α5β1+Gli1抑制剂组EdU阳性细胞率明显降低(P<0.05),见图3B、3C。
2.4各组A431细胞凋亡形态检测结果 Hoechst 33258染色结果显示,对照A组和pLEX-MCS组细胞内均出现较明显的细胞核浓缩,可见深色荧光浓染颗粒,偶见细胞核碎裂;而pLEX-α5β1组细胞内染色均匀,细胞核和细胞质未发生浓缩;相较于pLEX-α5β1组,pLEX-α5β1+Gli1抑制剂组有细胞发生细胞核浓缩现象,呈深色荧光浓染,见图4。
2.5各组A431细胞迁移与侵袭能力比较 Transwell实验结果显示,与对照A组和pLEX-MCS组比较,pLEX-α5β1组迁移细胞数与侵袭细胞数均明显增加(P<0.05);而相较于pLEX-α5β1组,pLEX-α5β1+Gli1抑制剂组迁移细胞数与侵袭细胞数均明显减少(P<0.05),见图5。
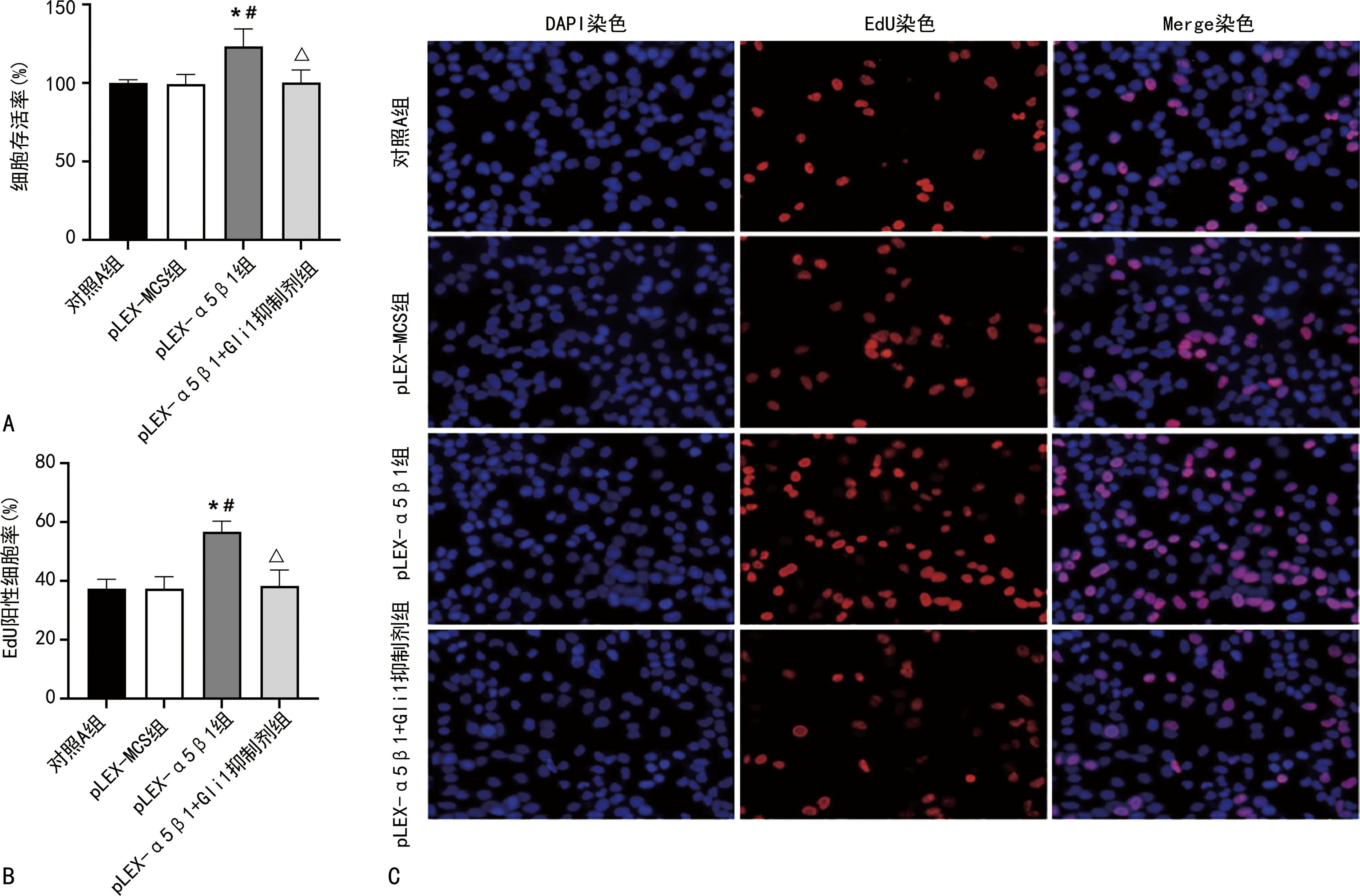
注:A为MTT法检测的各组A431细胞存活率比较;B为各组A431细胞中EdU阳性细胞率比较;C为EdU染色检测各组A431细胞增殖活性图(×100);与对照A组比较,*P<0.05;与pLEX-MCS组比较,#P<0.05;与pLEX-α5β1组比较,△P<0.05。图3 各组A431细胞增殖能力检测结果

图4 Hoechst 33258染色下各组A431细胞凋亡形态(×200)
2.6A431细胞对放疗的敏感性 MTT法检测各组A431细胞增殖活性变化,结果显示,在处理后培养24、48和72 h时,与对照B组比较,4 Gy组细胞增殖活性明显降低(P<0.05);而pLEX-α5β1+4 Gy组细胞增殖活性较4 Gy组明显升高(P<0.05),见表1。流式细胞术检测放疗处理后细胞凋亡情况,结果显示,4 Gy组细胞凋亡率较对照B组明显升高(P<0.05);pLEX-α5β1+4 Gy组细胞凋亡率较4 Gy组明显降低(P<0.05),见图6。

表1 不同培养时间各组A431细胞增殖活性A值比较

注:A为显微镜下各组迁移细胞与侵袭细胞图(×100);B为各组迁移细胞数比较;C为各组侵袭细胞数比较;与对照A组比较,*P<0.05;与pLEX-MCS组比较,#P<0.05;与pLEX-α5β1组比较,△P<0.05。图5 Transwell实验检测各组A431细胞的迁移与侵袭能力
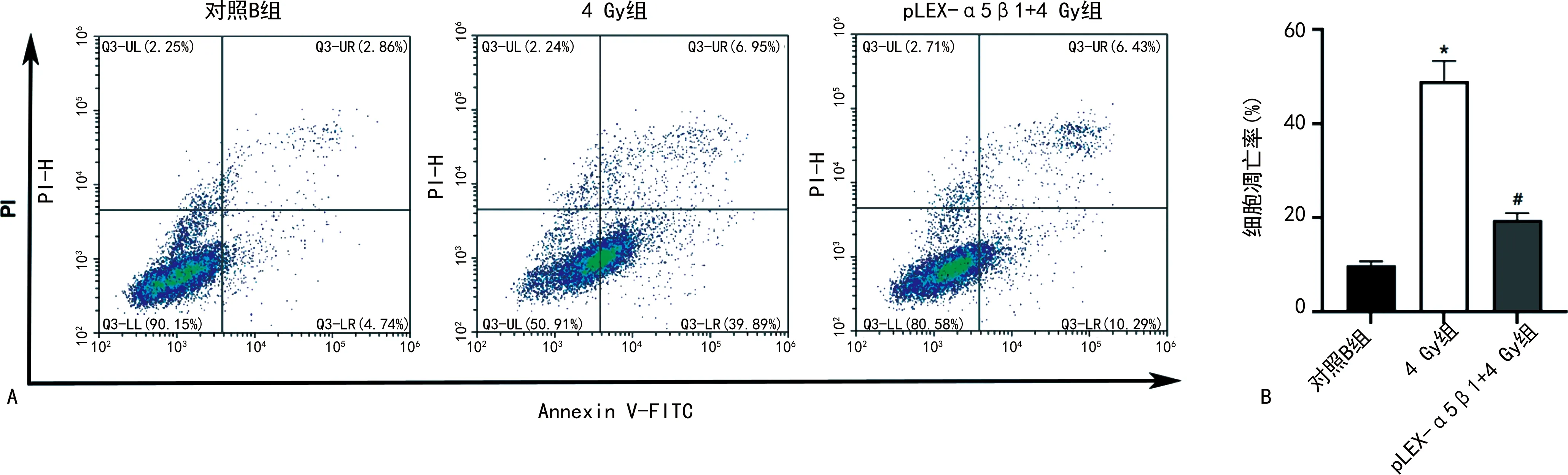
注:A为各组流式细胞术检测结果;B为各组细胞凋亡率比较;与对照B组比较,*P<0.05;与4 Gy组比较,#P<0.05。图6 流式细胞术检测各组A431细胞凋亡情况
3 讨 论
据报道,全球BCC的发病率在不断增加,我国约70%的皮肤肿瘤为BCC[2]。BCC的治疗方式可分为局部治疗和全身治疗,其中局部治疗包括手术治疗、冷冻疗法、激光及药物治疗等,全身治疗包括使用化疗药物维莫德吉、索尼德吉等在内的方法。此外,光动力治疗和基因治疗目前也被应用到BCC的临床治疗中或已开展了大量的实验研究[10]。虽然大多数早期BCC属于低度恶性肿瘤,只发生局部病变且易于治疗,但晚期BCC的治疗方法仍然十分有限。目前,晚期BCC(包括转移性BCC和局部难治性BCC)治疗难度大,治疗后5年复发率达20%,且患者预后不佳。因此,进一步探索BCC的发病机制及与其发生相关的潜在生物标志物,并以此来寻找BCC治疗的新型方案,是目前临床研究的热点及重点。
整联蛋白由两个亚基组成,其中α亚基相对分子质量为(120~170)×103,β亚基相对分子质量为(90~100)×103。人体内共有18个α亚基和8个β亚基,可以组装成至少24种具有不同结合特性、组织分布和生物学功能的αβ整联蛋白异二聚体,来充当组织和器官特异性配体的受体。在这24种整联蛋白亚型中,已发现多种亚型与肿瘤血管生成,肿瘤细胞增殖、迁移及侵袭有关,并参与调控肿瘤细胞对化疗和放疗的敏感性[6,11]。α5β1是唯一已知的α5整联蛋白,作为跨膜蛋白其具有不同的结构域,包括决定α5β1多种功能的细胞外结构域、跨膜结构域和细胞质结构域。细胞外和跨膜结构域负责与细胞外基质蛋白或其他细胞外配体结合,并有助于后续相关信号通路的功能发挥,而细胞质结构域可以与细胞骨架相关蛋白相互作用以影响细胞迁移、侵袭和增殖。已有报道指出,α5β1与癌细胞的失巢凋亡抗性或药物抗性有关[12-13];此外,α5β1还与骨组织形成的维持和致动脉粥样硬化炎症的发生有关[14-15]。α5β1的多种功能表明其表达失调可能导致包括癌症在内的多种疾病,目前研究已证实α5β1过表达可促进一些肿瘤的生长与转移,如MITRA等[16]研究表明,纤连蛋白与α5β1的结合导致了α5整联蛋白与c-Met直接结合(c-Met位于Src和FAK的上游),α5β1通过该作用激活c-Met/FAK/Src依赖性信号通路,从而促进卵巢癌细胞的侵袭和转移;MOROZEVICH等[17]研究发现,在MCF-7人乳腺癌细胞中,α5β1的高表达通过增强丝氨酸/苏氨酸蛋白激酶(AKT)、雷帕霉素靶蛋白(mTOR)和细胞外调节蛋白激酶1/2(ERK1/2)的活性来促进乳腺癌细胞侵袭及对多柔比星的抗性。本研究中,α5β1在皮肤BCC组织中异常表达,皮肤BBC组织α5β1阳性表达率明显高于正常皮肤组织(P<0.05),进一步通过体外实验发现,A431细胞过表达α5β1后,细胞的增殖、迁移与侵袭能力均提高,并抑制了细胞凋亡的发生。
放疗抵抗是肿瘤复发的主要原因之一,细胞与细胞外基质成分的黏附性是肿瘤化疗与放疗反应性的决定因素。目前,已有关于α5β1作为介导肿瘤放疗敏感性的重要调节因子的报道,如DAMIANO等[18]在研究中指出,α5β1可促进K562慢性粒细胞白血病细胞与纤连蛋白结合,这种结合作用对化疗药物和γ辐射诱导的细胞凋亡均表现出一定的抵抗力;SHABANA等[19]研究表明,α5β1在胶质母细胞瘤中过表达,PR_b是一种特异性靶向α5β1的纤连蛋白模拟肽,而含微小RNA(miR)-603的PR_b修饰的脂质体复合物能够明显增强胶质母细胞瘤干细胞对电离辐射的敏感性,这意味着α5β1的高表达可能影响了肿瘤细胞对放疗的敏感性。本研究结果显示,α5β1在A431细胞中高表达降低了细胞对4 Gy X射线照射的敏感性,因此,靶向α5β1可能是提高肿瘤细胞放疗敏感性的有效方法之一。
α5β1作为细胞表面受体发挥作用,能够激活导致肿瘤发生及进展的关键信号通路。以往研究表明,Hh信号通路可能与BCC的进展有关,也是BCC发病机制启动的关键通路,Hh信号通路的异常激活导致驱动BCC发生的靶基因的组成型激活,其中包括Gli1[20-21]。BRENNAN-CRISPI等[22]报道指出,在痣样基底细胞癌小鼠模型中桥粒钙黏蛋白2(Dsg2)过表达,以自分泌和旁分泌方式诱导转录激活因子3(Stat3)磷酸化并增加Gli1的表达水平,从而促进痣样基底细胞癌发展。在本研究中,A431细胞高表达α5β1后其细胞内Gli1 mRNA、蛋白的表达水平也明显升高。GANT61是一种可渗透细胞的六氢嘧啶化合物,是Gli介导的基因反式激活的抑制剂,其已被证明在肿瘤细胞中具有抑制细胞生长和抗肿瘤干细胞活性的作用[23]。本研究使用Gli1抑制剂GANT61进行处理后,A431细胞增殖、迁移与侵袭能力均显著下降,由此推测,α5β1促进BCC细胞生长的生物学作用可能与其介导的Gli1表达水平升高相关。
综上所述,α5β1在BCC中异常高表达,其高表达可提高BCC细胞增殖活性,促进BCC细胞的迁移与侵袭,并降低其对放疗的敏感性,该作用可能是通过介导Gli1表达来实现的。因此,以整联蛋白α5β1为靶点治疗BCC可能是一种潜在策略,但α5β1是否通过转录后水平直接调控Gli1的表达,有待后续进行相关研究证实。

