血清α1-MG和NGAL在狼疮肾炎早期诊断中的临床价值
马 珍,杨朝美
重庆市第四人民医院/重庆市急救医疗中心:1.感染与疾病预防控制科;2.检验科,重庆 400014
系统性红斑狼疮(SLE)是一种自身免疫介导的多器官、系统损害的结缔组织病,肾脏是其损伤的主要靶器官之一,部分SLE患者早期或病程中可出现狼疮肾炎(LN)。SLE患者LN的发病率为50%~70%,LN是SLE患者死亡的常见原因[1]。LN是最常见的继发性肾小球肾炎,如能早期发现并采取积极的治疗措施,将有助于LN患者肾功能的恢复[2]。中性粒细胞明胶酶相关载脂蛋白(NGAL)是脂质运载蛋白家族成员之一,主要表达于中性粒细胞、巨噬细胞、脂肪细胞,由肾脏代谢。有研究表明,在肾损伤的早期,血、尿NGAL水平开始升高,因此NGAL在预测肾损伤方面具有较高的特异度和灵敏度[3]。血清α1-微球蛋白(α1-MG)是肝细胞和淋巴细胞产生的一种糖蛋白,其水平可反映肾小球滤过功能,并可早期诊断肾损伤[4]。本研究通过分析LN患者血清α1-MG、NGAL水平变化,探讨其对LN的早期诊断价值,以助于临床早期发现LN并积极采取治疗措施改善SLE患者的预后。
1 资料与方法
1.1一般资料 选取2019年3月至2021年4月本院收治的LN患者102例作为LN组,其中男11例,女91例;年龄20~52岁,平均(32.27±7.11)岁。另选择同期本院健康体检者114例作为对照组,其中男13例,女101例;年龄22~54岁,平均(31.71±7.26)岁。LN组与对照组性别、年龄比较,差异无统计学意义(P>0.05),具有可比性。
1.2纳入及排除标准 纳入标准:(1)SLE诊断符合2019年欧洲抗风湿病联盟更新的《系统性红斑狼疮管理指南》标准[5];(2)LN诊断符合《中国狼疮肾炎诊断和治疗指南》标准[6],在SLE基础上出现以下1项及以上临床和实验室检查异常时,即可诊断为LN,①尿蛋白持续>0.5 g/24 h,或随机尿蛋白+++,或尿蛋白肌酐比值>50 mg/mmol;②活动性尿沉渣(除尿路感染外,尿白细胞>5个/高倍镜视野,尿红细胞>5个/高倍镜视野),或红细胞管型,或白细胞管型;③细胞管型包括红细胞管型、颗粒管型、血红蛋白管型、管状管型或混合管型;④肾穿刺活检病理结果为免疫复合物介导的肾小球肾炎;(3)临床资料完整。排除标准:(1)合并其他自身免疫性疾病;(2)合并原发性肾小球疾病或其他继发性肾脏病;(3)合并高血压、糖尿病、肿瘤;(4)合并血液系统疾病;(5)合并泌尿系统感染等其他影响肾功能的炎症性疾病;(6)哺乳期或妊娠期女性。
1.3仪器与试剂 贝克曼AU5821全自动生化分析仪购自美国贝克曼库尔特公司;血清尿素(Urea)、肌酐(Cr)、尿酸(UA)、胱抑素C(Cys C)检测试剂由宁波瑞源生物科技有限公司提供;α1-MG、NGAL检测试剂由四川新健康成生物股份有限公司提供。
1.4方法 对所有研究对象抽取清晨空腹静脉血3~4 mL,采血管为促凝管,3 000 r/min离心5 min,取血清检测Urea、Cr、UA、Cys C、α1-MG、NGAL水平。

2 结 果
2.1两组血清α1-MG、NGAL、Urea、Cr、UA、Cys C水平比较 LN组血清α1-MG、NGAL、Urea、Cr、Cys C水平与对照组比较,差异有统计学意义(P<0.05);两组血清UA水平比较,差异无统计学意义(P>0.05),见表1。

表1 两组血清α1-MG、NGAL、Urea、Cr、UA、β2-MG、Cys C水平比较[M(P25,P75)]

组别nCysC(μmol/L)α1-MG(mg/L)NGAL(ng/mL)LN组1021.31(0.88,3.56)38.90(32.70,59.15)269.70(218.00,421.25)对照组1140.79(0.69,0.87)17.10(14.90,18.70)135.20(111.50,185.60)Z-4.492-4.343-4.590P<0.001<0.001<0.001
2.2LN发生的影响因素分析 将表1中两组比较差异有统计学意义的指标纳入多因素Logistic回归分析模型,结果显示,血清α1-MG、NGAL水平升高是LN发生的独立危险因素(P<0.05),见表2。
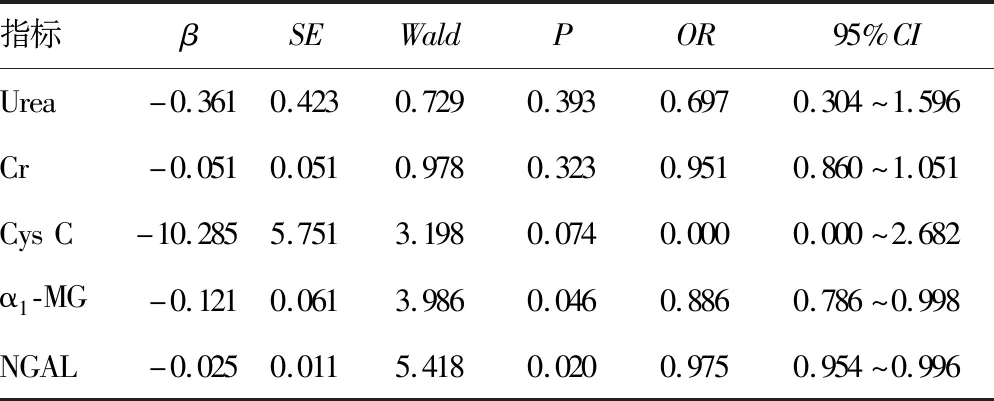
表2 LN发生的多因素Logistic回归分析结果
2.3LN患者血清α1-MG和NGAL水平的相关性分析 Pearson相关分析结果显示,LN患者血清α1-MG、NGAL水平呈正相关(r=0.749,P<0.05)。
2.4血清α1-MG、NGAL对LN的诊断效能 ROC曲线分析结果显示,α1-MG诊断LN的曲线下面积(AUC)为0.723,灵敏度为64.7%,特异度为93.0%。NGAL诊断LN的AUC为0.814,灵敏度为73.5%,特异度为86.0%。两项联合检测的AUC为0.842,灵敏度为73.5%,特异度为86.3%。见表3、图1。
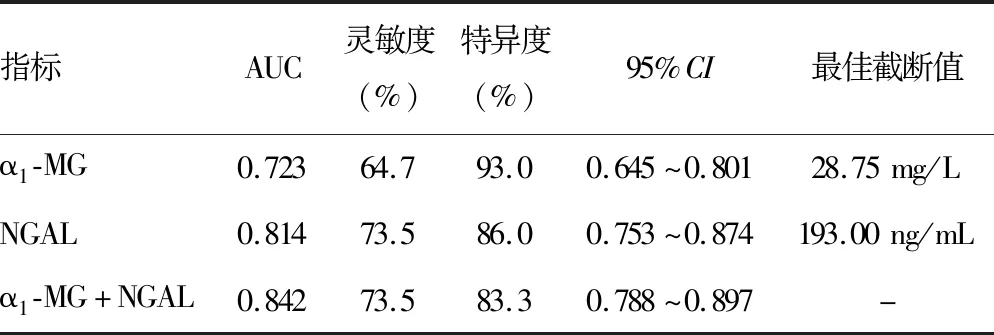
表3 血清α1-MG、NGAL诊断LN的效能

图1 血清α1-MG、NGAL诊断LN的ROC曲线
3 讨 论
LN主要由循环或原位免疫复合物沉积导致肾小球固有细胞增生、基底膜破坏和炎症细胞浸润所致,是最常见的继发性免疫性肾小球疾病[7]。相关文献显示,有75%~90%的SLE患者伴有不同程度的肾损伤,其中有21%左右可进展为尿毒症[8]。肾穿刺活检是明确LN病理类型的“金标准”,但侵入性操作难度大、风险高,患者难以接受,不利于密切跟踪LN进展情况。探讨引起LN的危险因素,寻找灵敏度高、特异性强、非侵入性、便于监测的新型生物标志物,对LN早期诊断、临床治疗效果评估等具有重要意义。
近年来,实验室早期诊断肾损伤的新型生物标志物越来越多[9]。NGAL是一种相对分子质量为25×103的小分子分泌蛋白,其mRNA可在人体中的很多组织和器官中表达,当肝脏、肾脏的上皮细胞受到损伤时会释放核转录因子(NF)-κB诱导NGAL产生并进入血液。有研究发现,在正常生理状态下,在肾组织中NGAL几乎不表达,且肾脏的滤过清除作用可以使血液中的NGAL水平保持相对稳定[10-11],但是肾脏在发生缺血性损伤或肾毒性药物损伤后,血清及尿液中NGAL水平可明显升高,在肾损伤发生2 h达高峰,其水平变化早于Urea、Cr等生物标志物,能更早地预测肾损伤[12]。NGAL在血液和尿液中的水平变化可早期反映肾小球滤过功能有无损伤,其临床价值已在多种类型肾损伤的临床研究中得到证实,被认为是研究最广泛的肾损伤早期诊断生物标志物之一[13-14]。相关研究表明,血清及尿NGAL水平与LN肾损伤指数有关,在活动性LN中其水平显著升高,提示NGAL在早期诊断LN、预测LN的发生方面具有潜在价值[15]。α1-MG主要是由淋巴细胞和肝脏恒定产生的一种糖蛋白,能自由通过肾小球滤过膜,绝大部分在肾近曲小管被重吸收并代谢,当肾脏重吸收功能障碍或肾近曲小管受损时,血清α1-MG水平快速升高,可作为早期肾损伤的一个特异性标志物,同时α1-MG既有不易受实验检测因素干扰的优势,又可反映肾脏基底膜通透性及肾小球滤过膜损伤程度[16]。
本研究结果显示,LN组血清Urea、Cr、Cys C、α1-MG、NGAL水平与对照组比较,差异有统计学意义(P<0.05),提示上述指标在LN患者中表达水平异常,可能可作为LN的诊断标志物,但其中部分指标受食物、药物等外源性因素影响较大,用于LN早期诊断的价值有限。如早期肾损伤时,血清Cr、Urea水平往往要在24~72 h后才缓慢升高;血清Cys C 水平尽管与性别、种族、肌肉质量和水合状态无关,但可能受甲状腺功能障碍、吸烟、炎症、某些癌症和糖皮质激素的影响,在肾小球病变早期其诊断灵敏度低于NGAL[17]。UA是嘌呤代谢的终末产物,其由受损细胞产生,可促进免疫炎症反应,受内外源性因素干扰较大,有关研究报道,不同程度肾损伤的SLE患者血清UA水平差异明显,较高的血清UA水平会增加SLE患者发生肾损伤的风险,合并高尿酸血症的SLE患者常伴有严重的肾损伤[18]。本研究中,LN组血清UA水平与对照组比较,差异无统计学意义(P>0.05),提示血清UA作为LN诊断指标的效果可能并不理想。
本研究中,多因素Logistic回归分析结果显示,血清α1-MG、NGAL水平升高是LN发生的独立危险因素(P<0.05),此外,LN患者血清α1-MG与NGAL水平呈正相关(P<0.05)。有研究证实,在糖尿病肾病中血清NGAL和α1-MG水平也存在高度相关性,二者对辅助诊断早期肾损伤有重要价值[11,16,19]。ROC曲线分析结果显示,血清α1-MG、NGAL联合检测对LN有较高的诊断效能,优于各指标单独检测。
综上所述,血清NGAL和α1-MG水平升高是LN发生的独立危险因素,且二者对LN的诊断价值较高,可作为早期诊断LN的有效生物标志物。但由于本研究为单中心研究,结果可能存在一定偏倚,结果有待后续多中心、大样本量的临床研究进一步证实。

