BRAFV600E基因突变、促甲状腺激素和甲状腺球蛋白预测甲状腺结节恶变的临床价值
赵利超,周艳红,毛小芳,张威,曹在新
甲状腺疾病在内分泌系统疾病中发病率较高,近年,随着大众健康意识的提高,甲状腺结节的检出率也有所增加[1]。在非碘缺乏地区的人群中,甲状腺结节的发病率为5%,其中半数以上是在超声检查中发现,此部分患者甲状腺癌的发生率为7%~15%[2]。细针穿刺活检(fine needle aspiration biopsy,FNAB)是术前评估甲状腺结节性质最常用的诊断技术,由于检测技术的差异导致部分患者出现假阴性或假阳性[3]。为避免不合理的手术决定,寻找有效的术前诊断标志物具有重要的临床价值。
研究显示,甲状腺球蛋白(thyroglobulin,Tg)水平是分化良好的甲状腺癌复发的有用标志物[4]。然而,在甲状腺恶性结节的术前检查中,Tg作为甲状腺恶性肿瘤的预测指标仍存在争议。甲状腺结节患者术前促甲状腺激素(thyroid stimulating hormone,TSH)水平的增加与分化型甲状腺癌的风险呈正相关[5],与甲状腺癌的进展以及颈部淋巴结转移之间存在相关性[6];但也有研究表明,高TSH水平与甲状腺恶性肿瘤之间无相关性[7]。BRAFV600E基因突变对甲状腺乳头状癌具有较高的阳性预测价值,但在甲状腺结节中,是否可以预测结节恶变,目前尚无明确结论。本研究检测甲状腺结节患者Tg和TSH的水平,以及BRAFV600E基因的突变情况,分析三者预测甲状腺结节发生恶变的临床价值。
1 对象与方法
1.1 对象 连续性收集2019年10月—2021年10月在笔者医院接受手术治疗的甲状腺结节患者184例,男性49例,女性135例,年龄(48.6±11.3)岁(32~58岁)。传统开放性甲状腺手术65例,腔镜辅助下甲状腺手术119例。根据病理检测结果,恶性结节组132例,其中多结节性甲状腺肿95例,孤立性甲状腺结节29例,有毒甲状腺肿8例;良性结节组52例,其中多结节性甲状腺肿40例,孤立性甲状腺结节11例,有毒甲状腺肿1例。甲状腺结节穿刺病理结果见图1。纳入标准:(1)符合甲状腺结节的切除指征[8];(2)术后经病理组织学确诊,且为首次确诊;(3)入院前未接受放化疗及免疫治疗;(4)临床资料完整。排除标准:(1)合并其他肿瘤;(2)既往有甲状腺手术史;(3)合并肝炎、肺炎和肺结核等急性或慢性疾病;(4)合并免疫系统或血液系统疾病;(5)失访者。所有患者均接受甲状腺次全切或双侧全切手术,甲状腺恶性结节组患者术后行131I和TSH抑制剂治疗。

A:恶性甲状腺结节;B:良性甲状腺结节。
1.2 方法
1.2.1 收集资料 记录患者入院时的基本信息,包括性别、年龄、体质量指数(body mass index,BMI)和病理组织确诊的甲状腺组织类型。
1.2.2 测量TSH 收集患者清晨空腹血5 mL于离心管中,倾斜50° 放置于4 ℃冰箱中静置1 h,然后于低速离心机中以3 000 r/min的速度离心5 min。将上层血清吸入新的离心管中,置于-80 ℃冰箱中保存。待样品收集完毕后,使用电化学发光免疫分析仪(CAL 2200i,深圳迈瑞公司)检测患者外周血清中的TSH和Tg水平。
1.2.3 检测BRAFV600E基因突变 将甲状腺结节切除术中获取的新鲜组织置于含0.9% NaCl的离心管中,送实验室检测。提取组织中的DNA,经紫外分光光度计检测DNA浓度,采用BRAFV600E基因突变检测试剂盒(厦门艾德生物医药公司)检测DNA中BRAFV600E基因突变的情况。将突变信号Ct值≥28设为阴性,<28为阳性。

2 结 果
2.1 两组间BRAFV600E基因突变阳性、Tg和TSH水平的比较 恶性结节组BRAFV600E基因突变阳性患者的比例、Tg和TSH水平均高于良性结节组,组间比较差别均具有统计学意义(P<0.05,表1)。
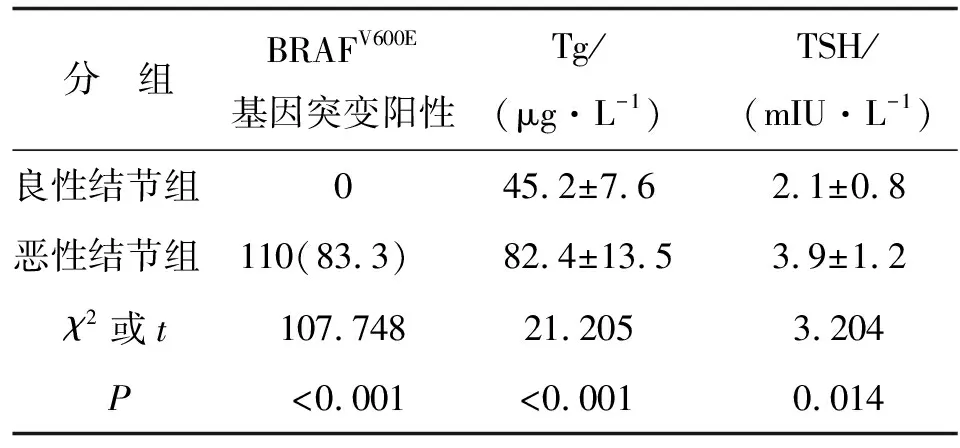
表1 两组间BRAFV600E基因突变阳性、Tg和TSH水平的比较
2.2 恶性结节组BRAFV600E基因突变、TSH和Tg水平对临床病理特征的影响 BRAFV600E基因突变阳性与肿瘤直径、淋巴结转移、病灶数量和TNM分期有关(P<0.05),TSH和Tg水平与淋巴结转移和TNM分期有关(P<0.05,表2)。
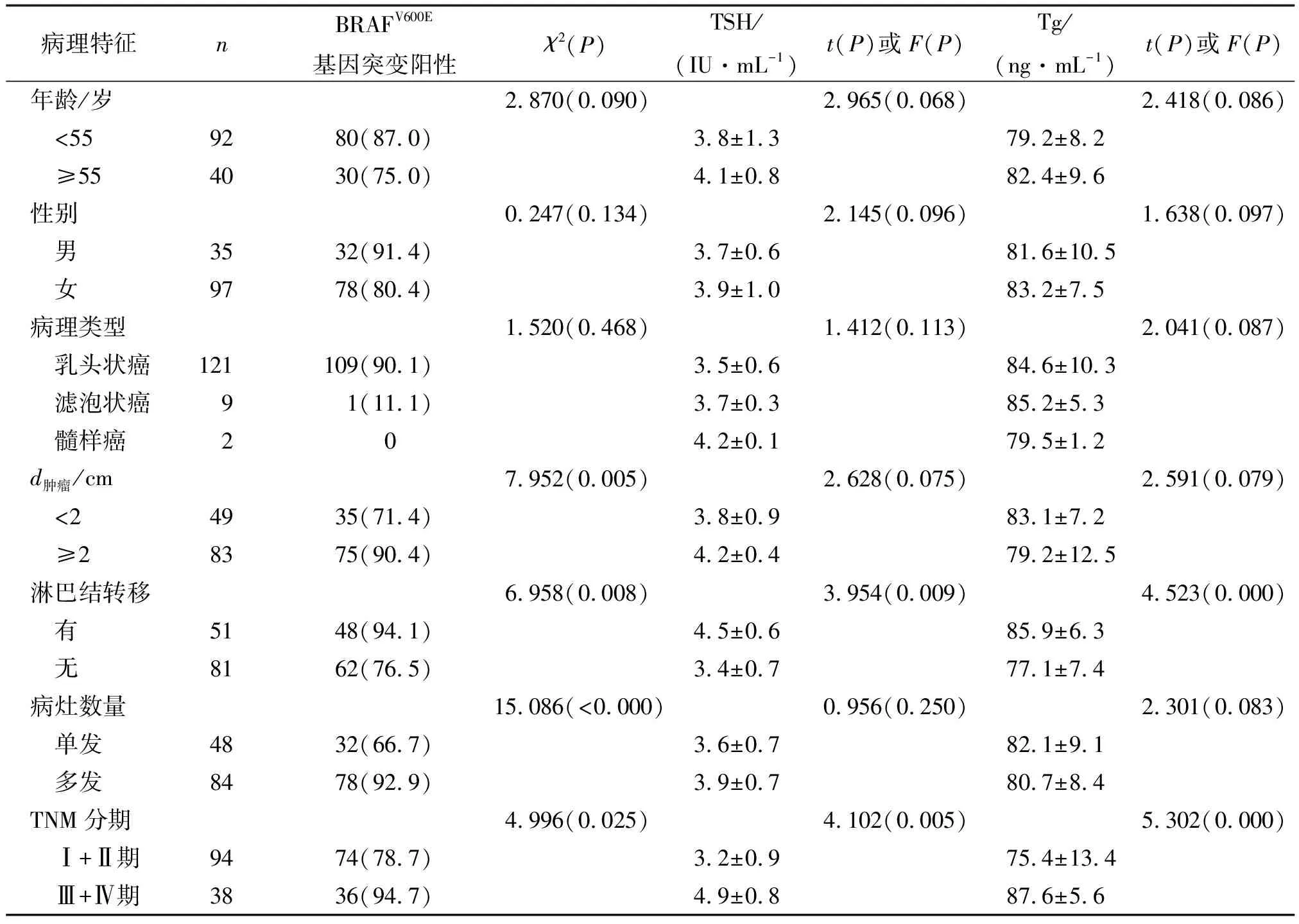
表2 恶性结节组BRAFV600E基因突变、TSH和Tg水平对临床病理特征的影响
2.3 影响甲状腺恶性结节的危险因素分析 自变量赋值:年龄(<55岁为0,≥55岁为1)、性别(女性为0,男性为1)、病理类型(髓样癌为0,滤泡状癌为1,乳头状癌为2)、肿瘤直径(<2 cm为0,≥2 cm为1)、淋巴结转移(无转移为0,有转移为1)、病灶数量(单发为0,多发为1)、TNM分期(Ⅰ+Ⅱ期为0,Ⅲ+Ⅳ期为1)、BRAFV600E基因突变(阴性为0,阳性为1)。因变量赋值:甲状腺结节(恶性为0,良性为1)。经logistic单因素和多因素回归分析显示肿瘤直径≥2 cm、淋巴结转移、TNM分期Ⅲ+Ⅳ期、BRAFV600E基因突变阳性、TSH水平升高和Tg水平升高均为影响甲状腺恶性结节的危险因素(表3)。
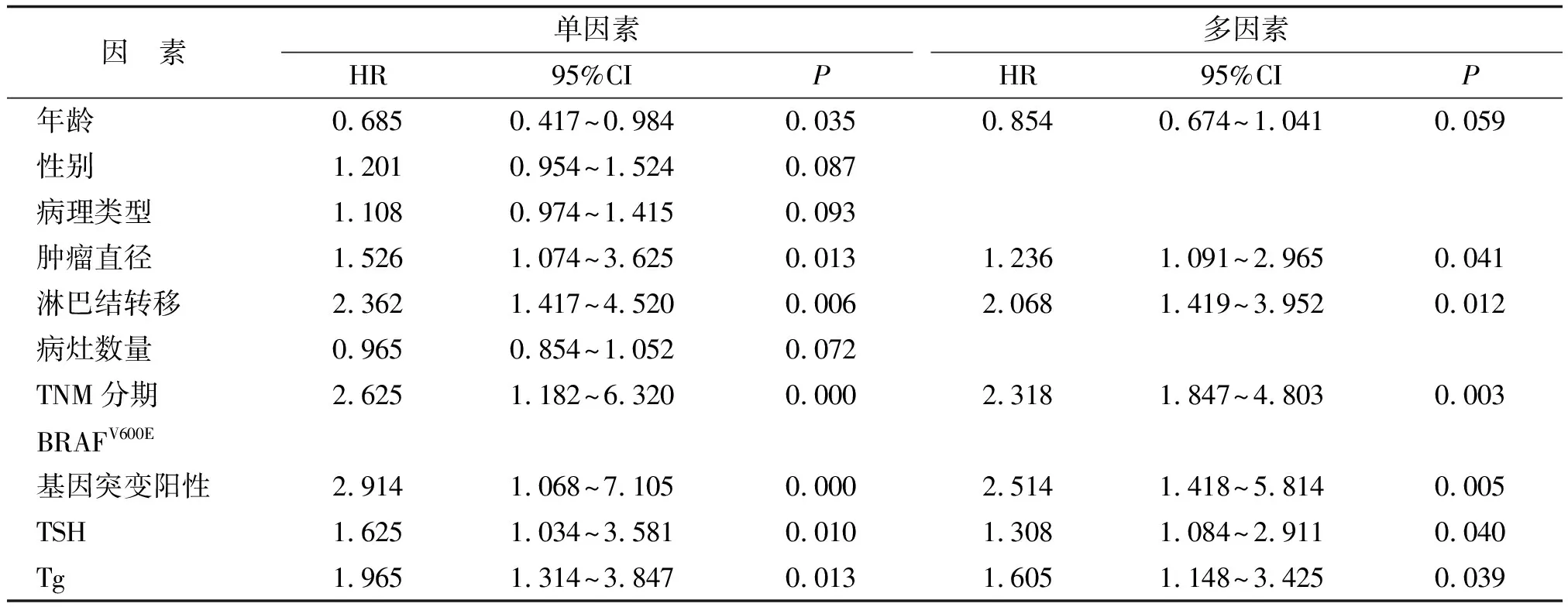
表3 影响甲状腺恶性结节的危险因素分析
2.4 BRAFV600E基因突变、TSH和Tg水平预测甲状腺恶性结节的临床价值 三者联合检测预测甲状腺恶性结节的曲线下面积为0.932,高于BRAFV600E基因突变、TSH和Tg(0.835、0.754和0.752)3个指标单独检测(Z=3.521、4.514、4.326;P=0.014、0.006、0.009),见图2和表4。
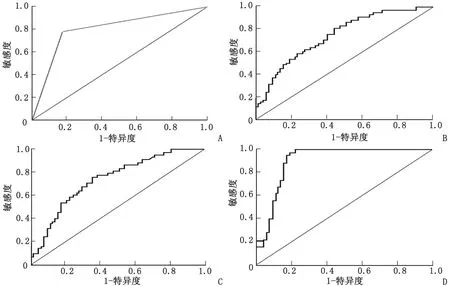
Tg:甲状腺球蛋白;TSH:促甲状腺激素。A:BRAFV600E基因突变;B:TSH;C:Tg;D:三者联合检测。
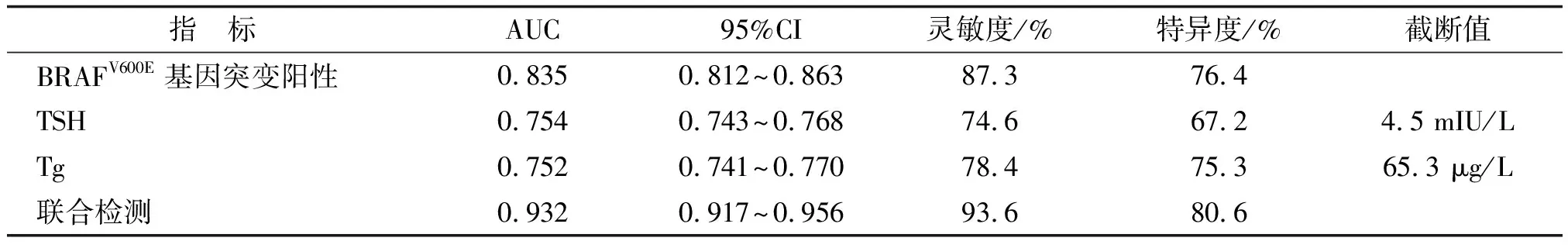
表4 BRAFV600E基因突变、TSH和Tg预测甲状腺恶性结节的ROC曲线特征
3 讨 论
甲状腺结节是临床上的常见病,超声检查为首选的影像学检查方法,超声引导下的FNAB在甲状腺恶性结节的诊断中使用最为广泛,但因FNAB诊断的敏感性低而出现不确定性的诊断结果。鉴于FNAB检测的局限性,临床上已采用其他潜在的预测因素来检测甲状腺结节的恶性风险,特别是分子标记物,例如FNAB标本中的BRAF突变,有望成为预测甲状腺癌的有效标记物[9]。既往研究表明,在不确定的FNAB细胞学检查中,检测Tg水平有助于甲状腺恶性结节的诊断[10]。但迄今为止,尚无法证明Tg和TSH水平可足够准确地用于甲状腺癌的筛查[11]。研究表明,TSH/Tg升高是甲状腺癌的危险因素,其与恶性肿瘤的相关性高于TSH[12]。
Tg作为甲状腺滤泡上皮细胞分泌的特异性蛋白,不仅见于正常甲状腺的滤泡细胞,甲状腺肿瘤也可分泌。免疫测定法并不能区分正常甲状腺组织分泌的Tg和恶性甲状腺肿瘤分泌的Tg,这可能是Tg不能单独用于诊断甲状腺良恶性结节的原因[13]。另外,某些甲状腺良性病变,如自身免疫性甲状腺炎、亚急性甲状腺炎、甲状腺腺瘤和结节性甲状腺肿,均可能导致甲状腺滤泡被破坏,从而导致血清Tg水平增高[14]。部分研究也表明,术前Tg对区分恶性结节和良性肿瘤并无价值[15]。因此,各个指南均未建议在诊断甲状腺结节时检测外周血清Tg水平。而另一些研究则指出,Tg水平在术前具有预测甲状腺恶性肿瘤的潜力[16]。本研究中,术前Tg水平与甲状腺恶性结节患者的淋巴结转移和TNM分期有关,且对甲状腺恶性结节具有一定的预测价值。目前的研究已明确,对行甲状腺全切或近全切以及131I消融治疗后的甲状腺恶性结节患者进行Tg定量检测,在监测甲状腺恶性结节复发和转移的风险中具有重要的作用[17-18]。
TSH是另一种流行的生物标志物,被认为是分化型甲状腺恶性结节的预测因子[19]。研究表明,血清TSH水平升高对甲状腺结节中发生恶性肿瘤的风险是否有预测价值,尚无定论[20]。一项包括5 000 多例甲状腺癌患者的荟萃分析显示,TSH水平升高者患甲状腺癌的风险比未升高者高两倍[6]。指南还强调,较高的血清TSH水平与甲状腺结节恶性肿瘤的发生风险有关[17]。因较易获取、检测速度快且成本低,目前,术前血清标志物(Tg、TSH和甲状腺抗体)在诊断甲状腺恶性结节的相关研究中已较为多见。然而,这些标志物在区分恶性肿瘤和良性结节方面的临床价值还有待进一步研究。本研究显示,恶性结节组TSH高于良性结节组,且与患者的淋巴结转移和TNM分期有关,提示TSH水平较高的患者,患恶性结节的可能性较大。
研究显示,对于伴有可疑超声征象的甲状腺结节,FANB联合BRAFV600E基因突变检测,有助于提高甲状腺结节诊疗的准确性,筛查甲状腺恶性结节具有较高的临床价值[21-22]。本研究中,良性结节中并未检测到BRAFV600E基因突变,恶性结节中检测到的突变率为83.3%。BRAFV600E基因突变与肿瘤直径、淋巴结转移、病灶数量和TNM分期有关,说明BRAFV600E基因突变可促进甲状腺恶性结节的进展。多因素回归分析显示,BRAFV600E基因突变为影响甲状腺恶性结节的危险因素,故认为BRAFV600E基因突变检测在鉴定甲状腺良恶性结节中具有一定的临床价值。本研究结果显示,BRAFV600E基因突变与Tg和TSH三者联合检测可显著增加诊断甲状腺恶性结节的临床价值。
综上所述,甲状腺恶性结节外周血中Tg、TSH水平增加和BRAFV600E基因突变影响甲状腺恶性结节临床病理特征,为甲状腺恶性结节发生的危险因素,三者联合检测可提高诊断甲状腺恶性结节的临床价值。

