CMTM6和PD-L1蛋白在乳腺癌组织中的表达及其对临床病理特征和预后的影响
马晓艳,刘姗姗,李轩飞,王卫杰
乳腺癌是女性最常见的恶性肿瘤,也是全球女性癌症死亡的主要原因。尽管局部手术、常规化疗、精准放疗、内分泌治疗和单克隆抗体的应用对乳腺癌患者的预后有显著的益处,但仍有大量患者面临复发和死亡的威胁。乳腺癌的预后预测与临床分期、病理类型和分子特征有关[1-2]。因此,识别新的预后标志物对降低复发率和死亡率有一定帮助。
程序性死亡[蛋白]配体-1(programmed deathligand-1,PD-L1)是程序性死亡[蛋白]1(programmed death-1,PD-1)受体的配体,PD-L1与PD-1的结合可导致肿瘤免疫逃逸[3-4]。迄今为止,阻断PD-1和PD-L1之间相互作用的免疫检查点抑制剂已被用于治疗多种类型的转移性癌症[5-6]。在原发性乳腺癌中,PD-L1的表达具有异质性,并且与更高的组织学分级和更具侵袭性的分子亚型相关[7]。最近,趋化因子样Marvel跨膜结构域6(chemokine-like factor-like Marvel transmembrane domain-containing family member 6,CMTM6)被确定为PD-L1蛋白表达的关键调节因子,参与调节肿瘤免疫应答[8-9]。CMTM6的功能障碍会抑制PD-L1在许多类型肿瘤中的表达[10-12]。研究表明,引发免疫反应并加强免疫监视的治疗靶标在肿瘤治疗中具有潜在价值[13]。然而,CMTM6在乳腺癌中的作用仍不清楚。本研究通过收集乳腺癌组织,采用免疫组织化学方法检测乳腺癌组织中CMTM6和PD-L1表达,并分析与患者临床病理特征和预后的影响,探讨CMTM6与PD-L1可能的关系以及是否有望成为预测乳腺癌预后的生物标记物。
1 对象与方法
1.1 对象 收集2017年6月—2019年1月接受乳腺癌根治术的原发性乳腺癌患者88例,年龄(52.3±10.4)岁(29~62岁)。纳入标准:(1)组织病理学确诊为乳腺癌;(2)术前未接受放化疗;(3)首次确诊为乳腺癌。排除标准:(1)合并其他肿瘤;(2)预计生存期低于6个月;(3)合并严重肝肾功能障碍;(4)远处转移及特殊类型的乳腺癌,如炎性肉瘤、乳腺癌、黏液癌、微乳头状癌、小管癌、髓样癌等。本研究经医院伦理委员会批准,患者均知情同意。
1.2 方法
1.2.1 主要试剂 兔抗人CMTM6单克隆抗体(编号:90329)、兔抗人PD-L1单克隆抗体(编号:86463)、辣根过氧化物酶标记的鼠抗兔单克隆抗体(编号:5127)均购于美国CST公司。免疫组织化学试剂盒和DAB显色试剂盒(北京中杉金桥生物技术有限公司)。莱卡光学显微镜(DM500,德国莱卡相机有限公司)。
1.2.2 免疫组织化学检测乳腺癌组织CMTM6和PD-L1的表达 收集患者的乳腺癌组织及癌旁组织标本,进行石蜡包埋,制成4 μm厚度的病理切片。经脱蜡和梯度乙醇水化后,加抗原修复液,放置微波炉中,98 ℃ 20 min,然后自然冷却和水洗。经封闭后,滴加anti-CMTM6或anti-PD-L1抗体(1∶200),置于4 ℃冰箱孵育过夜。PBS冲洗,滴加相应种属二抗(1∶400),室温下孵育60 min,PBS冲洗3遍。滴加新鲜配制的显色液,苏木精复染,中性树胶封固,置于显微镜下观察。
结果判定:由两位病理科医师在双盲条件下进行判读,每张切片随机选择5个高倍视野在光学显微镜下观察。CMTM6和PD-L1均表达于细胞膜上。染色强度:无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。染色细胞所占百分比:阴性为0分,阳性数≤10%为1分,10%<阳性数≤50%为2分,50%<阳性数≤75%为3分,>75%为 4分。染色强度与阳性细胞百分比的乘积按照 12分阳性等级:0分为阴性(-),1~4分为弱阳性(+),5~8分为阳性(++),9~12 分为强阳性(+++)。
1.2.3 术后随访 以电话和来院复查的方式进行随访,以手术时间为随访起点,以患者死亡或随访时间结束为随访终点,随访时间最短8个月,最长36个月。
1.2.4 观察指标 比较乳腺癌组织和癌旁组织中CMTM6和PD-L1表达的差异,并分析其对乳腺癌临床病理参数的影响。比较CMTM6和PD-L1不同表达组间术后3 a生存率,分析影响患者预后的危险因素,以及CMTM6阳性、PD-L1阳性和CMTM6、PD-L1双阳性对预后不良的预测价值。

2 结 果
2.1 CMTM6和PD-L1在乳腺癌组织和癌旁组织中的表达 CMTM6在乳腺癌组织中的阳性表达率为51.1%(45/88),高于癌旁组织的6.8%(6/88)(χ2=41.992,P<0.001)。PD-L1在乳腺癌组织中的阳性表达率为70.5%(62/88),高于癌旁组织的9.1%(8/88)(χ2=69.167,P<0.001,图1,表1)。
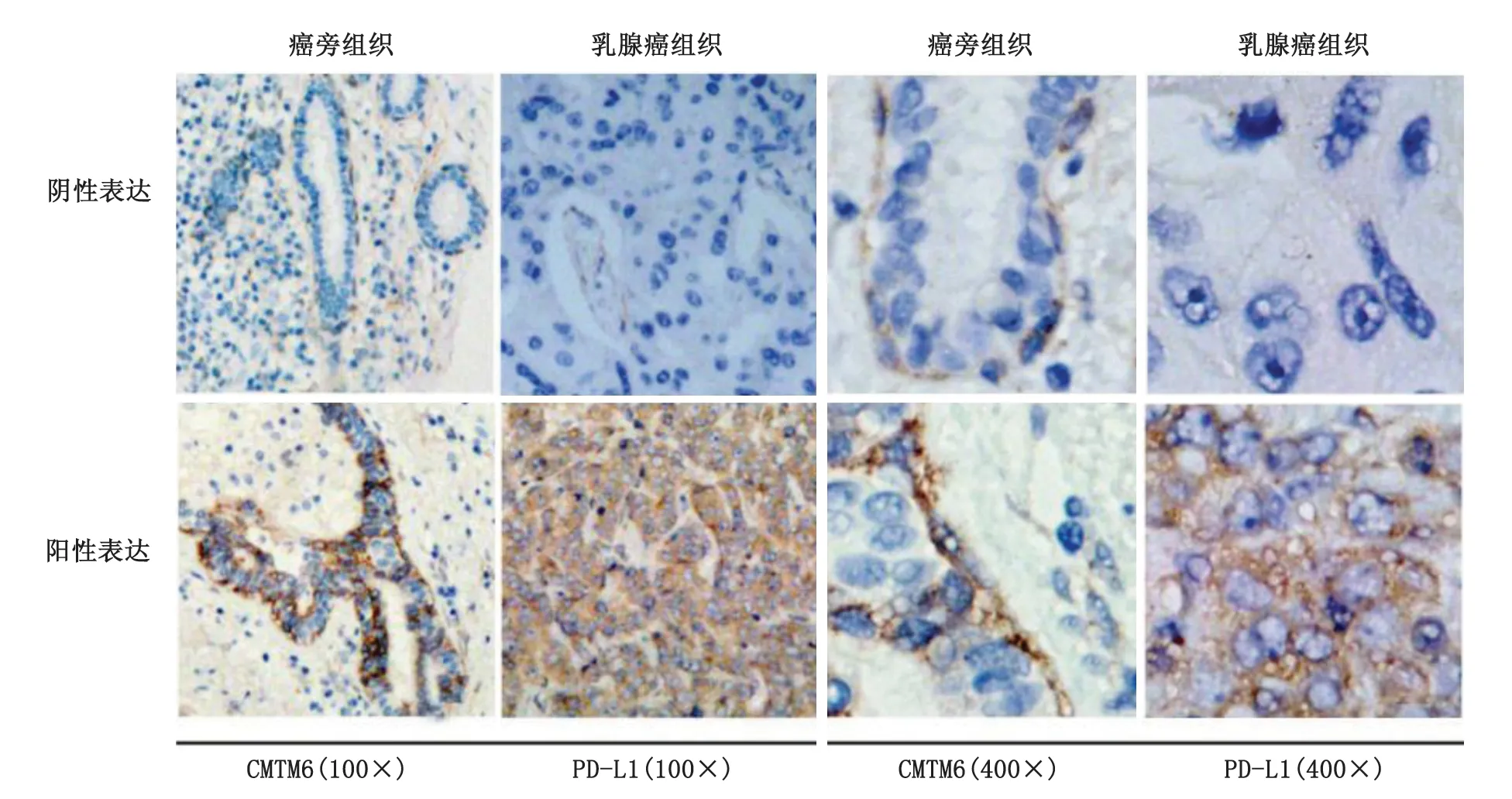
图1 CMTM6和PD-L1在乳腺癌组织和癌旁组织中的表达
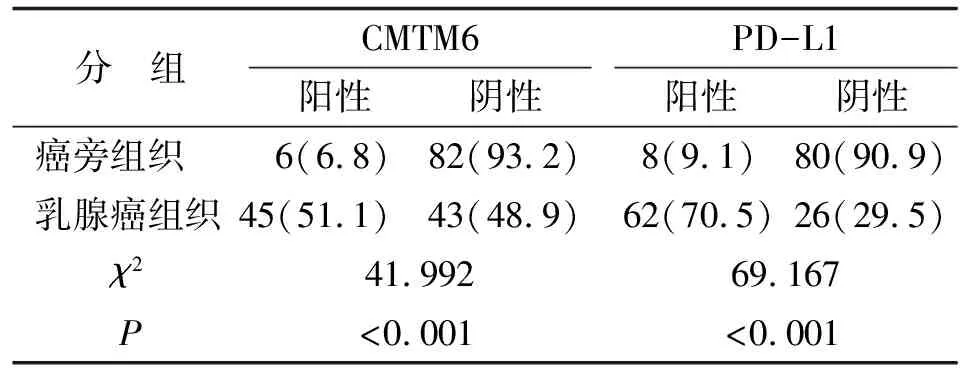
表1 CMTM6和PD-L1在乳腺癌组织和癌旁组织中的阳性表达率比较
2.2 乳腺癌中CMTM6和PD-L1阳性表达对患者临床病理特征的影响 CMTM6阳性表达和PD-L1阳性表达与乳腺癌的分子分型、组织分化程度、TNM分期、淋巴结转移、脉管侵犯有关。在分子分型中,三阴性乳腺癌的CMTM6和PD-L1阳性表达率均高于Luminal A型和Luminal B型(表2)。
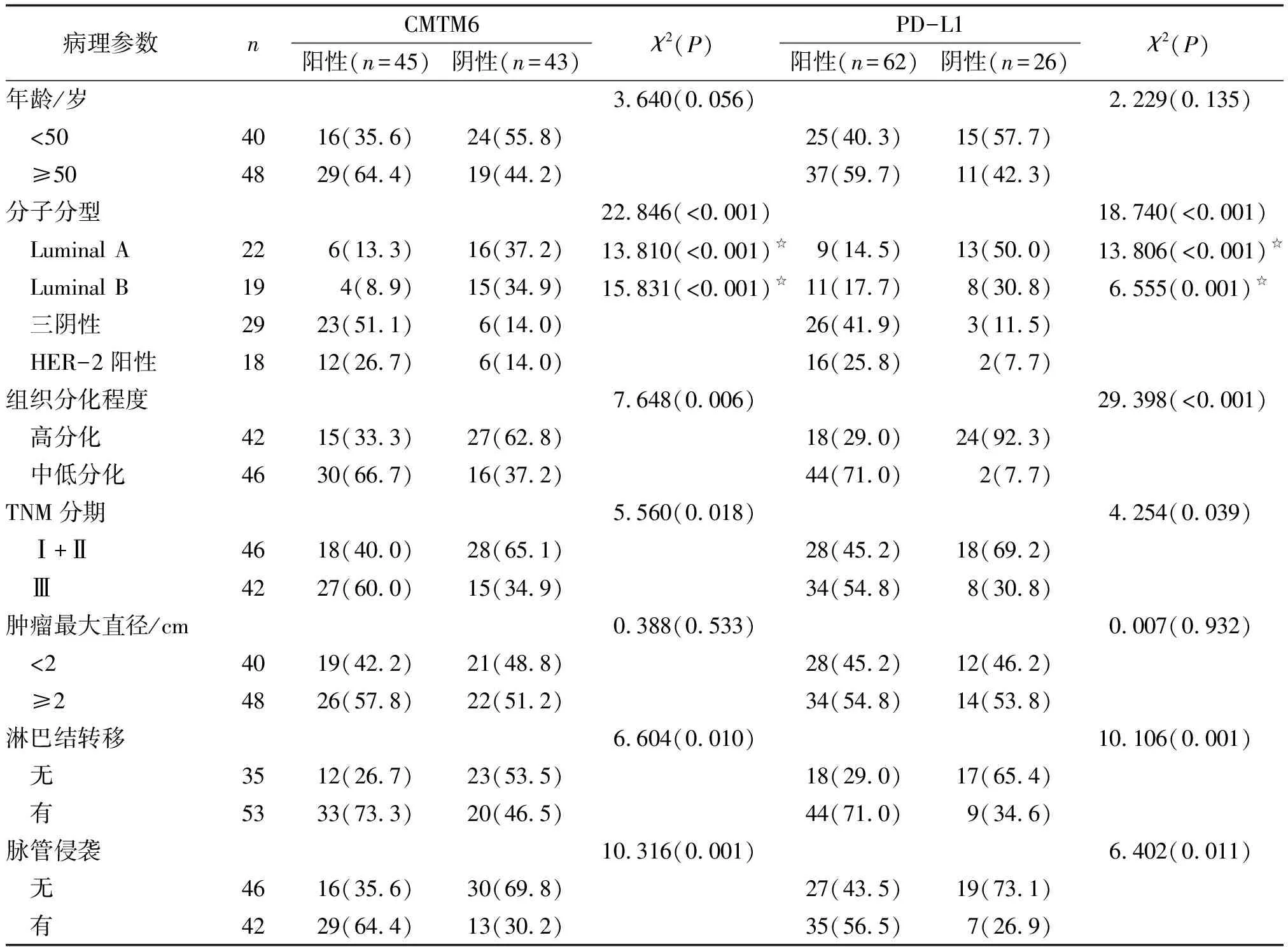
表2 乳腺癌中CMTM6和PD-L1阳性表达对患者临床病理特征的影响
2.3 CMTM6和PD-L1不同表达组间术后3 a生存率的比较 CMTM6阳性组术后3 a生存率为55.6%(25/45),低于CMTM6阴性组的88.4%(38/43)(χ2=11.643,P=0.001)。PD-L1阳性组术后3 a生存率为62.9%(39/62),低于PD-L1阴性组的92.3%(24/26)(χ2=7.787,P=0.005)。CMTM6、PD-L1双阳性组、单阳性组和双阴性组的生存率分别为39.3%(11/28)、86.3%(44/51)和88.9%(8/9),组间比较差别有统计学意义(χ2=21.098,P<0.001),其中CMTM6、PD-L1双阳性组的生存率最低(图2)。
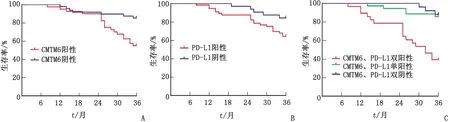
A:CMTM6阳性与阴性患者比较;B:PD-L1阳性与阴性患者比较;C:CMTM6、PD-L1双阳性、单阳性和双阴性患者比较。
2.4 影响乳腺癌患者术后3 a生存率的危险因素分析 赋值如下:年龄(<50岁为0,≥50岁为1)、分子分型(Luminal A型为0,Luminal B型为1,三阴性为2,HER-2阳性为3)、组织分化程度(高分化为0,中低分化为1)、TNM分期(Ⅰ+Ⅱ期为0,Ⅲ期为1)、肿瘤最大直径(<2 cm为0,≥2 cm为1)、淋巴结转移(无为0,有为1)、脉管侵袭(无为0,有为1)、CMTM6(阴性为0,阳性为1)、PD-L1(阴性为0,阳性为1)、CMTM6和PD-L1(双阴性为0,单阳性为1,双阳性为2)。经Cox单因素回归分析显示,三阴性乳腺癌、组织分化程度、TNM分期、脉管侵犯、CMTM6阳性、PD-L1阳性和CMTM6、PD-L1双阳性为乳腺癌患者术后3 a生存率的影响因素。以上因素经Cox多因素回归分析显示,三阴性乳腺癌、中低分化程度、TNM分期Ⅲ期、CMTM6阳性、PD-L1阳性和CMTM6、PD-L1双阳性为影响乳腺癌患者术后3 a生存率的独立危险因素(表3)。
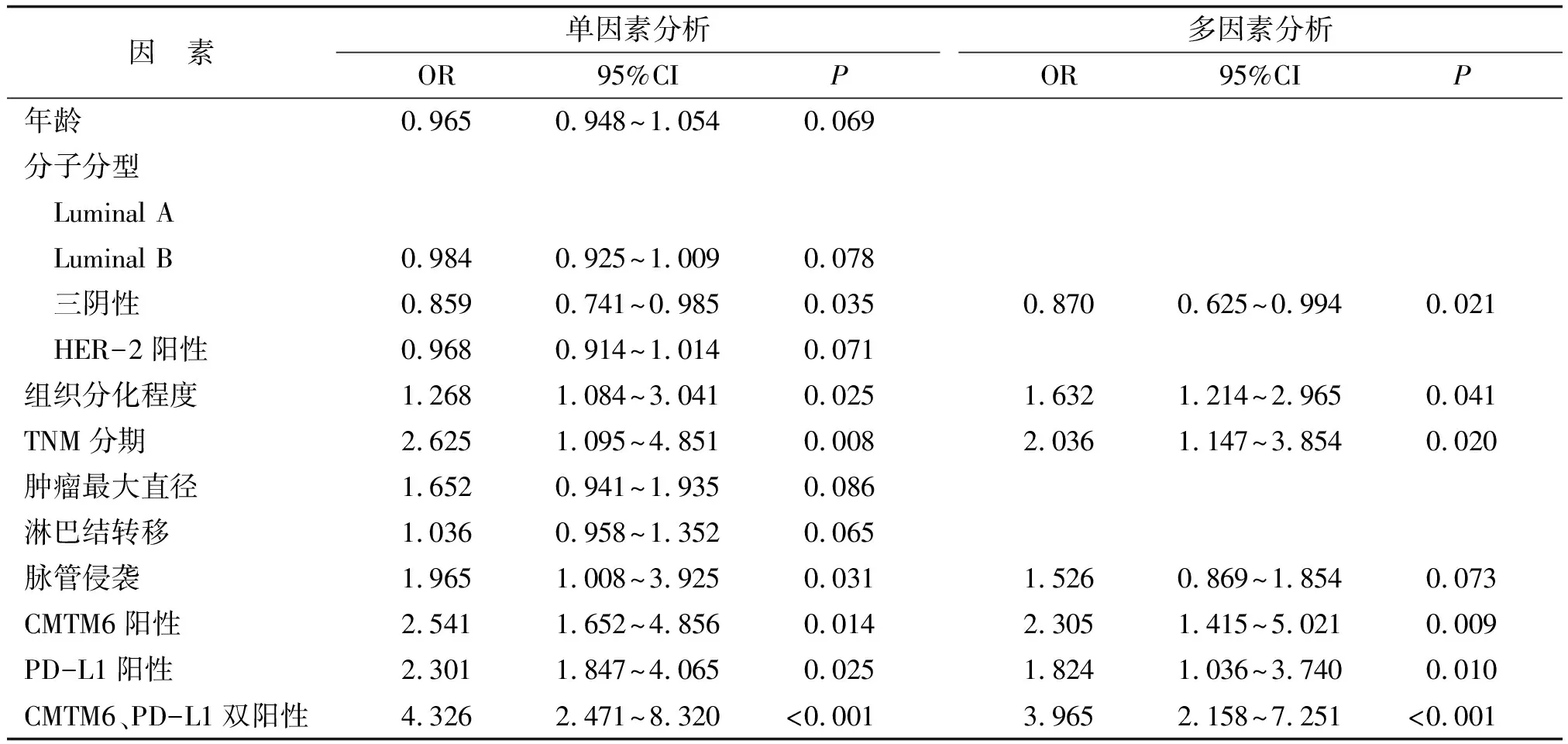
表3 影响乳腺癌患者术后3 a生存率的危险因素分析
2.5 CMTM6阳性、PD-L1阳性和 CMTM6、PD-L1 双阳性对乳腺癌术后3 a死亡的预测 CMTM6(+)PD-L1(-)预测乳腺癌术后3 a死亡的曲线下面积为0.815,95%CI为0.824~0.836,敏感度为0.783,特异度为0.765。CMTM6(-)PD-L1(+)预测乳腺癌术后3 a死亡的曲线下面积为0.754,95%CI为0.740~0.769,敏感度为0.694,特异度为0.713。CMTM6(+)PD-L1(+)预测乳腺癌术后3 a死亡的曲线下面积为0.956,95%CI为0.947~0.968,敏感度为0.915,特异度为0.803,临床价值高于CMTM6(+)PD-L1(-)和CMTM6(-)PD-L1(+)(Z=3.215、4.521,P=0.024、0.006,图3)。
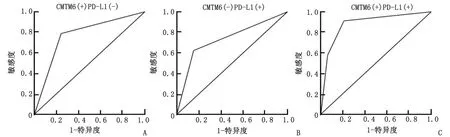
图3 CMTM6(+)PD-L1(-)、CMTM6(-)PD-L1(+)和CMTM6(+)PD-L1(+)对乳腺癌术后3 a死亡的预测价值
3 讨 论
乳腺癌是全球女性中第二大流行的癌症,手术切除联合辅助治疗是乳腺癌最有效的治愈性方法,由于复发和远处转移造成的不良预后,仍需进一步的了解。部分乳腺癌患者可通过阻断PD-1和PD-L1 之间的相互作用来抑制T细胞免疫反应而受益[14-15]。然而部分患者对PD-1/PD-L1抑制剂没有反应,部分初始有反应的患者随着时间的推移会产生耐药性[16]。PD-L1在肿瘤细胞或肿瘤浸润免疫细胞上的表达,不能准确预测患者对PD-1/PD-L1抑制剂的反应。因此,对PD-L1表达的分子调控认识是有限的。目前多项研究显示,CMTM6对PD-L1 有调节作用,但CMTM6在乳腺癌中的表达水平及对患者预后的影响尚不明确。
CMTM6促进肿瘤细胞中PD-L1的表达以防御T细胞的杀伤作用,相比之下,CMTM6的消耗可缓解T细胞免疫抑制作用[17]。此外,据报道头颈部鳞状细胞癌中CMTM6升高与预后不良相关[18],并且是肾透明细胞癌的潜在治疗靶点[19]。CMTM6和PD-L1双阳性表达可作为肺癌的预后和治疗指标[11,20]。本研究中,乳腺癌组织中CMTM6和PD-L1 的阳性表达率高于癌旁组织,且两者的阳性表达与乳腺癌的恶性及侵袭性相关,例如中低分化的肿瘤组织、TNM分期Ⅲ期及淋巴结转移和脉管侵犯。一项包含619例肝细胞癌的队列研究显示,CMTM6表达升高经常伴随更严重的恶性现象,例如TNM分期晚期、血管侵犯等[20]。本研究结果与此研究结果相一致。此外,本研究还显示,三阴性乳腺癌中CMTM6阳性表达率和PD-L1阳性表达率明显高于Luminal A型和Luminal B型乳腺癌,提示其可能与患者的不良预后相关。
CMTM6和PD-L1双阳性表达组患者术后3 a生存率仅为39.3%,提示双阳性表达是乳腺癌患者预后不良因素。LIU等[20]研究显示,CMTM6和PD-L1的共表达为巨大肝细胞癌预后不良的预测因子。在非小细胞肺癌的免疫组织化学和mRNA表达数据中,CMTM6表达与PD-L1呈正相关[11-12]。阻止CMTM6与PD-L1结合可能会恢复现有的免疫抑制反应,并有希望成为免疫治疗的一个靶点。在肺癌的基质细胞中,CMTM6和PD-L1共表达的患者行免疫治疗后与非免疫治疗者相比具有更长的总生存期[9]。经受试者工作曲线显示,CMTM6和PD-L1双阳性对乳腺癌术后3 a不良预后的预测价值高于单阳性组,提示CMTM6和PD-L1之间可能存在某种关系,共同促进乳腺癌的恶性进展。研究显示,CMTM6维持PD-L1细胞表面表达的稳定性,并在PD-L1的存活中起关键作用[18]。CMTM6不是PD-L1成熟所必需的,而是与PD-L1共定位于质膜和循环内体中,可以防止PD-L1成为溶酶体介导的降解的目标[17]。因此,降低CMTM6水平对PD-L1抑制剂的抗乳腺癌治疗应该有一定的帮助。
综上所述,CMTM6和PD-L1在乳腺癌中的阳性表达率增加,影响乳腺癌患者术后3 a的生存率,双阳性对乳腺癌患者术后预后不良具有较强的临床预测价值。CMTM6靶向治疗有望成为增强PD-L1抑制剂抗肿瘤的方案之一。

