以心脏损害为主要表现的法布雷病1例报道
陈斌,郑荔娴,郑妮冰,胡星星,许鑫,林皓平
法布雷病(Fabry disease,FD)是一种X染色体连锁的罕见遗传性溶酶体贮积病,由α-半乳糖苷酶A(α-galactosidase A,α-GLA)基因变异导致α-半乳糖苷酶活性部分或完全缺乏,造成代谢底物三己糖酰基鞘脂醇(globotriaosylceramide-3, GL-3)及其衍生物脱乙酰基GL-3(Lyso-GL-3)在不同组织和器官的细胞内大量堆积,出现皮肤、周围神经、肾脏、脑、眼、胃肠道及心血管等多器官系统的损害。其中,心脏受累的特征表现为进行性心肌肥厚、心肌纤维化、心律失常和心力衰竭,称为Fabry心肌病,具有心脏猝死的潜在风险[1]。现将笔者医院收治的1例以心脏损害为主要表现的FD报道如下。
1 病例介绍
患者,男性,54岁,因“反复胸闷痛14 a”就诊。缘于入院前14 a开始出现胸骨后闷痛,无放射至他处,无伴有出汗、濒死感等,症状多于活动或劳累后出现,每次持续数分钟至几十分钟不等,休息或含服“麝香保心丸”后可改善。6 a前开始多次就诊笔者医院,查肌酐、M蛋白、血尿轻链、血沉、自身抗体、尿蛋白阴性,肌钙蛋白0.03~1.35 ng/mL(正常值<0.01),N末端前体脑利钠肽(N-terminal pro-B-type natriuretic peptide, NT-proBNP)为852.5~1 602 pg/mL。心电图示窦性心律,左心室肥大,ST段压低、T波双向、深倒置(I、AVL、Ⅱ、Ⅲ、AVF、V3-6)(图1A);心脏彩色超声(彩超)提示室间隔及左心室各壁增厚,以心尖部尤为明显(2.19~2.21 cm);左心房扩大伴二尖瓣反流+;主动脉瓣反流+;左心室舒张功能减退。冠状动脉(冠脉)造影示左主干粗,前降支近段开口狭窄20%,前降支中段多发狭窄20%;回旋支近段多发狭窄20%,第一钝缘支开口狭窄25%;右冠脉中段近端狭窄20%,其余部分及分支未见明显狭窄。诊断:“肥厚型心肌病、冠脉粥样硬化、高血压病”,口服“阿司匹林、氯吡格雷、瑞舒伐他汀、雅施达、合贝爽”等药物治疗。3 a前再发胸闷、心悸就诊,复查肌酐、肾功能正常,床边心电图提示心房颤动(房颤)(图1B);动态心电图提示频发房性期前收缩、短阵室速(4个心动周期);心脏MRI平扫+增强示室间隔及左心室壁广泛不均匀增厚(最厚约3.0 cm),室腔缩小。增加“阵发性房颤、频发房性期前收缩、短阵室速”诊断,加用“利伐沙班、倍他乐克”等药物治疗。18个月前症状再发,就诊笔者医院急诊查肌钙蛋白I为8.51 ng/mL,心电图示房颤伴室性期前收缩,左心室肥厚,广泛ST-T改变。予“硝酸甘油、可达龙”治疗,胸闷痛症状较前缓解,复查心电图示窦性心律,左心室高电压,QTc间期延长,ST段压低(Ⅰ、aVL、Ⅱ),T波双向、倒置、深倒置(Ⅰ、aVL、Ⅱ、Ⅲ、aVF、V3-V6)(图1C);心脏彩超提示室间隔及左心室各壁增厚较前进展(2.60~2.77 cm)(图2),冠脉造影示左主干粗,第一对角支开口狭窄30%,第二对角支开口狭窄40%,前降支远段近端狭窄30%~40%,回旋支、右冠脉及其分支未见明显狭窄(图3)。左心室造影示心室下壁段、前侧壁段肌小梁增粗突入心腔,舒张期心腔略呈芭蕾舞足样改变(图4),前基底段、前侧壁段、心尖段、下壁段、后基底段室壁运动正常。心脏MRI平扫+增强提示室间隔及左心室壁广泛不均匀增厚,室腔缩小,为肥厚型心肌病(图5)。于2020年11月行房颤冷冻球囊导管消融术,术后未再发胸闷、胸痛,心电监护未见房颤发作,复查肌钙蛋白I较前明显下降。随后无明显胸闷痛、心悸不适,规律服用“氯吡格雷、洛汀新、瑞舒伐他汀、曲美他嗪、倍他乐克”等治疗,多次复诊笔者医院门诊,监测肌钙蛋白I波动于0.1~0.77 ng/mL,NT-proBNP 波动于472~1 319 pg/mL,肾功能、尿蛋白正常,心脏彩超提示心肌肥厚与前大致相仿,未再监测到房颤、室速发作。平素无少汗、无汗、周围感觉疼、夜尿增多等表现。既往史:“高血压病”病史24 a,脂肪肝,抗“甲状腺功能亢进症”药物治疗后(已停药,甲功正常)。有“先锋霉素”过敏史。家族史:父母已故,父亲因“心脏病(具体不详)”去世,母亲因“高血压病”去世,有1兄1妹,兄有“高血压病、肥厚型心肌病”病史。
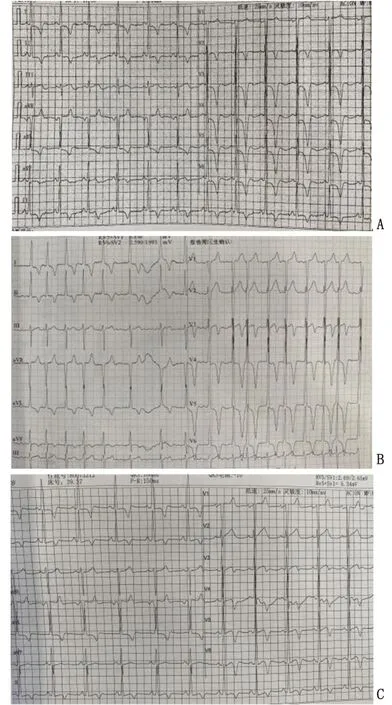
A:2016年首诊心电图;B:2018年首次监测到心房颤动;C:2020年心电图。
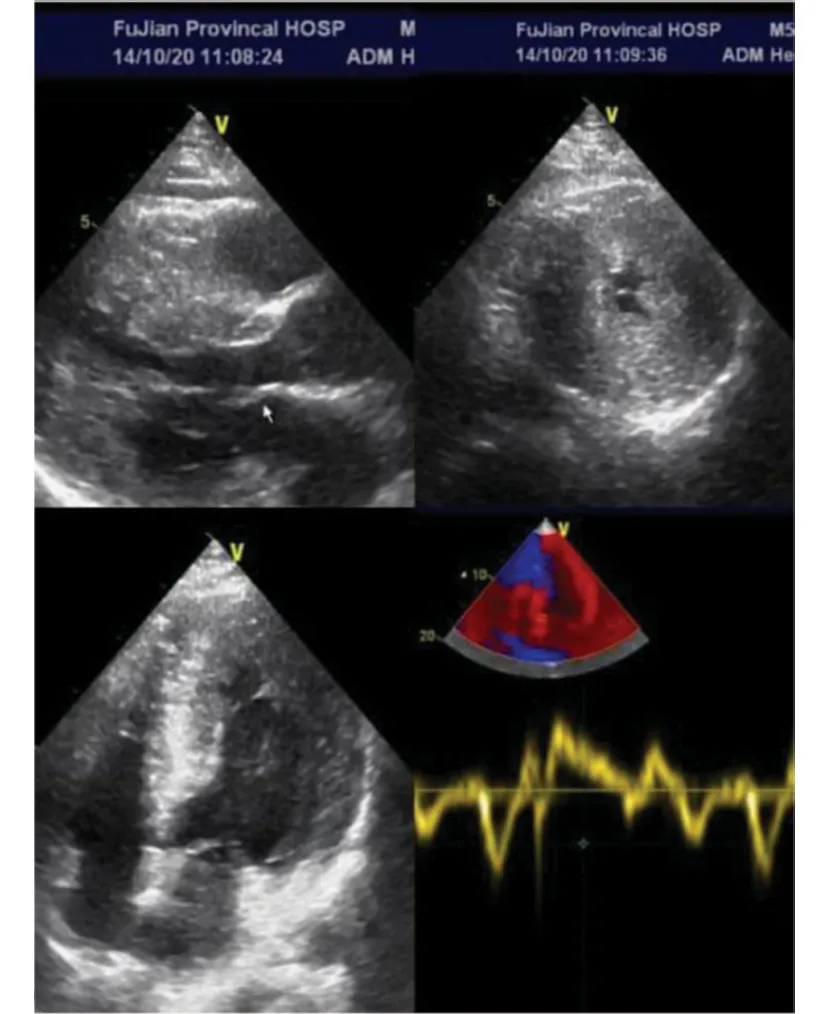
图2 超声心动图检查
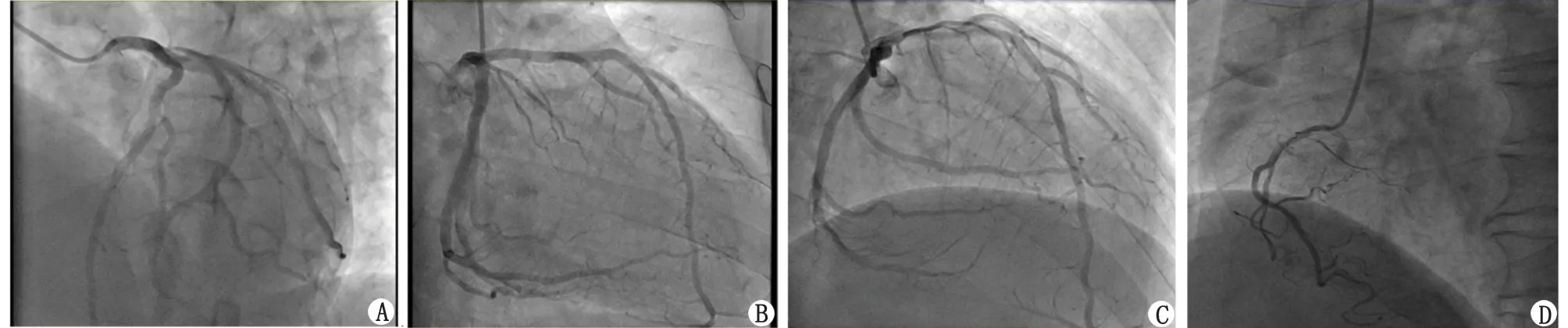
A:左头位;B:右足位;C:右头位;D:左前斜位。
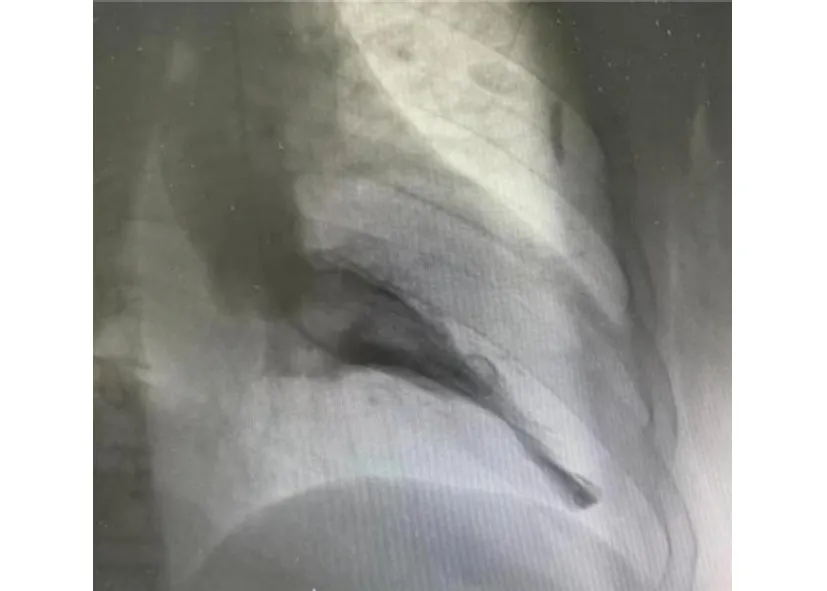
图4 左心室造影

A:T1-mapping测量值;B:T1-mapping伪彩图。
查体:T 36.2 ℃,P 62 min-1,R 21 min-1,BP 105/60 mmHg(1 mmHg=133.3 Pa)。神志清楚,颜面部皮肤可见散在色素痣,未见血管角质瘤,视力听力正常,双侧瞳孔等大等圆,眼底正常,颈静脉无怒张,肝颈静脉回流征阴性,甲状腺无肿大,胸廓无畸形,胸骨无压痛,双肺呼吸音清晰,未闻及干湿性啰音,无胸膜摩擦音。心前区无隆起,心尖搏动位于左第五肋间锁骨中线内0.5 cm,无抬举感,无震颤,心相对浊音界无扩大。心率62 min-1,律齐,A2=P2,各瓣膜听诊区未闻及杂音,无心包摩擦音。腹软,全腹无压痛、反跳痛,未触及包块,肝脾脏肋下未触及,墨菲氏征阴性。肠鸣音无亢进或减弱,4次/分,四肢肌力、肌张力正常对称,四肢感觉正常,病理征阴性。
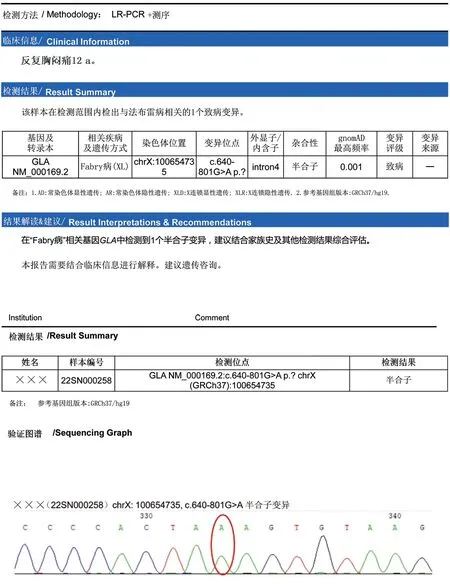
2022年5月行FD筛查:Lyso-GL-3:5.69↑(<1.11 ng/mL),α-GLA:0.71↓[2.40~17.65 μmol/(L·h)]。进一步行基因检测发现GLA640-801G>Ap.? 半合子突变(图6),诊断FD明确。在心血管相关治疗的同时,增加酶替代治疗(阿加糖酶α,每2周1次)。
FD:法布雷病;GLA:半乳糖苷酶。
2 讨 论
FD作为一种罕见的X染色体连锁的遗传性溶酶体贮积病,其确切的患病率目前尚不清楚,普通人群中预估患病率为1/100 000[2]。上海交通大学医学院附属瑞金医院曾报道,我国终末期肾衰竭透析患者中FD患病率为0.12%[3]。美国血液透析患者中的患病率男性为0.21%,女性为0.15%;心脏病(含左心室肥厚和肥厚型心肌病)患者中男性为0.94%,女性为0.90%;脑卒中患者中男性为0.13%,女性为0.14%[4]。随着心脏成像技术的进步和对心肌病认识的提高,高危患者中FD不再罕见,特别是在显著心脏受累表现的患者中晚发型(非经典表型)或非典型FD[5]。迄今已发现了1 000多个GLA基因变异,并将其归类为致病性、良性、无临床相关性或意义不明[6]。我国台湾地区通过对新生儿及特发性肥厚型心肌病患者筛查,发现台湾地区FD心脏变异(IVS4+919G>A)的患病率很高(约1 600例男性中有1例)[7]。本例患者检测出GLA c.640-801G>A p.?半杂合子突变,该变异也称为IVS4+919G>A,即台湾地区人群中高发突变位点,为剪切突变,该变异可能导致mRNA剪切信号的改变而影响酶活性[8],该变异评级为致病变异。
中国成人肥厚型心肌病诊断与治疗指南[9]指出,35岁以上表现为肥厚型心肌病的患者0.5%~1%为此病,且通常合并其他系统受累症状,推荐对该类型患者进行α-GLA活性测定及基因检测。2020年,美国心脏协会/美国心脏病学会肥厚型心肌病指南[10]将FD心肌损害独立于指南之外阐述。FD临床表现多样,累及多器官系统,最常见的受累器官系统是心脏(69%)、周围神经(46%)、肾脏(45%)、眼睛(37%)、脑(34%)、皮肤(32%)、胃肠道(31%)和听觉系统(19%)。其中,心脏受累常有以下特征:左心室肥厚的家族史(特别是没有证据表明是男性遗传),心电图短PR间期、心动过缓、房室传导阻滞、二维超声心动图后壁整体纵向应变降低、轻至中度主动脉根部扩张、二尖瓣和主动脉瓣增厚伴轻中度反流、心脏磁共振成像示乳头肌肥大、基底下外侧延迟钆强化、T1 mapping值降低[1]。FD的病理学特征为溶酶体糖脂在组织中的聚集,光镜下可见细胞胞浆内空泡样改变,电镜下可见相应组织细胞(如心肌细胞、肾小球脏层上皮细胞、皮肤汗腺等)胞质内充满嗜锇性“髓样小体”,小体呈圆形或卵圆形,小体内部呈层状,类似洋葱皮或髓鞘结构[11]。除了合并多系统受累的典型FD外,还有比典型病例起病晚的、以首发原因不明左心室肥厚的非典型病例,尤其是男性。本病例仅累及心血管系统,表现为高血压病、肥厚型心肌病、心律失常、心功能不全,心电图、心脏彩超及心脏磁共振均未见典型表现,且未合并其他器官系统受累表现,属于罕见病例。因此,基于FD心脏表现的多样性及非特异性,对于年龄>40岁且家族背景不明的不明原因左心室肥厚患者,建议常规筛查α-GLA活性(男性)和GLA基因测序(女性)[12]。
FD的治疗目标在于延缓疾病进展,改善生活质量,降低相关并发症的发病率,延长患者的生存期。除累及各个器官系统的对症支持治疗外,其治疗方法包括:(1)酶替代疗法。酶替代疗法通过外源性补充基因重组的α-GLA,替代患者体内酶活性降低或完全缺乏的α-GLA,促进GL-3的分解,减少GL-3和LysoGL-3在器官组织的贮积,减轻患者的疼痛程度,减少蛋白尿,并改善其他相应症状,阻止或延缓多系统病变发生[13-14]。酶替代疗法药物包括阿加糖酶β和阿加糖酶α。(2)分子伴侣疗法。分子伴侣是一种口服小分子药物,可选择性、可逆性地与结构、功能有缺陷的α-GLA结合,稳定蛋白构象,帮助蛋白正确折叠以发挥正常功能,增加或恢复α-GLA活性,促进其运输至溶酶体,以清除贮积的底物,因此又称为酶增强治疗[15-16]。目前临床使用较多的是米加司他(migalastat,已在加拿大及欧洲等国家上市,暂未在我国上市)。另外底物减少治疗、基因治疗及基于mRNA治疗等一些新的药物或治疗策略正在临床试验或研发中,有望为FD的治疗提供新的方向[17]。

