多参数MRI 对局灶性自身免疫性胰腺炎与胰腺癌的鉴别诊断价值
殷 灿,邓喜青
(中南大学湘雅医学院附属株洲医院放射影像科,湖南 株洲 412000)
自身免疫性胰腺炎(Autoimmune pancreatitis,AIP)是一种少见类型的慢性胰腺炎[1],与自身免疫异常相关。国际共识诊断标准(ICDC)[2]将其分为两种类型,其中1 型AIP 与免疫球蛋白G4 明显相关,按照病灶累及范围又可以分为局灶性AIP(f-AIP)和弥漫性AIP 两种。AIP 的病理学特点除表现为胰腺肿胀、导管狭窄及腺泡萎缩外,均伴有导管周围的炎性细胞聚集及广泛的间质纤维化[3]。在临床上f-AIP 和胰腺癌(Pancreatic cancer,PC)可具有相似的临床症状及影像学特点,这给鉴别诊断带来了一定困难[4],而二者的治疗策略及预后截然不同,因此,明确诊断意义重大[5]。本文回顾性分析f-AIP、PC 及正常胰腺(Normal pancreas,NP)患者的影像资料,旨在探讨多参数MRI 在f-AIP、PC 诊断及鉴别诊断中的价值。
1 资料与方法
1.1 临床资料
本研究获得了医院伦理委员会的批准。回顾性分析2012 年1 月—2020 年12 月确诊的10 例f-AIP 患者及20 例PC 患者的临床资料,并随机选取20 例NP 患者作为对照。纳入标准:①AIP 的诊断采用国际胰腺学会发布 《AIP 诊断标准国际共识(ICDC for AIP)》;PC 均经术后病理证实;②所有患者均于我院行上腹部MRI 检查,包括T2WI、T1WI 和DWI 序列,磁共振胰胆管造影(MRCP)及动态增强扫描。排除标准:①图像质量差,影响图像评估分析;②虽证实为AIP 或PC,但于MRI 图像上f-AIP 病灶或癌灶信号混杂而影响数据测量;③既往使用过激素,有其他自身免疫疾病。
1.2 成像方法
MRI 检查:采用Siemens 3.0T 超导型磁共振扫描仪。轴位T2WI 压脂序列:TR/TE=3 856 ms/80 ms,FOV=38cm×38cm;轴位T1WI 压脂序列:TR/TE=180ms/13 ms;DWI序列,b值选择0 s/mm2和800 s/mm2,TR/TE=3 000 ms/50 ms,FOV 38 cm×38 cm;对比剂经肘静脉注射钆喷酸葡胺注射液(拜耳药业),剂量0.1 mmol/kg,速率为2.5 mL/s,分别于注药开始后15、80、300 s 进行动脉期、门静脉期及延迟期扫描。
1.3 图像分析
观察内容包括累及部位(胰腺头/体/尾)、强化方式以及有无主胰管扩张、狭窄等。根据胰腺相关研究[6],将胰腺病变的信号特点分为3 种类型(均匀型、斑点型和靶环型),并分别统计这3 种特征影像表现在动态增强时f-AIP 组和PC 组中的出现概率。再分别在T2WI 压脂序列、DWI 序列生成的T2WI图及ADC 图像上测量T2WI 信号强度值(SI)和表观弥散系数(ADC)。所有数据的测量均由1 名腹部学组副主任医师在工作站西门子公司自带的软件处理包测量得到。感兴趣区(ROI)的大小及形态固定为30 mm2的类圆形。f-AIP、PC 组ROI 置于3 个不同的且病灶显示最佳的位置,取均值纳入统计;对照组ROI 分别置于胰头、胰体和胰尾,取均值。为避开相邻组织容积效应的影响,ROI 的选择应尽可能放置于病灶内。
1.4 统计学处理
采用SPSS 25.0 软件进行数据处理,P<0.05 为差异有统计学意义。将f-AIP 组与PC 组病变组织信号特征的数据分别进行秩和检验。对于T2WI SI值、ADC 值,符合正态分布且方差齐的采用独立样本t 检验比较组间差异,方差不齐者采用校正t 检验,而不符合正态分布的则采用Mann-Whitney U检验。并绘制T2WI SI 值、ADC 值及两者联合鉴别f-AIP 与PC 的ROC 曲线。计算曲线下面积(AUC),根据Youden 指数确定最佳阈值。AUC 值<0.5 表示表现较差,0.5~<0.7 表示一般,0.7~<0.8 表示良好,≥0.8 表示优秀。
2 结果
3 组病人年龄、性别差异均无统计学意义。PC组中病灶多胰头受累(18/20),T2WI 病灶多呈稍高信号,DWI 呈高或稍高信号为主,增强扫描以不均匀弱强化为主(17/20),见图1。f-AIP 组少胰头受累(3/10),T2WI 呈等或稍高信号,DWI 多呈高信号,增强扫描多呈延迟性均匀明显强化(8/10),见图2。f-AIP 组、PC 组均可见主胰管的扩张或狭窄改变。增强扫描动脉期PC 组、f-AIP 组表现为均匀型及斑点型的分别为25.0%(5/20)、90.0%(9/10),表现为靶环型的分别为75.0%(15/20)、10.0%(1/10),两组差异有统计学意义(χ2=10.652,P=0.025)。增强扫描延迟期PC 组、f-AIP 组表现为均匀型及斑点型的分别为15.0%(3/20)、80.0%(8/10),表现为靶环型的分别为85.0%(17/20)、20.0%(2/10),两组差异有统计学意义(χ2=8.362,P=0.016)。NP 组T2WI SI 值为(0.317±0.041)×10-3,PC 组、f-AIP 组T2WI SI 值均大于NP组,且PC 组大于f-AIP 组;NP 组ADC 值为(1.311±0.136)×10-3mm2/s,PC 组、f-AIP 组ADC 值均小于NP 组,且PC 组大于f-AIP;两两比较差异有统计学意义(P<0.05),见表1。T2WI 鉴别f-AIP 与PC 的ROC 曲线(图3),T2WI SI值的最佳临界值为0.408×10-3,相应的敏感性为80.0%,特异性为90.0%,AUC 为0.920。DWI 鉴 别f-AIP 与PC 的ROC 曲线(图3),ADC 值的最佳临界值为1.109×10-3mm2/s,相应的敏感性为60.0%,特异性为90.0%,AUC 为0.813。根据ROC 曲线,两者联合诊断时的敏感性为92.0%,特异性为81.0%,此时AUC最大,值为0.953。
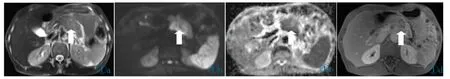
图1 a~1d 男,68 岁,PC 患者。胰体部增大,其内可见一团块状异常信号(白箭头所指),T2WI 呈稍高信号(图1a),信号欠均匀,DWI 示胰体局灶性稍高信号(图1b),相应ADC 图呈稍低信号(图1c),增强扫描延迟期病灶呈不均匀强化(图1d)。Figure 1 a~1d.Male,68 years old,PC patient.The body of the pancreas was enlarged,with a mass of abnormal signal(indicated by the white arrow),slightly high signal intensity on T2WI(Figure 1a),inhomogeneous signal intensity,focal high signal intensity on DWI(Figure 1b),slightly low signal on the corresponding ADC map(Figure 1c),and inhomogeneous enhancement in the delayed phase of enhanced scan(Figure 1d).
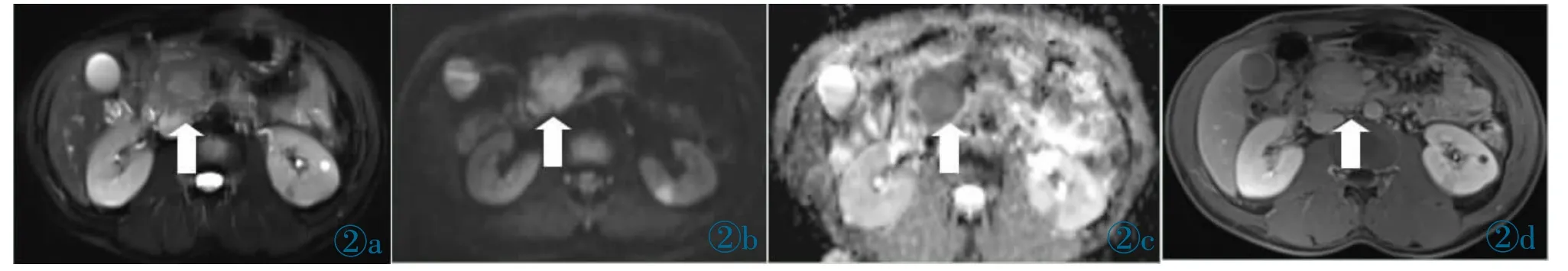
图2 a~2d 女,59 岁,f-AIP 患者。病灶局限于胰头部(白箭头所指),T2WI 呈稍高信号(图2a),DWI 呈高信号(图2b),ADC 图呈低信号(图2c),增强扫描延迟期呈均匀强化(图2d)。Figure 2 a~2d.Female,59 years old,f-AIP patient.The focus was confined to the head of the pancreas (indicated by the white arrow),slightly high signal on T2WI(Figure 2a),high signal on DWI(Figure 2b),low signal on ADC(Figure 2c),and homogeneous enhancement in the delayed phase of enhanced scan(Figure 2d).
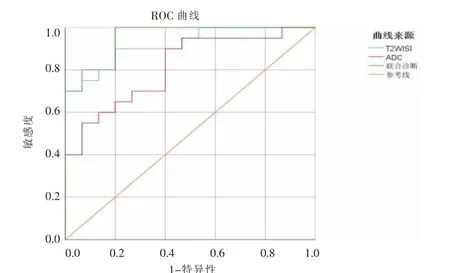
图3 T2WI、DWI 定量评估及二者联合鉴别f-AIP、PC 的ROC曲线。Figure 3.T2WI,DWI quantitative evaluation and the ROC curve of the combination of T2WI and PC to identify f-AIP and PC.
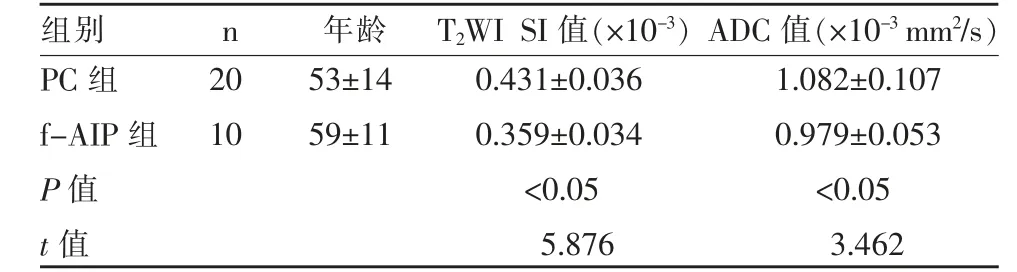
表1 f-AIP、PC 组患者的T2WI SI 值及ADC 值
3 讨论
3.1 f-AIP、PC 的影像学特点
AIP 的典型影像学表现是在胰周形成纤维化包壳,形成“腊肠”样特征性的改变[7],该影像表现一般多见于弥漫性AIP,本组f-AIP 均未出现。本研究f-AIP 组3 例累及胰头,5 例累及胰体,2 例累及胰尾。T2WI 呈等或稍高信号,DWI 多呈高信号,增强扫描多呈延迟性均匀明显强化;PC 组18 例累及胰头,1例累及胰体,1 例累及胰尾,T2WI 病灶多呈稍高信号,DWI 呈高或稍高信号为主,不均匀低强化为主。本研究显示增强扫描动脉期、延迟期两组的影像特征差异有统计学意义,增强扫描动脉期、静脉期PC组表现为靶环型的分别为75%、85%,均高于f-AIP组。分析其原因可能是PC 为乏血供肿瘤,肿瘤内更易发生坏死、囊变等,导致肿瘤强化多表现为靶环型;而f-AIP 是一种特殊的慢性炎性疾病,其特点是胰腺实质炎性细胞聚集及广泛的间质纤维化,坏死、囊变少见,病灶多呈均匀强化。MRCP 上f-AIP、PC均可见胆管或主胰管扩张或狭窄。AIP 可表现为主胰管弥漫性或节段性狭窄[8],一般为炎性狭窄无截断,这与PC 导致的主胰管或胆总管局部狭窄截断伴远端主胰管或肝内外扩张有一定差异。一般情况下,常规MRI 扫描结合动态增强有助于f-AIP 与PC 的鉴别,但当此方法诊断存在重叠时二者鉴别困难,需进一步结合其他方法。
3.2 T2WI SI 值鉴别f-AIP 与PC 的价值
组织内坏死、出血、黏液样变性、钙化等同时存在时,通过肉眼可以观察到组织内的差异,这在一定程度上可在常规MRI 图像上观察和评估。但在微观水平上,如细胞形态、代谢等方面的差异,很难通过常规MRI 图像的肉眼观察来证实和评价。MRI 上的信号强度通常同时受到多种生理和病理因素的影响。在大多数情况下,T2WI 上高信号区不是由炎症细胞或癌细胞组成,而是由于继发性改变,如坏死、积液、水肿或脓肿等引起。在T2WI 上,组织内高信号可能反映水肿或内部坏死[9],低信号可能反映组织纤维化[10]。T2WI SI 值是T2WI 上的信号强度值,其大小与不同组织成分在T2WI 上的信号高低呈正相关。我们可以通过测量T2WI SI 值来间接评估组织信号在微观上的变化。本研究发现f-AIP 组、PC 组的T2WI SI 值均高于对照组,且f-AIP 组的T2WI SI 值小于PC 组。分析其可能的原因是f-AIP 的本质是一种特殊类型的慢性炎症,以炎性细胞浸润、组织纤维化为主要特点,导致组织间隙水分子增多,且f-AIP 可伴有静脉闭塞性炎症而导致静脉回流障碍,这会进一步促使组织间隙水分子的聚集,从而导致T2WI SI 值升高;但同时f-AIP 伴有组织纤维化这一特点,又一定程度上引起T2WI SI 值降低,从而低于PC 组。PC 主要是癌细胞堆积生长,细胞排列密集,组织间隙内水分子少,其内液化坏死常见,促使其T2WI SI 值升高。本研究显示T2WI SI 鉴别f-AIP 与PC 最佳临界值为0.408×10-3,此时30 例研究对象中8 例诊断为AIP,22 例诊断为PC,与确诊情况相近。
3.3 ADC 值鉴别f-AIP 与PC 的价值
有研究表明正常对照组的ADC 值均大于PC、f-AIP 组,且PC 的ADC 值大于f-AIP[11-12],与本研究相符合。f-AIP 组ADC 值下降可能是由于胰腺组织内炎性细胞的大量聚集,导致细胞外间隙变窄,从而限制了水分子的自由运动,导致其ADC 值下降;PC组织中由于癌细胞紧密排列,细胞密度增大,导致水分子的运动受限,从而使ADC 值下降[13-14]。PC 组ADC 值大于f-AIP 组,分析其原因可能是由于PC的细胞密度小于f-AIP,且AIP 间质纤维化可能会进一步限制水分子的自由运动;另一方面,PC 为乏血供肿瘤,因此病灶内常有囊变、坏死,此时水分子运动受限情况可能会得到一定程度缓解,相应ADC值有所升高[15]。关于f-AIP、PC 的ADC 值的研究也存在一定差异。Klau 等[16]的研究表明PC 的ADC 值小于AIP,与本研究不符,这可能与研究者使用的不同磁共振设备或不同参数有关,从而导致在不同研究中2 种疾病鉴别诊断的ADC 值阈值存在较大差异。因此,ADC 值只能作为f-AIP 与PC 鉴别诊断的参考指标之一。
本研究属回顾性分析,有以下不足之处:①f-AIP 少见,且为单中心研究,从而导致样本量较小。②f-AIP 渗出较多时,常与胰腺分界不清,可能影响数据测量。下一步有待进行多中心研究,扩大样本量,排除f-AIP 渗出较多的病例。
综上所述,常规MRI 结合动态增强、T2WI 及DWI 多参数量化进行综合分析,能提高f-AIP 和PC的鉴别诊断准确率。当影像提示f-AIP 时,应及时结合相关免疫球蛋白G4 或进一步穿刺活检明确诊断。

