18F-FDG PET/CT 多代谢参数对非小细胞肺癌EGFR 基因突变的预测价值
史爱琪,王建林,王育珠,郭国蓉,范丑丑,柳江燕
(兰州大学第二医院核医学科 甘肃省医学影像重点实验室,甘肃 兰州 730030)
全球癌症数据表明肺癌的发病率和死亡率在男性中最高,女性中仅低于乳腺癌[1],非小细胞肺癌(NSCLC)比例超过85%,主要组织学亚型为腺癌,随访5 年生存率仅为17%[2]。表皮生长因子受体(EGFR)约在20%~50%的NSCLC 中发生突变。近年来酪氨酸激酶抑制剂(TKI)表现出能有效延长EGFR 突变型NSCLC 患者的生存期[3],因此EGFR 的检测对指导治疗至关重要,但目前获取标本易受各种因素限制而面临很大挑战,因此寻找简单无创的方法评估EGFR 的突变状态尤为重要。
氟代脱氧葡萄糖正电子发射型计算机断层显像(18F-FDG PET/CT)因其非侵袭性、结合解剖与功能信息的特性广泛应用于肺癌诊治中[4-5],同时研究表明EGFR 状态与NSCLC 肿瘤内葡萄糖代谢明显相关,因此18F-FDG PET/CT 代谢参数与EGFR 突变的关系成为研究热点,以最大标准化摄取值(SUVmax)分析最多,但结果仍存在很大争议,同时目前关于平均标准化摄取值(SUVmean)、肿瘤代谢体积(MTV)及病变糖酵解总量(TLG)的报道较少且结论尚不一致。因此本研究通过分析PET/CT 多代谢参数及临床特征与NSCLC 患者EGFR 突变的相关性,探讨突变的独立预测因素并建立模型判断效能,为临床提供指导。
1 资料与方法
1.1 临床资料
回顾性分析2016 年3 月—2021 年3 月我院行18F-FDG PET/CT 检查及EGFR 检测的NSCLC 患者98 例,其中腺癌83 例、非腺癌15 例(鳞癌11 例、腺鳞癌3 例及大细胞癌1 例)。纳入标准:病理证实的NSCLC;PET/CT 之前未行任何形式的抗肿瘤治疗(如手术、放化疗或其他);PET/CT 检查与EGFR 检测间隔<1 月;资料完整。排除标准:检查前已接受任何形式的抗肿瘤治疗;伴有其他恶性肿瘤病史;病灶多发;原发病灶最大径<1 cm。记录临床资料:性别、年龄、吸烟史、TNM 分期、病变位置、肿瘤最大径、CT边缘征象、病理类型及Ki67 指数。TNM 分期参照美国癌症研究联合会第8 版肺癌分期[6]。根据EGFR有无突变将患者分为突变组和野生组。
1.2 18F-FDG PET/CT 图像采集和分析
采用Discovery 690 型PET/CT 显像仪(GE Healthcare,WI,USA)检查。示踪剂为18F-FDG,通过医用回旋加速器(Minitrace Qilin,GE Healthcare,WI,USA)生产,并使用自动合成模块进行合成,放化纯度>95%。患者禁食、禁饮含糖饮料至少6 h,注射前血糖维持在9.0 mmol/L 以内。以2.96~5.55 MBq/kg的剂量肘静脉注射18F-FDG,静息约60 min 后在平静呼吸下取仰卧位扫描,范围为头顶至股骨上段,头部5~8 min/床位,其余3 min/床位。先行低剂量CT(120 kV,50~220 mA)图像采集,层厚3.75 mm,后采用static TOF+3D 模式行PET 图像采集,图像矩阵为256×256。应用CTAC 迭代重建,重建方式为VUE Point FX,重建后的图像经MedEx(北京麦迪克斯公司)工作站后处理及融合,从而得到各层面的PET、CT 及PET/CT 融合图像。
由2 名PET/CT 专业医师分析图像。CT 边缘征象阳性指毛刺征、分叶征、胸膜牵拉征至少存在1项;阴性指三者均无。在MedEx 工作站中通过视觉观察法识别肿瘤原发病灶,在病灶周围通过将整个病灶包绕的方法,以40% SUVmax 为阈值勾画感兴趣区(ROI),由软件自动在横断面、冠状面及矢状面上对病灶进行容积分割而得出用于定量18F-FDG 摄取值的相关半定量代谢参数。病灶内出现坏死时FDG 摄取呈减低或缺失,即低于所设定的阈值,软件将会自动排除坏死区域。SUVmax 是肿瘤代谢最活跃的摄取值,SUVmean 是病灶或ROI 内像素SUV平均值。MTV 指肿瘤中代谢活性较高部分的体积,TLG=MTV×SUVmean。
1.3 EGFR 基因突变检测
EGFR 基因突变检测由我院病理科进行,标本均取于手术切除、支气管镜或穿刺活检组织,采用ARMS-PCR 法扩增基因及EGFR 突变检测试剂盒进行突变状态分析。
1.4 统计学方法
采用SPSS 23.0、MedCalc 19.0.4 软件进行统计分析。计量资料符合正态分布用表示,两独立样本t 检验进行组间比较,不符合正态分布用中位数(上、下四分位数)表示,Mann-Whitney U 检验行组间比较。等级及计数资料用频数和百分比表示,分别用Mann-Whitney U 检验、χ2检验进行组间比较。使用约登指数确定最佳截断值,多因素Logistic 回归分析筛选并构建预测模型,DeLong 检验比较ROC曲线之间的差异。P<0.05 为差异有统计学意义。
2 结果
2.1 一般资料
符合纳入标准的患者共98 例,男55 例、女43例。EGFR 基因突变型55 例(腺癌52 例,鳞癌1 例,腺鳞癌2 例),野生型43 例(腺癌31 例,鳞癌10 例,腺鳞癌1 例及大细胞癌1 例),两组平均年龄分别为(57.2±8.9)岁、(58.4±9.5)岁。其中46 例无吸烟史,52 例有吸烟史。
2.2 临床特征与EGFR 基因突变的关系
单因素分析表明EGFR 突变更易发生在女性、无吸烟者、腺癌、周围型、肿瘤最大径较短及T1 期患者中,组间差异均有统计学意义(P<0.05),其余指标(年龄、N/M 分期、临床分期及CT 边缘征象)组间均无显著差异。
2.3 18F-FDG PET/CT 多代谢参数与EGFR 基因突变的关系
突变组SUVmax、SUVmean、MTV 及TLG 均较野生组低,且组间差异均具有统计学意义(表1)。ROC 曲线得出各参数最佳截断值为7.85、5.34、22.19、103.55,对应AUC 分别为0.622、0.638、0.679、0.687(图1,表2)。
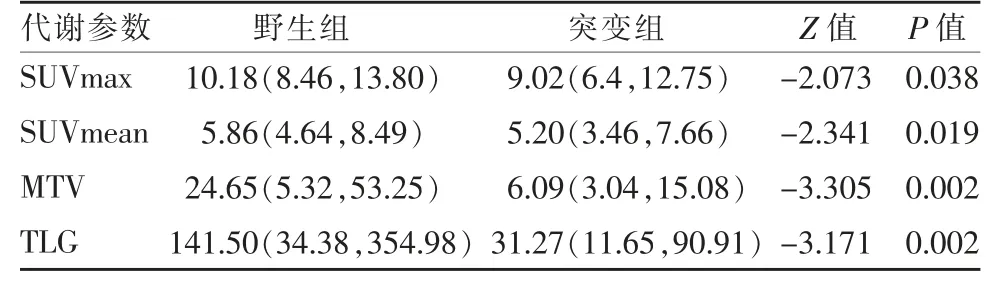
表1 PET/CT 多代谢参数与EGFR 基因突变的关系

表2 各代谢参数预测EGFR 基因突变的效能评估

图1 4 个代谢参数的ROC 曲线。Figure 1.ROC curves of the four metabolic parameters.
2.4 多因素分析及模型建立
单因素分析后有显著差异的指标纳入多因素分析,得出吸烟史、肿瘤位置、SUVmax 及SUVmean 是独立预测因素(表3)。上述4 个因素联合构建预测模型,ROC 曲线分析显示AUC 最大可达0.907,95%CI 0.842~0.971,敏感度98.2%,特异性79.1%,阳性预测值85.5%,阴性预测值81.4%,正确百分比83.7%,诊断效能较SUVmax、SUVmean 显著提高,且Delong检验表明这4 个因素与该预测模型之间的差异均有统计学意义(P<0.000 1)(图2)。图3,4 显示不同EGFR 状态典型病例的PET/CT 表现。
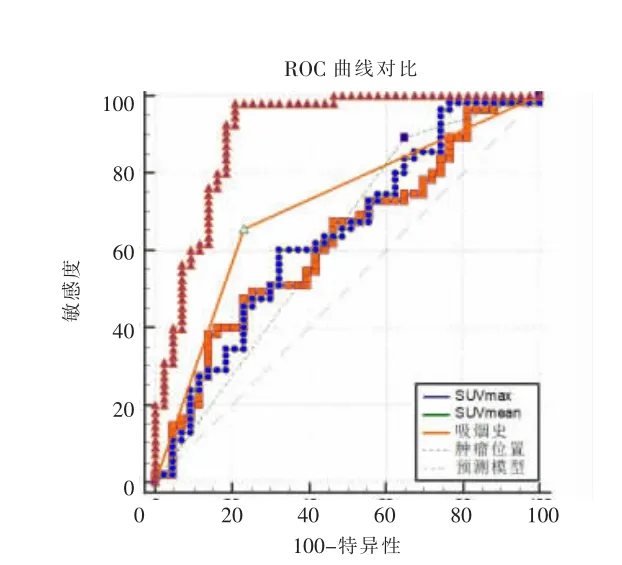
图2 独立预测因素及预测模型的ROC 曲线。Figure 2.ROC curves of independent predictors and prediction model.
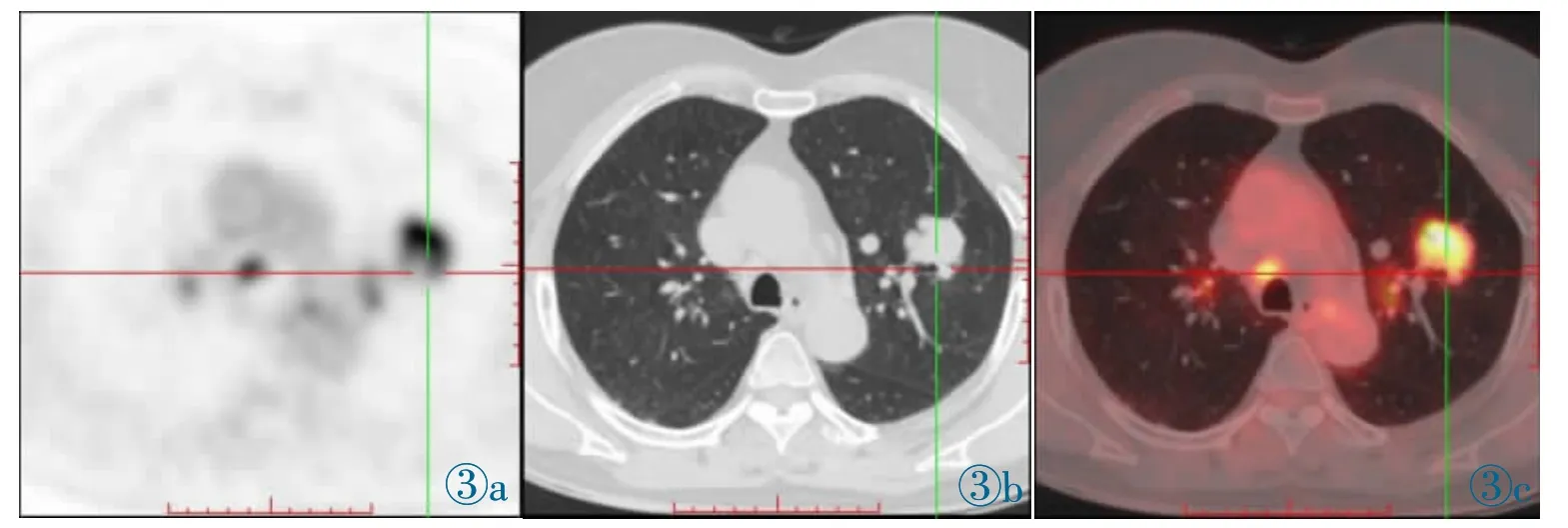
图3 女,62 岁,左肺上叶腺癌,EGFR 突变型,最大径约33 mm,18F-FDG 摄取增高,SUVmax 为7.26。Figure 3.Female,62y,adenocarcinoma in the left upper lobe,EGFR mutant.The maximum diameter is about 33 mm.FDG uptake is increased with SUVmax of 7.26.
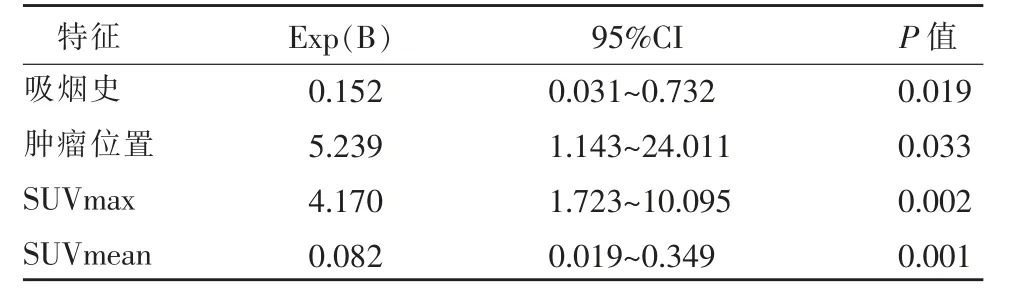
表3 EGFR 突变的多因素分析结果
3 讨论
EGFR 突变是NSCLC 中最常见的用药靶点之一,有效的EGFR-TKI 治疗的开展要求早期识别合适的患者。虽然有证据表明腺癌、女性、无吸烟者及亚洲区域等临床特征与EGFR 突变相关,但仍需探索更准确的因素预测其突变状态。既往研究报道,EGFR 基因可通过下游途径影响细胞膜葡萄糖转运体,进而影响肿瘤葡萄糖代谢[7],而18F-FDG PET/CT可以无创性的方式体现瘤内糖代谢情况,因此以该方式探索EGFR 突变状态逐渐受到更多关注。
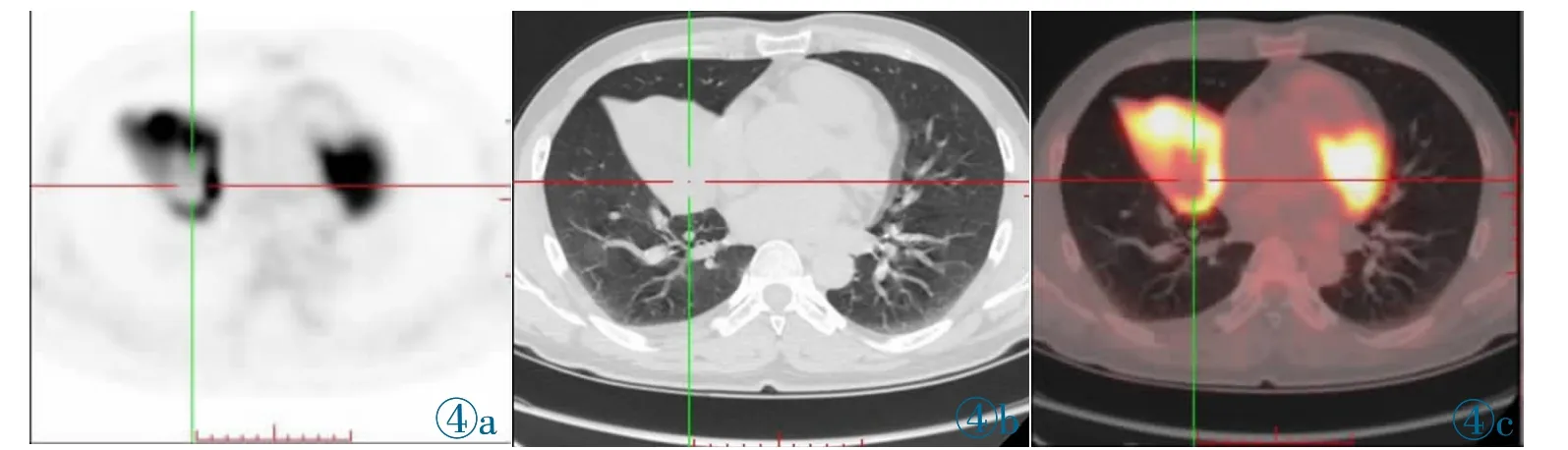
图4 男,45 岁,近右肺门鳞癌,EGFR 野生型,最大径约71 mm,18F-FDG 摄取增高,SUVmax 为17.8。图4a~4c 依次为横断位的PET、CT 及PET/CT 图像。Figure 4.Male,45y,squamous cell carcinoma near right hilm,EGFR wild type.The maximum diameter is about 71 mm.FDG uptake is increased with SUVmax of 17.8.Figure 4a~4c: Transverse PET,CT,and PET/CT images respiectively.
本研究发现EGFR 突变率为56%,与既往报道的亚洲人群突变率(36.8%~76.2%)相一致。单因素分析表明性别、吸烟史、病理类型、肿瘤位置、最大径、T 分 期、SUVmax、SUVmean、MTV 及 TLG 与EGFR 突变之间均明显相关。多因素分析后仅非吸烟者、周围型肺癌、低SUVmax(≤7.85)及低SUVmean(≤5.34)是独立预测因素,联合这些因素建立模型有助于区分EGFR 突变状态。
既往关于SUVmax 预测EGFR 突变的研究结果相互矛盾。大部分研究表明低SUVmax 与EGFR 突变有关[8-9],低SUVmax 最佳阈值范围为2.69~11.5。Gu 等[10]纳入Ⅰ~Ⅳ期NSCLC,表明低SUVmax(<9.0)与EGFR 突变明显相关。部分只纳入ⅢB、Ⅳ期患者发现低SUVmax(<9.6)可能是EGFR 突变的预测因素[11]。上述观察结果与本研究结果(SUVmax≤7.85)相一致,但SUVmax 阈值有所不同,只纳入晚期患者阈值稍高,有文献报道携带该突变的肿瘤会在克隆进化中异质性发生改变,代谢特征随之改变[12]。既往有学者探索了两者之间的分子机制,发现NADPH氧化酶4(NOX4)/活性氧(ROS)/细胞膜葡萄糖转运蛋白1(GLUT-1)轴在糖代谢中发挥重要作用,NOX4 表达下调时ROS 活性降低导致GLUT1 表达下降,同时突变型肿瘤细胞ROS 活性较低,因此可以部分解释EGFR 突变细胞对18F-FDG 摄取减少的原因[13]。少数研究得出相反的结论[14],即SUVmax 较高者更易发生突变,所得最佳阈值范围为5.0~13.65。Ko 等[15]表明SUVmax≥6 的患者突变频率更高。Wang 等[16]观察到突变型NSCLC 比野生型葡萄糖摄取及乳酸产生增加显著,一定程度上解释了部分研究突变型SUVmax 更高的原因。也有一些研究并未发现两者之间的相关性[17]。
由于SUVmax 仅反映肿瘤内糖代谢最高值,为更全面地体现肿瘤代谢行为,部分研究开始纳入其他参数,提示MTV 及TLG 均不具有EGFR 突变预测价值,与本研究结果一致[18-19]。相似的结果在Whi等[20]的研究中也可观察到,单因素分析显示SUVmax、MTV 及TLG 与EGFR 突变明显相关,但多因素分析后仅低SUVmax 是重要的预测因子,MTV、TLG 不能独立预测EGFR 突变。
引起这种争议的原因可能有:①代谢参数SUVmax、SUVmean 易受患者及技术等多种因素影响且SUVmax 有时不能反映肿瘤全部特征;②研究设计、患者选择、病理类型及分期等对结果也有影响;③NSCLC 可能与多种影响糖代谢的基因突变结合而引起结果差异。
本研究使用ROC 曲线分析各代谢参数的曲线下面积(AUC),发现TLG 效能最高。多因素分析后仅SUVmax、SUVmean 可预测突变,且SUVmean 效能更好,而MTV 和TLG 未能独立预测,这可能与参数本身的特点有关,SUVmean 是ROI 内的平均SUV,相比SUVmax 能反映更多代谢信息,MTV 和TLG 反映整个肿瘤的代谢,易受18F-FDG 摄取和体积的影响。Zhu 等[21]得出SUVmax 和SUVmean 识别EGFR 突变的AUC 分别为0.629 和0.632,与本研究结果相似。值得注意的是,本研究发现吸烟史的单独预测效能均比SUVmax、SUVmean 更高,AUC 0.711,而肿瘤位置的单独预测效能较低,AUC 0.620,即代谢参数呈中等的预测效能。Guo 等[22]纳入18 篇相关文献进行荟萃分析,表明SUVmax、SUVmean 对EGFR 突变状态呈中等的预测能力,支持了本研究结果。当联合这4 个因素建立预测模型,其AUC 可达0.907,高于单一指标的预测效能,敏感度及特异性各为98.2%、79.1%,阳性及阴性预测值各为85.5%、81.4%,正确百分比为83.7%,即该模型具有良好的预测效能及准确性,有助于初步指导EGFR-TKI 靶向治疗。
本研究还纳入一些临床指标,与多数研究结果一致,女性、非吸烟者、腺癌患者EGFR 状态有显著差异。肿瘤最大径(≤3.4 cm)与EGFR 突变明显相关,相似的结果在先前研究中可观察到[9,23]。Liu 等[24]表明周围型肺癌更易发生EGFR 突变,与本研究结果一致,提示肿瘤位置与内部代谢存在一定的关联,但目前关于该因素研究较少,尚需更多的研究来阐明。此外CT 边缘征象与突变无关,与部分报道结论一致[25]。
本研究仍存在一些不足,首先,回顾性研究的特点可造成部分选择偏倚,且样本量相对较小;其次,未进一步探讨EGFR 突变亚型与代谢的关系,同时伴有其他基因改变如ROS1 和ALK 融合也会对18F-FDG 摄取有影响,但因这种改变罕见尚未分析;此外未对预测模型进行验证,未来会收集独立数据验证,同时继续随访并分析预后。
本研究表明,吸烟史、肿瘤位置、SUVmax 及SUVmean 是NSCLC 患者EGFR 突变的独立预测因素,联合这4 个因素构建预测模型较单一因素有更好的预测效能,有利于早期区分无法行EGFR 基因检测患者的突变状态,从而指导EGFR-TKI 靶向治疗使患者获益。未来仍需要前瞻性、大规模的研究来进一步证实18F-FDG PET/CT 代谢相关的信息对EGFR 突变的预测价值。

