牡蛎酶解液对2型糖尿病小鼠皮肤软组织创伤愈合修复的作用及其机制研究*
王小艳,王庆苗,周怀霞
(1.庆阳市中医医院 内分泌科,甘肃 庆阳 745000;2.甘肃中医药大学 中医内科教研室,甘肃 兰州 730000)
2 型糖尿病是临床常见内分泌系统疾病,90%糖尿病为该类型。随着我国人口老龄化进程加剧,其发病率呈逐年上升趋势[1]。糖尿病创伤愈合障碍是2 型糖尿病患者严重并发症之一,通常由微小组织创伤引发炎症所导致。有数据显示,约20% 2 型糖尿病患者会出现非治愈性糖尿病足溃疡,严重情况下诱发感染、坏疽甚至截肢,给患者心理及生理健康带来严重影响[2]。目前,临床仍缺乏安全、有效、能促进2 型糖尿病患者组织损伤修复的治疗方法。因此探究安全有效的药物促进2 型糖尿病患者组织损伤修复是临床亟待解决的问题之一[3]。
皮肤创伤主要采用自体皮肤移植、缝合及使用抗生素治疗,但易造成增生性瘢痕。采用酶水解方式从蛋白质中获得的部分活性肽在皮肤组织创伤愈合方面具有较高应用价值。牡蛎是一种营养丰富、含有多种蛋白质的海洋生物资源之一,具有抗氧化、抑菌等功能[4]。既往研究显示,牡蛎酶解产物对皮肤软组织创伤愈合具有促进作用,但具体机制尚未明确[5]。刘好[6]研究显示,基质细胞衍生因子1(stromal cell derived factor 1,SDF-1)/趋化因子受体4(chemokine receptor 4,CXCR-4)通路活化对糖尿病小鼠皮肤创伤修复具有一定的促进作用。目前有关牡蛎酶解产物对2 型糖尿病皮肤组织创伤愈合的作用及其机制研究少见报道,因此本研究探究其对2 型糖尿病皮肤软组织创伤愈合修复的作用,并分析其对SDF-1/CXCR-4 通路的影响,以期为临床开发促进2 型糖尿病组织损伤修复的药物提供一定理论依据。
1 材料与方法
1.1 动物来源
50 只无特定病原体级4 周龄雄性小鼠,体重20~30 g,平均(25±5)g,购自北京唯尚立德生物科技有限公司,实验动物生产许可证号:SCXK(京)2016-0009,实验动物使用许可证号:SYXK(京)2021-0257。
1.2 主要试剂与仪器
1.2.1 主要试剂牡蛎肉(兰州沃特莱斯生物科技有限公司),初元Ⅰ型产品(主要含小麦低聚肽、海洋鱼皮胶原低聚肽),规格:100 mL/瓶,购自江西省江中药业股份有限公司,动物蛋白酶(规格:3 万u/g,河北省定州百克赛斯生物科技有限公司),链脲菌素(Streptozocin,STZ)(上海雅吉生物科技有限公司),苏木精-伊红(hematoxylin-eosin,HE)染色试剂盒(上海信帆生物科技有限公司),白细胞介素6(Interleukin-6,IL-6)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒(江西艾博因生物科技有限公司),兔抗鼠SDF-1、CXCR4 及β-actin 多克隆抗体、山羊抗兔HRP 二抗(杭州昊鑫生物科技股份有限公司)。
1.2.2 主要仪器Optima™XPN 超速离心机(苏州贝克曼库尔特生物科技有限公司),M1324R 型高速冷冻离心机(深圳市瑞沃德生命科技有限公司),JXDG型冷冻干燥机(上海净信实业发展有限公司)。
1.3 方法
1.3.1 牡蛎酶解物制备将牡蛎肉清洗、沥干,打浆,调至pH 7.0,加1 000 u/g 动物蛋白酶,酶解5 h,沸水浴灭活10 min,冷却,8 000 r/min 离心20 min,取上清液浓缩,浓缩后冷冻干燥备用。
1.3.2 模型复制及分组50 只小鼠适应性饲养1周,禁食、不禁水12 h,用pH 4.8 柠檬酸缓冲液稀释STZ 并配制成浓度为1%的溶液(避光、现用现配),将小鼠称重后按30 mg/kg 剂量一次性腹腔注射STZ,注射结束后禁食24 h 但给予饮用5%蔗糖水溶液,随后给予自由饮食、饮水。注射后3~7 d 抽取小鼠尾静脉血检测血糖,随机血糖≥16.7 mmol/L,即符合2型糖尿病诊断标准,可用于后续实验。将2 型糖尿病模型小鼠用10%水合氯醛腹腔麻醉后背部剃毛、消毒,使用皮肤活检针在小鼠背部剪去大小约1 cm×1 cm 的方形切口,充分分离皮肤、皮下组织及肌纤维膜组织,复制2 型糖尿病小鼠皮肤软组织创伤模型,术后注射青链霉素合剂,预防伤口感染。将模型小鼠随机分为5组,模型对照组,以及牡蛎酶解液低、中、高剂量组、阳性对照组,每组10 只。其中牡蛎酶解液低、中、高剂量组小鼠于模型复制成功次日分别给予0.25 g/(10 g·d)、0.5 g/(10 g·d)、1.0 g/(10 g·d)牡蛎酶解液灌胃处理[5],1 次/d,连续14 d,模型对照组同时间给予等量生理盐水灌胃处理;阳性对照组同时间给予初元Ⅰ型产品0.1 mL/(10 g·d)灌胃处理。
1.3.3 创面面积、创面愈合率测定分别于术后第3 天、7 天、14 天观察小鼠创面愈合情况,拍照并计算创面面积、创面愈合率。创面愈合率=(初始创面面积-当日创面面积)/初始创面面积×100%。
1.3.4 创面组织标本采集各组小鼠分别于术后第14 天后,以10%水合氯醛腹腔麻醉并处死,迅速提取背部创面组织标本,取材大小为1.5 cm×1.5 cm,厚度<0.5 cm。
1.3.5 HE 染色观察创面组织病理变化分别取各组5 只小鼠创面组织标本以4%多聚甲醛固定,乙醇脱水、透明、石蜡包埋过夜,连续切片厚约6 μm,脱蜡、水化,进行苏木精-伊红(hematoxylin-eosin,HE)染色,以中性树胶封片,光学显微镜下观察组织病理变化,并拍照。
1.3.6 ELISA法检测创面组织炎症因子分别取各组5 只小鼠创面组织标本,制备组织匀浆,3 000 r/min离心10 min,取上清液,严格按照各ELISA 试剂盒说明书进行操作,检测创面组织炎症因子IL-6、TNF-α水平。
1.3.7 Western blotting 检测创面组织SDF-1/CXCR-4通路蛋白的表达分别取各组小鼠创面组织标本,制备组织匀浆并提取总蛋白并检测浓度及纯度,电泳、转膜、5%脱脂奶粉室温封闭2 h,分别加入一抗SDF-1(1∶500)、CXCR-4(1∶1 500)、内参βactin(1∶500),次日加入HRP 标记山羊抗兔二抗(1∶1 000),室温孵育2 h,显色、显影、定影,根据各蛋白条带灰度值计算目的蛋白相对表达量。
1.4 统计学方法
数据分析采用SPSS 20.0 统计软件。计量资料以均数±标准差()表示,比较用单因素方差分析或重复测量设计的方差分析,进一步两两比较用SNK-q检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组小鼠创面形态变化
各组小鼠均未出现感染及死亡。模型复制成功后第3天,各组小鼠创面均已结痂,伤口周围出现红肿,无液体渗出,伤口收缩均不明显。模型复制成功后第7天,各组创面结痂变硬,创伤周围表面不平整,创缘皮肤收缩明显;其中,牡蛎酶解液高剂量组及阳性对照组结痂厚度优于牡蛎酶解液低剂量组、模型对照组,局部创面呈暗红色。模型复制成功后第14天,模型对照组伤口结痂有少量脱落,但瘢痕面积变化小,各给药组伤口明显缩小,部分明显缩痂、脱痂;其中,牡蛎酶解液高剂量组及阳性对照组呈现肉红色新生表皮,瘢痕暗红。见图1。
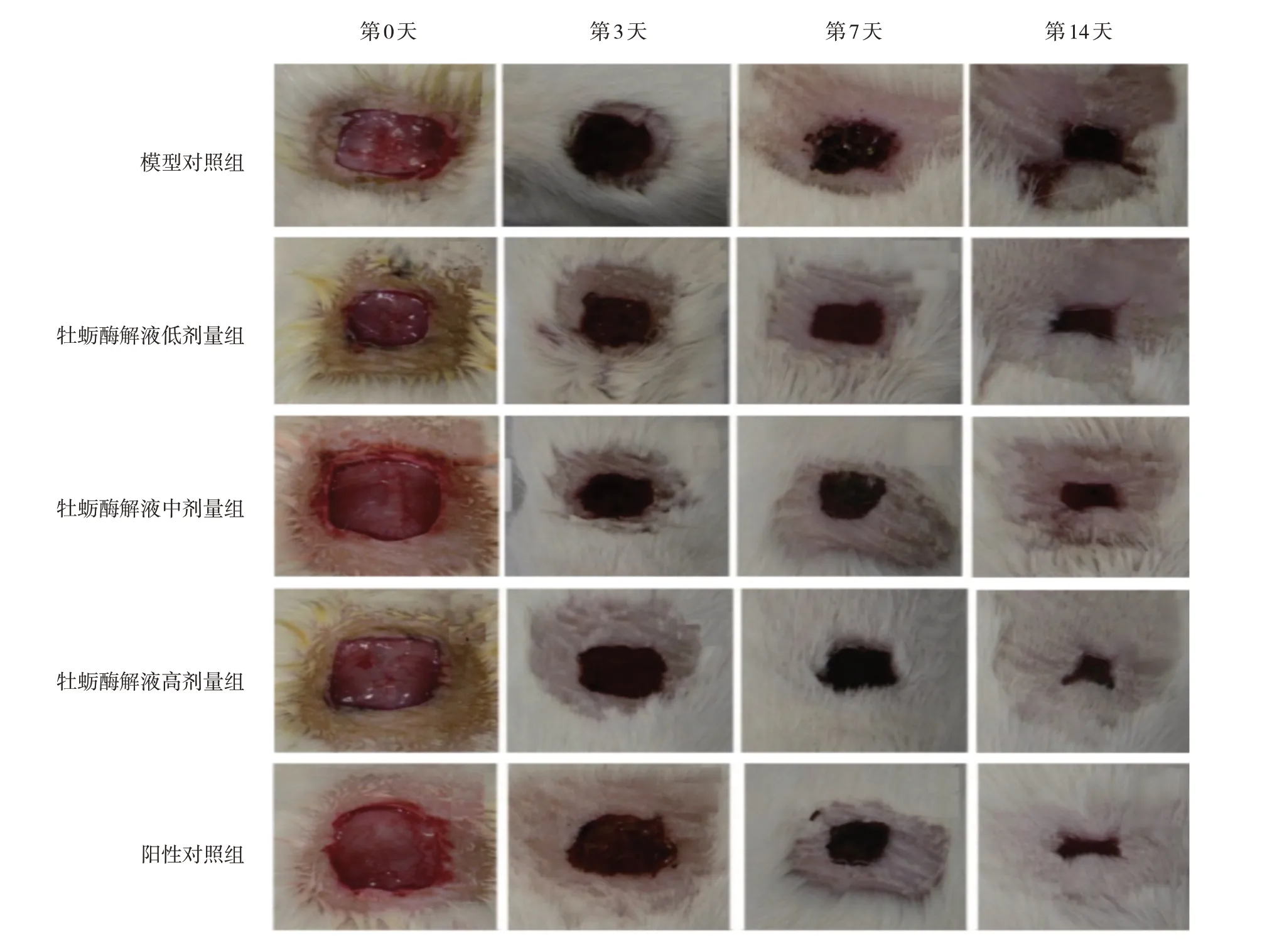
图1 各组小鼠创面形态变化
2.2 各组小鼠创面愈合率的变化
牡蛎酶解液低、中、高剂量组、阳性对照组和模型对照组小鼠术后3 d、7 d、14 d 的创面愈合率比较,采用重复测量设计的方差分析,结果:①不同时间点小鼠创面愈合率有差异(F=12.978,P=0.000);②5 组小鼠创面愈合率有差异(F=16.836,P=0.000);③5 组小鼠创面愈合率变化趋势有差异(F=22.128,P=0.000)。见表1。
表1 各组小鼠不同时间点的创面愈合率比较(n=10,%,)
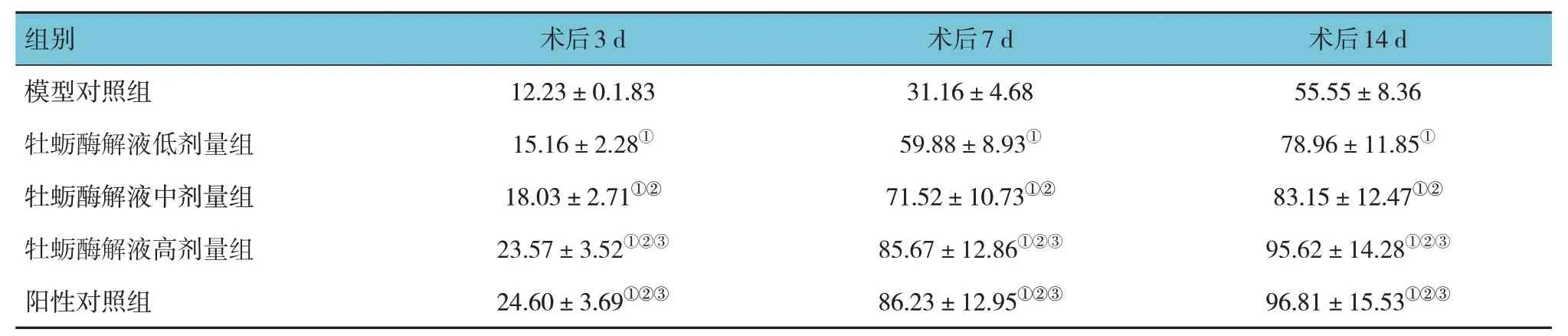
表1 各组小鼠不同时间点的创面愈合率比较(n=10,%,)
注:①与模型对照组比较,P <0.05;②与牡蛎酶解液低剂量组比较,P <0.05;③与牡蛎酶解液中剂量组比较,P <0.05。
2.3 各组小鼠创面组织病理变化
HE 染色结果显示,模型对照组小鼠创面组织中汗腺细胞、新生血管及导管较少;牡蛎酶解液低、中、高剂量组及阳性对照组小鼠创面组织中有肉芽组织形成,毛囊、汗腺细胞和导管增生较多,且排列整齐。见图2。
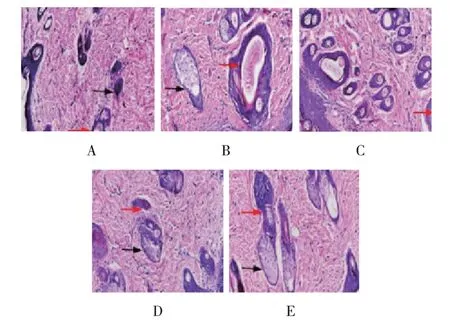
图2 各组小鼠创面组织病理变化(HE染色×200)
2.4 各组小鼠创面组织炎症因子水平比较
模型对照组、牡蛎酶解液低、中、高剂量组及阳性对照组小鼠创面组织炎症因子IL-6、TNF-α 水平比较,经方差分析,差异有统计学意义(F=29.518和10.827,均P=0.000)。进一步两两比较结果:与模型对照组比较,牡蛎酶解液低、中、高剂量组及阳性对照组小鼠创面组织IL-6、TNF-α 降低(P<0.05);牡蛎酶解液低剂量组IL-6、TNF-α 高于中、高剂量组(P<0.05),且牡蛎酶解液中剂量组IL-6、TNF-α 高于高剂量组(P<0.05),呈剂量依赖性;牡蛎酶解液高剂量组与阳性对照组IL-6、TNF-α 水平比较,差异无统计学意义(P>0.05)。见表2。
表2 各组小鼠创面组织炎症因子水平比较(n=5,)
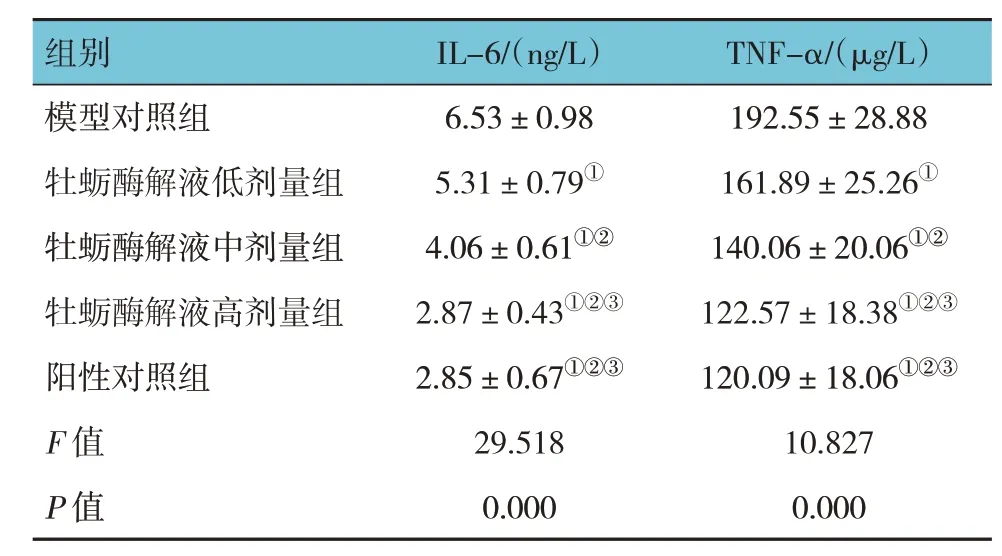
表2 各组小鼠创面组织炎症因子水平比较(n=5,)
注:①与模型对照组比较,P <0.05;②与牡蛎酶解液低剂量组比较,P <0.05;③与牡蛎酶解液中剂量组比较,P <0.05。
2.5 各组小鼠创面组织SDF-1/CXCR-4 通路蛋白相对表达量比较
模型对照组、牡蛎酶解液低、中、高剂量组及阳性对照组小鼠创面组织SDF-1、CXCR-4 蛋白相对表达量比较,经方差分析,差异有统计学意义(F=46.863 和78.137,均P=0.000)。进一步两两比较结果:与模型对照组比较,牡蛎酶解液低、中、高剂量组及阳性对照组小鼠创面组织SDF-1、CXCR-4 蛋白相对表达量升高(P<0.05);牡蛎酶解液低剂量组SDF-1、CXCR-4 蛋白相对表达量低于中、高剂量组(P<0.05),且牡蛎酶解液中剂量组SDF-1、CXCR-4蛋白相对表达量低于高剂量组(P<0.05),呈剂量依赖性;高剂量组与阳性对照组SDF-1、CXCR-4 蛋白相对表达量比较,差异无统计学意义(P>0.05)。见表3 和图3。
表3 各组小鼠创面组织SDF-1/CXCR-4通路蛋白相对表达量比较(n=5,)
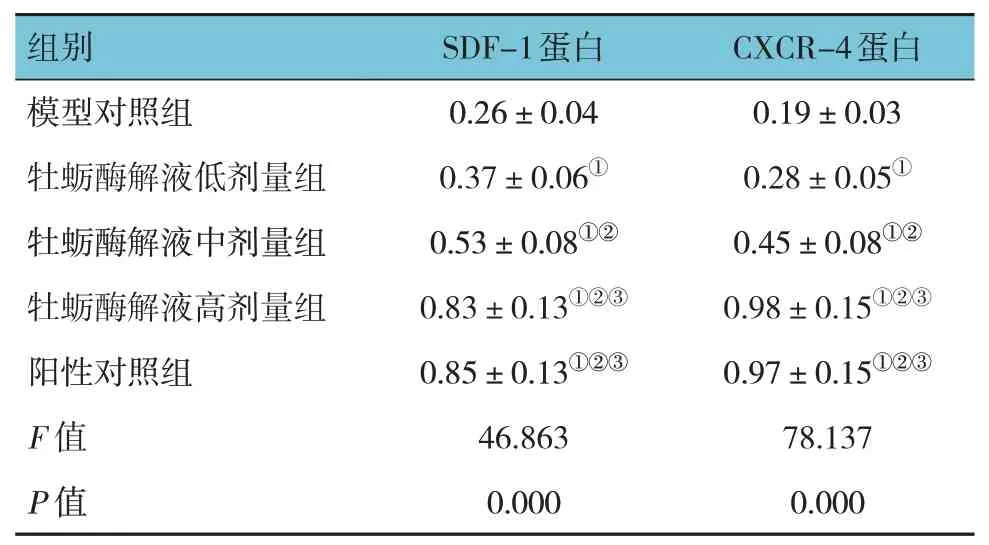
表3 各组小鼠创面组织SDF-1/CXCR-4通路蛋白相对表达量比较(n=5,)
注:①与模型对照组比较,P <0.05;②与牡蛎酶解液低剂量组比较,P <0.05;③与牡蛎酶解液中剂量组比较,P <0.05。
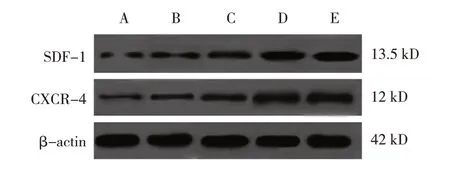
图3 各组小鼠创面组织SDF-1/CXCR-4通路蛋白的表达
3 讨论
2 型糖尿病是一种内分泌代谢失常引起的系统性慢性疾病,可引起全身多个系统损害,其中糖尿病足溃疡及伤口愈合困难是糖尿病最常见的严重并发症之一。有研究表明,由于机体微循环障碍、抗感染能力降低、组织修复能力减弱等常导致糖尿病患者伤口出现溃疡、感染、坏疽等,严重情况下导致截肢甚至死亡[7-9]。因此探寻能有效促进糖尿病患者伤口愈合的治疗手段具有重要临床意义。创伤愈合是一个动态修复过程,包含急性炎症期、细胞增殖期、组织重塑期3 个阶段,而2 型糖尿病对上述各阶段均可产生破坏效应,从而导致组织创伤修复能力受损及组织愈合障碍等[10-11]。传统创伤愈合活性物质如生长因子、细胞因子、免疫调节因子等都难以转化于临床促愈合治疗中[12]。近年来,生物活性肽的研究引起研究人员的青睐。有研究表明,其具有活性高、特异性和稳定性强的特点,部分活性肽如牡蛎酶解活性肽在皮肤组织创伤中具有较高的应用潜能[13]。杨发明等[5]研究显示,牡蛎酶解产物能够促进小鼠皮肤软组织创伤愈合,但具体机制尚未明确。
本研究复制2 型糖尿病皮肤软组织创伤小鼠模型,结果显示,与模型对照组比较,牡蛎酶解液低、中、高剂量组小鼠创面愈合率升高,呈剂量依赖性。说明牡蛎酶解液可能促进2 型糖尿病皮肤软组织创伤愈合。皮肤受伤后,组织中M2 型巨噬细胞会立即触发局部炎症反应,减慢组织愈合过程。本研究结果显示,与模型对照组比较,牡蛎酶解液低、中、高剂量组小鼠创面组织炎症因子IL-6、TNF-α 水平降低,呈剂量依赖性,说明牡蛎酶解液可能减轻2 型糖尿病皮肤软组织创伤小鼠创面组织炎症反应,促进创伤愈合修复。
SDF-1/CXCR-4 通路是一条信号转导通路,SDF-1 与其受体CXCR-4 相互结合可促进细胞中炎症因子如IL-6、TNF-α 等合成及分泌,促进炎症反应[14-15]。刘好[6]研究显示,抑制CXCR-4 表达可促进糖尿病小鼠皮肤创伤修复。李东峻[16]研究显示,抑制SDF-1/CXCR-4 轴活化对银屑病皮损修复有一定促进作用。本研究结果显示,与模型对照组比较,牡蛎酶解液低、中、高剂量组小鼠创面组织SDF-1、CXCR-4 蛋白相对表达量降低,呈剂量依赖性。说明牡蛎酶解液可能通过抑制SDF-1/CXCR-4 通路活化来抑制炎症反应,进而促进2 型糖尿病小鼠皮肤软组织创伤愈合修复。
综上所述,牡蛎酶解液可促进2 型糖尿病小鼠皮肤软组织创伤愈合修复,其可能是通过抑制SDF-1/CXCR-4 通路活化进而抑制炎症反应来实现的。然而本研究并未能阐明牡蛎酶解液对SDF-1/CXCR-4 通路的具体调控作用,后期应、将进行深入阐述。

