液基细胞学技术对甲状腺结节细针穿刺病理诊断的准确性研究
李燕红,周显,袁志正,吴奕晗
(东莞康华医院病理科,广东 东莞 523000)
0 引言
我国甲状腺FNA细胞学检查始于20世纪七八十年代,最早在内分泌科,继而在检验科或病理科中开展,并逐渐在全国流行,同时经历了从盲穿到超声引导下细针穿刺的过程,术前甲状腺FNA细胞学诊断溃疡有效抬高甲状腺手术恶性比例,避免对良性结节采取不必要的诊断性手术,应进一步推广并常规作为甲状腺病变术前诊断的有效方法。目前,甲状腺结节治疗以手术为主,但并非所有甲状腺肿瘤患者可以行手术切除,需根据结节良恶性、恶性肿瘤分化情况,选择最佳治疗方法,解决患者手术适应证受限的问题[1]。目前,甲状腺结节良恶性鉴别诊断最佳方法为细针穿刺细胞学检查技术,可明确患者甲状腺结节病理,为临床选择合理的诊治方案提供有效参考。细针穿刺细胞学检查是在超声引导下将细针穿入结节中,获取结节细胞标本,可以对各类型甲状腺结节作出准确、直接的诊断[2]。细针穿刺细胞学检查中,传统涂片技术是常用的制片手段,将获取病灶标本进行染色、显微镜检查,更好地观察病灶细胞变化情况,以此判断结节的良恶性。但传统涂片技术容易受到白细胞、红细胞等血细胞成分的干扰,使病灶标本细胞发生重叠现象,影响诊断准确率[3-4]。近年来,液基细胞学技术在穿刺细胞学检查中广泛普及,可清晰显示细胞形态结构,增加显微镜下细胞数量,细胞呈排列整齐,背景干净,血细胞和杂质少,不仅能清楚观察细胞成分,还能增强细胞三维立体感,清晰显示细胞核多形性、核膜不规则性、核沟和核内包涵体,对提升甲状腺结节良恶性鉴别诊断准确率具有重要意义。鉴于此,此次研究分析液基细胞学技术在甲状腺结节细针穿刺病理诊断中的应用价值,报告如下。
1 资料与方法
1.1 一般资料
选择医院2020年1月至2021年6月收治的503例甲状腺结节患者作为研究对象,回顾性分析其临床资料。纳入标准:经影像学技术检查,显示部分甲状腺结节伴有沙粒样钙化,界限模糊,符合恶性肿瘤征象特点,需进一步确诊;符合超声下细针穿刺、手术治疗指征;具有正常交流能力;意识清晰。排除标准:参与研究前已接受化疗、放疗、甲状腺硬化注射;合并凝血功能障碍;心、肝、肾等重要脏器功能不全;穿刺点周围皮肤发炎或感染。503例甲状腺结节患者中,男性患者占比131例,女性患者占比372例;年龄最小14岁,最大82岁,平均年龄(51.94±9.68)岁;甲状腺癌结节直径最短0.50mm,最长35.0mm,平均直径(16.35±5.64)mm。
1.2 材料方法
患者入院后进行血常规、尿常规、血液生化、心电图等检查,并了解患者病史、手术史、用药治疗史等,排除禁忌证。检查仪器:彩色多普勒超声诊断仪(荷兰飞利浦公司生产提供,型号为 Philips IU22)。首先,对所有患者进行甲状腺超声检查,取平卧位,于颈部放置软枕,头稍微后仰,确保颈前区充分暴露,探查患者甲状腺结节位置,探头选择VF10-5,频率为5MHz,避开气管和血管,确定甲状腺结节位置,并标记穿刺点。其次,对穿刺点周围皮肤进行清洁和消毒,消毒后给予利多卡因进行颈前区局部麻醉,局部浸润麻醉,换仰卧颈部过伸位,穿刺过程中切勿吞咽、说话、咳嗽,常规消毒铺巾,在超声引导下,手持21G一次性注射针(规格10mL)避开周围重要组织及气管,使细针穿刺结节至中心,在连续负压抽动情况下,前后移动2次,吸取结节细胞,对囊实性甲状腺结节于实性部位取材。退针,穿刺部位压迫止血,将获取的穿刺液注入深圳廖氏原生物公司固定液15mL中,送病理科行液基细胞学技术制片。
液基细胞学制片:将标本振荡数秒,然后倒入离心管中,给予离心5-10min,离心率为1500-2000r/min,去掉上清液,加细胞缓冲液,振荡,再次离心去上清液,去除黏液、胶质、血细胞成分,确保标本中细胞分布均匀,根据沉淀物的量决定加入1-5mL标本于染色仓中进行离心法或者沉降法收集细胞进行制片,采用95%乙醇湿法固定标本,使用苏木精-伊红染色法(hematoxylin-eosin staining,HE)或者巴氏染色法对病理标本进行染色。染色操作步骤:切片于苏木素染色2-5min左右,流水冲洗后,1%盐酸酒精分化3-5s,流水冲洗,返蓝,伊红染液中染色2min,依次放入95%酒精Ⅰ5min、95%酒精Ⅱ5min、无水乙醇Ⅰ5min、无水乙醇Ⅱ5min、二甲苯Ⅰ5min、二甲苯Ⅱ5min中,确保切片脱水透明干净,给予中性树胶封片。最终,镜检,采集图像分析报告。或者采用全自动液基细胞制片仪进行批量制片、染色,所有甲状腺结节穿刺标本评估由2名临床经验丰富的细胞病理诊断医师参照甲状腺细胞诊断标准完成,主要分为不满意标本、良性病变、甲状腺乳头状癌等。和传统涂片相比,液基细胞学方法制片优点如表1,图1及图2。

表1 结果对比

图1 液基细胞方法制片 可见核沟和核内包涵体(HE 10x40)

图2 传统细胞涂片,细胞排列混乱,杂质多(HE 10x40)
1.3 观察指标
完成活组织穿刺检查后,接受手术治疗的患者,切除结节标本送至病理科进行组织学检查,以组织病理学诊断作为金标准。分析液基细胞学技术对甲状腺结节良恶性鉴别诊断效能。组织病理学处理和诊断方法所有外科手术标本经10%中性缓冲福尔马林固定,石蜡包埋切片,HE染色,中性树胶封片。根据甲状腺病变诊断标准,由2位病理医师对细胞学标本和组织学标本进行分析。以病理组织学诊断结果为诊断金标准。
1.4 统计学方法
使用SPSS 23.0统计学软件对本次研究数据进行分析,计数资料以百分比(%)表示,并分别行χ2、t检验。P<0.05,差异存在统计学意义。
2 结果
共90例患者来院接受手术治疗的,术后常规病例诊断为甲状腺乳头状癌病例66例,对应的液基细胞学诊断为乳头状癌44例,不典型病变16例,良性病变4例,见少量滤泡细胞团(<6团)2例;常规病例诊断结节性甲状腺肿瘤10例,对应液基细胞学诊断为非典型病变2例,良性病变6例,考虑滤泡性肿瘤1例;常规诊断结节性甲状腺肿瘤,不排除癌1例,对应液基细胞诊断为良性病变;常规甲状腺局灶滤泡上皮增生,建议免疫组化5项1例,液基细胞学诊断为良性病变;常规桥本氏甲状腺炎1例,对应液基细胞学诊断为滤泡细胞轻度异型;常规诊断为甲状腺结节良性病变12例,对应液基细胞学诊断均为良性病变,见表2。
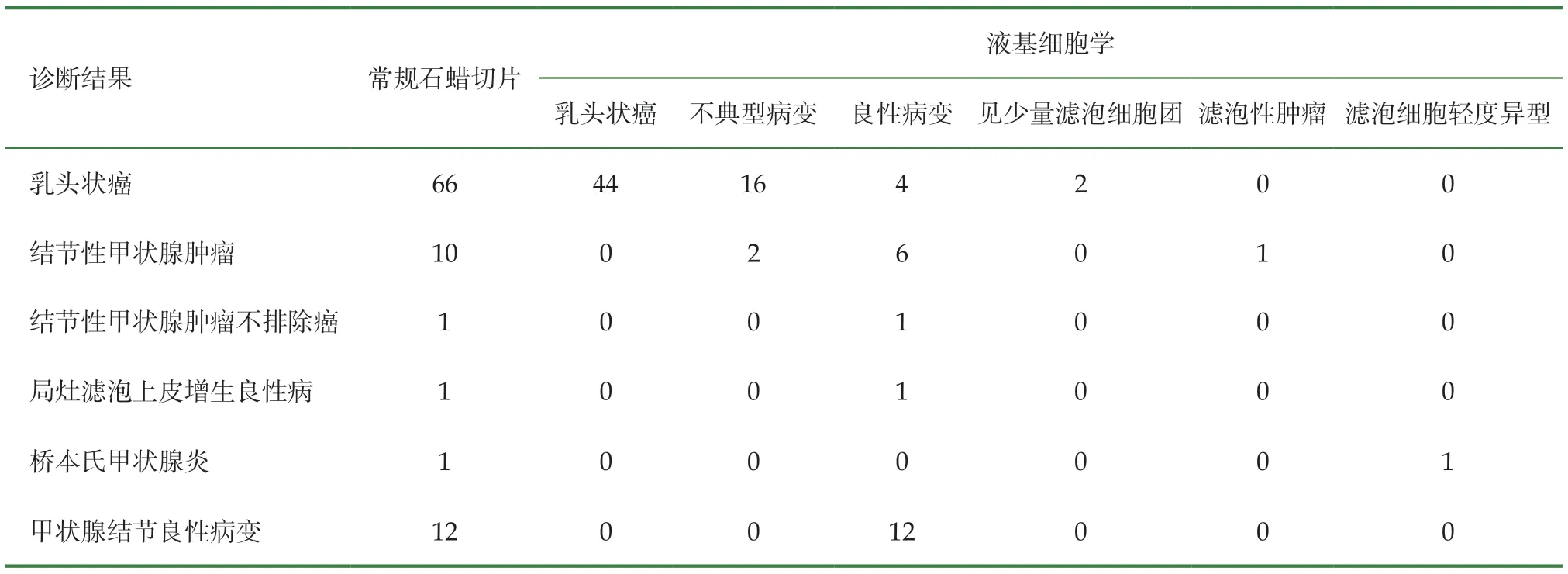
表2 结果对比
同一病例诊断为甲状腺乳头状癌的液基片和常规片比较,见图3、图4。

图3 液基细胞制片 甲状腺乳头状癌 (HE 10x40)

图4 常规组织切片甲状腺乳头状癌 ( HE 10x40)
4 讨论
甲状腺结节是指甲状腺占位性病变,与甲状腺激素分泌异常、甲状腺退行性病变、自身免疫、炎症等多种原因有关,其既可单发,也可多发,单发结节癌变风险较高[5-6]。超声引导下甲状腺细针穿刺抽吸活组织检查技术是临床评估甲状腺结节性质的首要选择,彩超引导下穿刺可以精准避开血管及其他重要组织,减少创伤性,同时也能准确定位可疑恶性结节,同时选择直径最小的穿刺针,能减少血液对甲状腺结节细胞稀释,值得注意的是穿刺针太细也会减少有效细胞量[7]。
穿刺活组织获得病灶细胞标本后,行细胞学制片、显微镜观察,可以根据患者甲状腺结节细胞排列和结构,观察细胞核核沟,判断其性质,提高恶性结节检出率。但甲状腺血供丰富,穿刺标本容易沾染大量胶质蛋白,采用传统人工涂片制片技术难以彻底清除细胞标本中的胶质蛋白和血细胞成分,影响图片质量,导致穿刺活检诊断受到限制[8-9]。但是液基细胞学技术反复震荡标本,让标本纯度更高,确保细胞在显微镜下获得清晰视野背景,更好地突出细胞单层排列特点,既能清除细胞标本中的胶质蛋白与杂质细胞成分,又能提高制片效率,弥补传统涂片的不足,该技术采用重力沉降方法收集具有诊断有效性的细胞,在20mm范围圆心区域保存完整细胞,有利于观察滤泡细胞是否集中在视野区域内,更容易识别良恶性细胞细胞核液基细胞学制片技术是一种收集与制备细胞标本的新技术[10-11]。这种方法也有其局限性,对滤泡性肿瘤、滤泡癌诊断符合率较低,适用于乳头状癌、结节性甲状腺肿诊断中。究其原因,滤泡癌细胞有包膜或血管浸润特征,而细针穿刺组织很难取到病变组织,故无法作出正确诊断[12-13]。值得注意的是,操作者的穿刺技术与经验会直接影响标本质量,病理技师的制片水平也影响着结果判断。但总体来说,液基细胞学技术诊断特异度、阳性预测值、准确率分别为均高于传统涂片技术[14-16]。
综上所述,采用液基细胞学技术可以提高穿刺细胞学针质量,为临床准确诊断甲状腺结节良恶性提供可靠依据,保证诊断效能,可以规避不必要的手术切除。

