改良SWAN-rLMC评分对慢性大脑中动脉闭塞的不对称静脉血管征的评估和预后的影响
许开喜 陈新建 顾宝东 徐行茹 马先军 左涛生 孟云 卞光荣
1南京中医药大学连云港附属医院南京医科大学康达学院附属连云港市中医院影像科,连云港 222004;2南京中医药大学连云港附属医院南京医科大学康达学院附属连云港市中医院脑病科,连云港 222004
磁敏感加权血管成像(susceptibility weighted angiography,SWAN)对局部磁场变化具有很高的敏感性,通过显示引流静脉及供血动脉的脱氧血红蛋白含量高低引起血管周围的磁场变化反映脑缺血状态改变。低灌注和缺血引起的补偿性血管扩张使得毛细血管床中血流相对减慢,也增加了缺血组织中血氧消耗,区域毛细血管和引流静脉脱氧血红蛋白含量增高,在SWAN 上表现为低信号,称为不对称脉静脉血管征(asymmetrically veins sign,AVS)。AVS包括不对称皮质静脉征(cortical veins sign,CVS)和不对称深髓质静脉(deep medullary veins,DMV)。SWAN 对急性大脑中动脉闭塞(acute middle cerebral artery occlusion,AMCAO)中 AVS 和SVS 研究较多[1-3],而对慢性大脑中动脉闭塞(chronic middle cerebral artery occlusion,CMCAO)研究比较少。AVS 可代表缺血低灌注状态,但其对于预测CMCAO 的预后的价值不明确。CMCAO 脑组织的缺血耐受及侧支循环代偿程度通过影响缺血区域毛细血管和引流静脉脱氧血红蛋白含量,改变局部磁化率及AVS显示,进而影响CMCAO 患者病情及认知等神经功能预后[4]。本研究首次对CMCAO 区域性软脑膜侧支循环状态进行研究,探讨侧支循环良好组和不良组的AVS 的阳性率差异,并分析AVS评估CMCAO预后的价值,为临床早期诊断、预防提供依据。
对象与方法
1、研究对象
回顾性收集在2017年1月至2022年2月间于南京中医药大学连云港附属医院的CMCAO 患者39 例,男25 例,女14 例,年龄 46~90(67.18±10.167)岁。临床表现头痛、头晕,遗忘、短暂性脑缺血发作(transient ischemia attack,TIA)、言语不清等。入组标准:(1)年龄>18 岁;(2)完成头颅多参数磁共振成像(magnetic resonance imaging,MRI)检查;(3)三维时间飞跃法磁共振血管成像(three dimensional time of flight magnetic resonance angiography,3D TOF-MRA)显示单侧大脑中动脉M1 段闭塞;(4)血管危险因素(高血压、糖尿病、高脂血症、饮酒、吸烟等);(5)研究数据齐全。排除标准:(1)陈旧性脑梗死范围大于相应供血区直径15 mm;(2)颈内动脉闭塞引起大脑中动脉闭塞;(3)肿瘤、烟雾病、血管炎、夹层动脉瘤;(4)严重肝脏和肾脏功能不全、血液系统疾病。对CMCAO 患者发病入院时间,入院时血压,入院第2 天空腹静脉血的血脂、血糖、糖化血红蛋白检查,出院时改良Rankin 量表(mRS)评分,出院后电话随访或患者再次入院,随访记录包括随访时间及是否TIA、腔隙性脑梗死、脑梗死、脑出血或血管相关死亡。
2、方法
采用美国GE Discovery 750 3.0T MR 扫描机器,32 通道相控阵头部线圈,所有患者均行常规T1加权成像(T1weighted imaging,T1WI)、T2WI、T2液体衰减反转恢复序列(fluid attenuated inversion recovery,FLAIR)、弥散加权成像(diffusion weighted imaging,DWI)、表观弥散系数(apparent dispersion coefficient,ADC)、3D TOF-MRA 和 SWAN 检查。常规 MRI 扫描方 T1WI 为重复时间(repetition time,TR)1 750 ms、回波时间(echo time,TE)21.8 ms,T2WI 为 TR 3 598 ms、TE 107.3 ms,FLAIR 为 TR 8 400 ms、TE 87.0 ms,DWI 为 TR 6 000 ms、TE 73.5 ms;3D TOF-MRA 扫描参数:TR 22 ms、TE 2.6 ms,视野(field of view,FOV)22.0 cm×19.4 cm,矩阵 256×224,反转角 15°;SWAN 扫描参数:TR 37.4 ms、TE 22.9 ms,矩阵416×320,层厚2 mm,间距0 mm,采集次数 1,激励次数(excitation number,NEX)0.70,带宽62.5 kHz,反转角20°。
3、图像处理和影像分析
3D TOF-MRA、SWAN 图像采集原始数据传输到GE 的4.6 工作站上后处理软件处理,分别对3D-TOF MRA 和SWAN 原始图像进行最小强度投影(minimum intensity projection,MinIP)处理后。用区域性软脑膜侧支(regional leptomeningeal collateral,rLMC)评分[5]评价病变侧大脑中动脉区侧支循环情况进行改良,增加大脑后动脉供血区,侧脑室体旁的DMV,由原9 个区域改为11 个区域,评价血管包括软脑膜血管、豆纹静脉及DMV,评分在SWAN 的进行图像MinIP处理后,可显示连续层面的静脉血管图像的幅值图和相位图,共包括11 个区域,共计24 分。具体评分方法如下:M1(大脑中动脉皮质供血区前部),M2(大脑中动脉皮质供血区岛叶外侧部分),M3(大脑中动脉皮质供血区后部),M4、M5、M6分别为核团以上层面大脑中动脉皮质供血区的前、侧和后部,大脑前动脉供血区、基底节区、大脑后动脉供血区、DMV(每个区域的患侧未见静脉影为0 分,较对侧少或等于为1分,多于对侧相应区域为2分)和外侧裂区(患侧未见静脉影为0 分,较对侧少或等于为2 分,多于对侧相应区域为4分)。AVS阳性定义为SWAN影像上病变侧大脑中动脉供血区侧支循环的CVS 和DMV 条带状低信号影较对侧增粗增多。随访纳入本研究的CMCAO 患者进行1 个月~5年随访,均采用专科门诊、住院电话随访,随访期间记录患者大脑中动脉供血区TIA、脑梗死、死亡。
图像分析:由1 名15 年和30 年工作经验影像医师和16 年工作经验神经临床医师分别独立阅片,不一致者协商决定。
4、统计学方法
采用SPSS 26.0 软件进行描述性统计,计量资料符合正态分布,用(均数±标准差)表示,计数资料以例数(百分率)表示。采用独立样本t检验、χ2检验对不同预后组患者的一般临床资料进行分析。利用受试者工作特征曲线(ROC)下的面积(AUC)大小来评估不同序列rLMC 评分判断不良预后的预测能力,AUC 值越接近1,预测价值越大,AUC 之间的比较利用MedCalc 15.0 软件采用Hanley&McNeil 法进行分析。假设检验统一使用双侧检验,以P<0.05 为差异有统计学意义。
结 果
1、一般资料
39 例 CMCAO 患者,临床表现头痛、头晕 22 例,头昏1 例,肢体不利 9 例,TIA 2 例,语音不清 2 例,其他手麻、口渴、面瘫等症状3 例。高血压35 例(89.74%),高血脂症21 例(53.85%),糖尿病11 例(28.21%),饮酒9 例(23.08%),吸烟8 例(20.51%)。不同预后组患者一般临床资料比较差异均无统计学意义(均P>0.05)(表1)。

表1 不同预后慢性大脑中动脉闭塞患者一般资料
2、临床及影像学表现
2.1、CMCAO 患者侧支循环的的 SWAN-rLMC 评分与预后进行相关性分析 MRI 显示39 例CMCAO 患者无腔隙性脑梗死27 例(69.23%)(图1A、2A),同侧腔隙性脑梗死7 例(17.95%),对侧5 例(12.82%)。MRA 显示39 例CMCAO 患者,左侧23 例(58.97%)(图1B),右侧16 例(41.03%)。均有偏侧大脑前及后动脉27 例(69.23%),单独偏侧大脑后动脉3例(7.69%),单独偏侧大脑前动脉4例(10.26%),均无偏侧大脑前及后动脉5例(12.82%)。在随访中20例发生不良预后,其中11 例发生脑梗死(图1F),8 例发生TIA,1 例因发生脑出血而死亡。
2.2、2组临床特征和影像评分比较 39例CMCAO 患者中,AVS 在侧支循环不良组中明显多于良好组,SWAN-rLMC 评分侧支循环不良组20 例、占51.28%(图1C~E),良好组19 例、占48.72%(图2C~E)。其中不良组有2 例预后良好,良好组有2 例预后不良。根据SWAN-rLMC 评分划分的区域性软脑膜侧支良好组和不良组的预后并不相同,侧支良好组的预后良好率为89.5%,不良组的预后良好率为10.0%,差异有统计学意义(χ2=24.633,P<0.001)。SWAN-rLMC 评分预测不良预后的ROC见图3,SWAN-rLMC 评分预测不良预后交互点图见图4,SWAN-rLMC 评分判断不良预后的 AUC 值为 0.886(95%CI:0.761~1.000),差异有统计学意义(P<0.001),最佳截断值为12分,此时的灵敏度为90.0%,特异度为89.5%,对判断不良预后具有很好的预测价值。

图1 男,62 岁,反复头晕、头昏1 个月。A:弥散加权成像(DWI)示脑实质未见异常病灶;B:磁共振血管成像(MRA)示左侧大脑中动脉(MCA)的M1 段主干闭塞,偏侧优势大脑前动脉(ACA)和大脑后动脉(PCA);C~E:磁敏感加权血管成像(SWAN)示左侧不对称深髓质静脉(DMV)(短红箭头所示)、不对称皮质静脉征(CVS)阳性(长红箭头所示),SWAN-rLMC(区域性软脑膜侧支)评分18 分(评分不良);F:2年11个月后DWI示左侧半卵圆中心急性腔隙性脑梗死,出院改良Rankin量表(mRS)评分为1分

图2 女,69 岁,头晕5 d,侧支循环良好。A:弥散加权成像(DWI)示脑实质未见异常病灶;B:磁共振血管成像(MRA)示右侧大脑中动脉(MCA)的M1段主干闭塞,右侧优势大脑前动脉;C~E:磁敏感加权血管成像(SWAN)示右侧MCA供血区不对称脉静脉血管征(AVS)阴性,区域性软脑膜侧支(rLMC)评分10分(评分良好),出院改良Rankin量表(mRS)评分为0分

图3 SWAN-rLMC 评分预测39 例CMCAO 患者不良预后的ROC
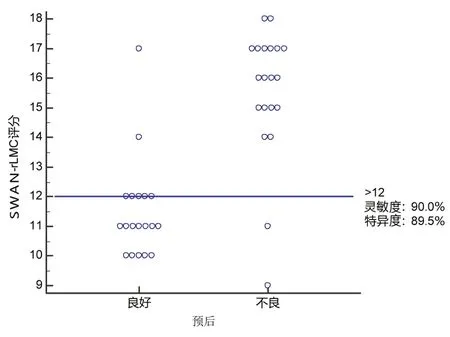
图4 SWAN-rLMC 评分预测39 例CMCAO 患者不良预后交互点图
讨 论
随着MRI迅速发展,不要造影剂及无辐射的TOF-MRA广泛应用,发现CMCAO 越来越多。CMCAO 多在大脑中动脉粥样硬化斑块基础上,血管不断加重最后完全闭塞,有的不出现症状,有的轻微症状,有的TIA、脑卒中,甚至出现大面积脑梗死、脑出血或死亡。临床工作中CMCAO 患者临床症状和预后不一致,这与脑侧支循环有关。侧支循环开放通过Wills’环(1 级)、眼动脉和软脑膜血管(2 级)和新生血管(3 级)。由于大脑中动脉的M1 段位于Wills’环外侧,M1 段慢性闭塞后,Wills’环和眼动脉不能供应大脑中动脉远端血液,这能通过大脑前后动脉与大脑中动脉的软脑膜动脉吻合支供应缺血区域。Marti 等[6]研究发现,大脑中动脉闭塞48~72 h后,脑缺血周围区出现大脑新生血管,这种新生血管增生活跃,容易与软脑膜血管的侧支循环发生沟通。CMCAO 患者通过2级软脑膜血管和3级新生血管供应缺血区域。这是CMCAO 的区域在漫长的血管狭窄过程中狭窄血管周围由低氧诱发的新生小血管生成[7],还有来自颈内动脉终末段、大脑前后动脉、前后交通支等的软脑膜血管供应基底节区,同时可有软脑膜吻合血管开放代偿大脑中动脉远端皮质支血流[8]。
近年来随着高分辨磁共振的SWAN 的临床广泛应用,在AMCAO 患者中出现AVS 比较广泛,在CMCAO 患者中有时出现显著CVS 和DMV。CMCAO 脑组织的缺血耐受及侧支循环代偿程度通过影响缺血区域毛细血管和引流静脉脱氧血红蛋白含量,脱氧血红蛋白增多改变局部磁化率及AVS 显示。对rLMC 基础上进行改良,当CMCAO 后大脑后动脉通过软脑膜血管供应缺血区域,当周围静脉回流发生障碍时,引起AVS扩张,同时深静脉周围静脉回流也发生障碍,引起DMV 扩张,所以增加大脑后动脉供血区、DMV,由原9个区域改为11个区域,评价血管包括软脑膜血管、豆纹静脉及 DMV,共包括 11 个区域共计 24 分,SWAN-rLMC 评分预测不良预后交互点图最佳截断值为12 分,SWAN-rLMC评分>12分为不良组,≤12分为良好。
动脉血中的氧合血红蛋白的电子都是成对的,具有反磁性,在SWAN 上表现为高信号。当它流经毛细血管床时,变为脱氧血红蛋白。脱氧血红蛋白带不成对电子,表现为顺磁性,主要存在于静脉和组织微静脉中,在动脉和组织中的浓度为0。CMCAO 后的脑血流量(cerebral blood flow,CBF)及代谢改变处于动态变化中,通过自动调节和氧摄取分 数(oxygen extraction fraction,OEF)增 加 代 偿 反 应 。CMCAO 后主要通过微循环进行血液循环,慢性脑缺血时微循环中血液从动脉到静脉流动,此时血管舒张、阻力降低,细动脉发生扩张[9]。CBF改变后,在细动脉扩张后细静脉顺应性增强扩张性改变[10]。在CMCAO 的患侧侧支循环不良时,责任血管远端脑组织缺乏其他代偿血流,局部脑灌注压力减低及血流量明显减少,通过增加OEF 来提高脱氧血红蛋白与氧合血红蛋白的比例,毛细血管和小静脉内的脱氧血红蛋白增多,局部无氧代谢产生的乳酸等物质堆积造成血管扩张,随着脱氧血红蛋白含量大幅度增高,局部磁化率改变导致在SWAN 像上出现AVS越明显,反之,侧支循环良好时,缺血脑组织通过代偿血流维持一定灌注压和血流量,局部毛细血管和小静脉内含氧量低于正常脑组织,但其OEF 改善,脱氧血红蛋白含量少,没有引起局部磁化率改变,在SWAN 像上不出现AVS。AVS显示代表着AMCAO 患者侧支循环形成,同时广泛组AVS 征患者最终梗死体积较稀疏组AVS 梗死体积小[2]。CMCAO 患者可长期处于慢性缺血代偿期,侧支循环的血流主要通过软脑膜血管支配脑组织的供血[11-12]。CMCAO 患者出现AVS,说明患侧灌注压力严重减低,超出血管舒张的自我调节机制,CBF 明显减低,细胞通过增加OEF 维持氧代谢和脑功能。处于贫困灌注期,此时细胞结构的完整性存在,积极有效地治疗改善血流可使其恢复,否则引起缺血性脑卒中或脑出血发生。本组39 例CMCAO 患者中,随访中无临床症状有19 例、占48.72%,这是广泛软脑膜侧支吻合供应大脑中动脉闭塞区域却并无临床症状的重要因素,这与文献报道相一致[13]。20 例发生不良预后,其中11 例发生脑梗死,8 例发生TIA,1 例因发生脑出血而死亡,这是CMCAO 软脑膜侧支循环代偿不足,血流调节机制受损而CBF降低,则易导致脑卒中发生。SWAN-rLMC 评分侧支循环不良组20例、占51.28%,良好组19 例、占48.72%。根据SWAN-rLMC 评分划分的区域性软脑膜侧支良好组和不良组的预后并不相同,侧支良好组的良好预后率为89.5%,不良组为10.0%,差异有统计学意义(χ2=24.633,P<0.001)。SWAN-rLMC 评分判断不良预后的AUC 值分别为0.886(95%CI:0.761~1.000),差异有统计学意义(P<0.001),最佳截断值为12 分,此时的灵敏度为90.0%,特异度为89.5%,对判断不良预后具有很好的预测价值。这说明侧支循环可影响AVS 显示,侧支循环良好患者脱氧血红蛋白含量较低,局部磁化率越轻,反之,侧支循环不良患者脱氧血红蛋白含量高,局部磁化率越高,AVS显示显著,代表着缺氧越明显,同时静脉回流发生障碍,可能预示远期预后不良。
局限性:1、单中心小样本量的回顾性研究;2 初步应用改良rLMC 评分评估CMCAO 的侧支循环状态,将来可进一步CT 血管成像、CT 灌注扫描或数字减影血管造影检查来验证CMCAO患者侧支循环与AVS的关系。
初步研究表明侧支循环状态可以影响CMCAO 患者AVS 显示,提出SWAN-rLMC 评分改良评估CMCAO 患者预后时,要考虑侧支循环代偿状态。即侧支循环良好时,不需要临床积极治疗。侧支循环不良时,出现AVS代表CMCAO患侧长期处贫困灌注期逐渐向失代偿期发展,缺血进一步加重,需要临床积极干预,防止脑卒中发生和及加重老年痴呆程度。
利益冲突所有作者均声明不存在利益冲突

