缺血预适应在急性缺血性脑卒中颅内动脉狭窄中的应用
娄博 冯博
聊城市第三人民医院神经内科,聊城 252000
脑血管疾病中急性缺血性脑卒中(acute ischemic stroke,AIS)发病率占60%~70%,主要是由血管阻塞、脑血管破裂、椎动脉/颈动脉狭窄等引起大脑供血不足导致脑组织损伤,其具有较高致死率、致残率[1-4]。研究显示AIS动脉病变时肥大细胞可释放蛋白酶、炎性因子等,并可促进血管生成,进而参与颅内血管狭窄发生过程[5]。缺血预适应(ischemic preconditioning,IP)是指采用缺血训练仪对双上肢进行短暂缺血/再灌注治疗,以此减轻其他器官或组织缺血/再灌注损伤,可增强机体抗缺血损伤能力,研究表明IP对急性ST 段抬高型心肌梗死患者冠状动脉侧肢循环的形成具一定促进作用,并可改善患者预后[6]。IP 可通过体液通路、免疫反应、神经通路等保护脑组织,脑组织缺血状态下,IP 可促进血管生成相关基因表达,减少其血流量,增加血管密度,并可促使腺苷、谷氨酸盐释放,抑制神经递质兴奋性,进而减轻脑组织缺血/再灌注损伤[7]。本研究主要探讨IP 对AIS 颅内动脉狭窄患者的治疗效果及其可能应用价值,为临床诊疗提供参考。
资料与方法
1、一般资料
选取2020年2月至2021年8月聊城市第三人民医院收治的105例AIS颅内动脉狭窄患者为研究对象,随机数字表法分为对照组52 例、观察组53 例。对照组:男33 例、女19 例;年龄 50~70(63.28±2.06)岁;病程 1~2(1.46±0.15)周;卒中部位:内囊16 例、基底节22 例、其他14 例。观察组:男 30 例、女23 例;年龄 50~71(63.30±2.09)岁;病程1~3(1.52±0.17)周;卒中部位:内囊 20 例、基底节 24 例、其他9例。两组一般资料比较差异均无统计学意义(均P>0.05),具可比性。
本研究经聊城市第三人民医院伦理委员会批准(批准号20200512),所有患者及其家属知情且签署知情同意书。
2、纳入与排除标准
纳入标准:所有患者均符合 AIS 诊断标准[8],且经 CT 血管造影(CTA)显示为颅内动脉狭窄;凝血功能正常者;近期未服用抗凝药物者。排除标准:脑梗死出血转化者;四肢血管缺血性疾病者;严重颅脑外伤者;合并心源性栓塞者;颅内感染者。
3、方法
对照组口服阿托伐他汀钙片(福建东瑞制药有限公司,国药准字H20193043,规格:10 mg)+阿司匹林肠溶片(石药集团欧意药业有限公司,国药准字H20153035,规格:100 mg),阿托伐他汀钙片用量为20 mg/次,1 次/d,阿司匹林肠溶片用量为100 mg/次,1 次/d,连续治疗4 周。观察组在对照组基础上给予IP 治疗:患者平卧位/半坐位,采用HMBS-1000A 型缺血预适应训练仪(北京格美胜达医疗设备有限公司)分别套入双侧上肢,传导压力管贴在上臂内侧,开启训练仪,气囊内充入气体,气压为180 mmHg(1 mmHg=0.133 kPa),充气5 min,释放气压,重复5 次,每次间隔5 min,2次/d,连续治疗4周。
4、观察指标
(1)比较两组治疗效果[9]:显效:美国国立卫生研究院卒中量表(NIHSS)评分相较于治疗前减低幅度≥91%,临床症状完全好转;有效:18%≤NIHSS评分减低幅度<91%,临床症状部分消失;无效:NIHSS 评分减低幅度<18%,临床症状未见好转。总有效率(%)=[(显效例数+有效例数)/总例数]×100%。(2)比较治疗前后两组NIHSS、改良Rankin 量表(mRS)评分:NIHSS 用于评估患者神经功能损伤程度,分值越高表明神经功能损伤加重[10];mRS 用于评估患者综合生活能力,包括无症状(1 分)、有症状但未见明显残障(2 分)、轻度残障(3 分)、中度残障(4 分)、重度残障(5 分)、严重残障(6 分)[11]。(3)比较治疗前后两组血管弹性指标:采用Philips HD7 型彩色多普勒超声(飞利浦)检查血管弹性指标,包括血管压力-应变弹性系数(Ep)、顺应性(AC)、增大指数(AI)、脉搏波传导速度(PWVβ)。(4)比较治疗前后两组内皮功能指标:分别于治疗前后采集外周静脉血5 ml,离心10 min吸取上清(3 500 r/min,离心半径10 cm),采用酶联免疫吸附法(ELISA)检测假血友病因子(vWF)、内皮素1(ET-1)水平,采用酶法检测一氧化氮(NO)水平,武汉艾美捷公司提供vWF、ET-1 检测试剂盒,上海酶联生物提供NO 检测试剂盒。(5)比较治疗前后两组低密度脂蛋白受体相关蛋白6(LRP6)、超敏C-反应蛋白(hs-CRP)、颈动脉内膜中层厚度(IMT)变化:ELISA 检测血清LRP6水平,武汉艾美捷公司提供检测试剂盒;采用免疫透射比浊法检测hs-CRP 水平,罗氏制药公司提供检测试剂盒;使用GELOGIQ E9 型颈动脉超声仪(美国GE公司)检测IMT。
5、随访
以电话、门诊复查等方式进行随访,出院后开始随访,时间为6 个月,采用格拉斯哥预后量表(GOS)评估预后情况:包括恢复良好、轻度残疾、重度残疾、植物状态、死亡,计算预后良好率[(恢复良好例数+轻度残疾例数)/总例数×100%][12]。
6、统计学分析
采用统计学软件SPSS 22.0 对数据进行分析,计量资料均符合正态分布,以均数±标准差()表示,组间比较采用独立样本t检验,组内治疗前后比较采用配对t检验;计数资料用例(%)表示,采用χ2检验;以P<0.05为差异有统计学意义。
结 果
1、比较两组治疗效果
对照组显效17 例、有效25 例、无效10 例;观察组显效28 例、有效22 例、无效3 例。观察组总有效率94.34%(50/53)高于对照组80.77%(42/52)(χ2=4.456,P=0.035)。
2、比较两组NIHSS、mRS评分
治疗前两组NIHSS、mRS 评分比较差异均无统计学意义(均P>0.05);治疗后两组NIHSS、mRS 评分均低于治疗前,且观察组低于对照组,差异均有统计学意义(均P<0.05)。见表1。
表1 两组急性缺血性脑卒中颅内动脉狭窄患者治疗前后NIHSS、mRS评分比较(分,)

表1 两组急性缺血性脑卒中颅内动脉狭窄患者治疗前后NIHSS、mRS评分比较(分,)
注:对照组口服阿托伐他汀钙片、阿司匹林肠溶片,观察组在对照组基础上给予缺血预适应治疗;NIHSS为美国国立卫生研究院卒中量表,mRS为改良Rankin量表;与同组治疗前比较,aP<0.05
mRS 5.11±1.03 5.16±1.07 0.244 0.808 3.02±0.26a 4.03±0.33a 17.438<0.001时间治疗前例数53 52治疗后组别观察组对照组t值P值观察组对照组t值P值53 52 NIHSS 12.24±2.08 12.31±2.19 0.168 0.867 7.16±1.38a 9.49±1.75a 7.583<0.001
3、比较两组血管弹性指标
治疗前两组血管弹性指标比较差异均无统计学意义(均P>0.05);与治疗前相比,治疗后两组Ep、AI、PWVβ 降低,AC 升高,且观察组改变幅度大于对照组,差异均有统计学意义(均P<0.05)。见表2。
表2 两组急性缺血性脑卒中颅内动脉狭窄患者治疗前后血管弹性指标比较()
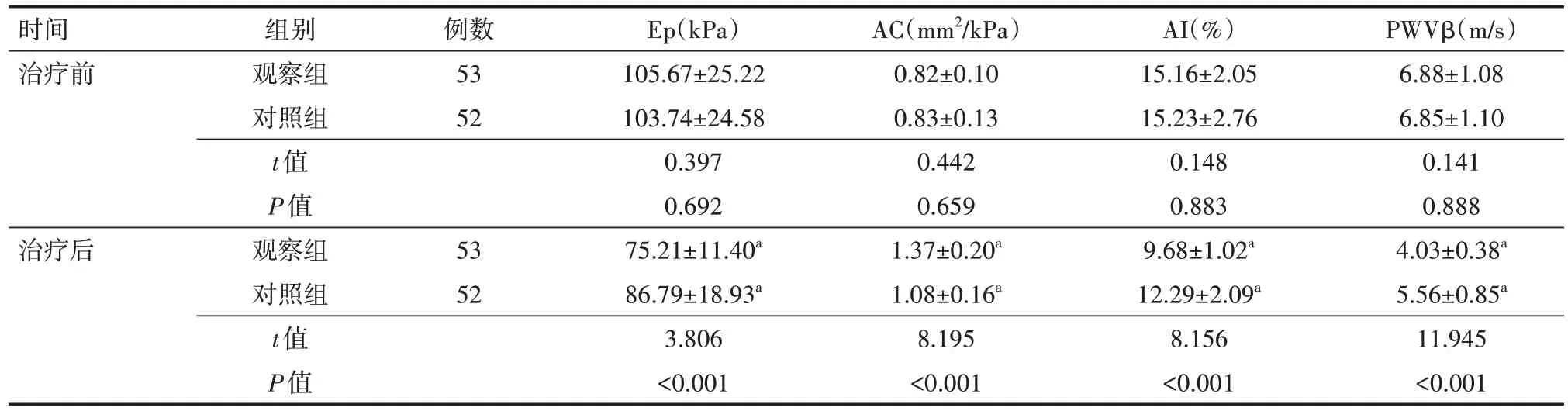
表2 两组急性缺血性脑卒中颅内动脉狭窄患者治疗前后血管弹性指标比较()
注:对照组口服阿托伐他汀钙片、阿司匹林肠溶片,观察组在对照组基础上给予缺血预适应治疗;Ep为血管压力-应变弹性系数,AC 为顺应性,AI为增大指数,PWVβ为脉搏波传导速度;与同组治疗前比较,aP<0.05
PWVβ(m/s)6.88±1.08 6.85±1.10 0.141 0.888 4.03±0.38a 5.56±0.85a 11.945<0.001时间治疗前例数53 52治疗后组别观察组对照组t值P值观察组对照组t值P值53 52 Ep(kPa)105.67±25.22 103.74±24.58 0.397 0.692 75.21±11.40a 86.79±18.93a 3.806<0.001 AC(mm2/kPa)0.82±0.10 0.83±0.13 0.442 0.659 1.37±0.20a 1.08±0.16a 8.195<0.001 AI(%)15.16±2.05 15.23±2.76 0.148 0.883 9.68±1.02a 12.29±2.09a 8.156<0.001
4、比较两组内皮功能指标
治疗前两组内皮功能指标比较差异均无统计学意义(均P>0.05);治疗后两组vWF、ET-1 低于治疗前,NO 水平高于治疗前,且观察组变化幅度优于对照组,差异均有统计学意义(均P<0.05)。见表3。
表3 两组急性缺血性脑卒中颅内动脉狭窄患者治疗前后内皮功能指标比较()

表3 两组急性缺血性脑卒中颅内动脉狭窄患者治疗前后内皮功能指标比较()
注:对照组口服阿托伐他汀钙片、阿司匹林肠溶片,观察组在对照组基础上给予缺血预适应治疗;vWF 为假血友病因子,ET-1为内皮素1,NO为一氧化氮;与同组治疗前比较,aP<0.05
NO(ng/L)63.21±11.07 62.19±10.73 0.479 0.633 80.19±18.73a 71.03±21.66a 2.319 0.022时间治疗前例数53 52治疗后组别观察组对照组t值P值观察组对照组t值P值53 52 vWF(%)96.25±20.83 96.47±21.56 0.053 0.958 67.73±15.76a 82.16±17.38a 4.458<0.001 ET-1(%)91.78±20.59 90.27±18.92 0.391 0.697 55.49±10.49a 76.18±16.39a 7.719<0.001
5、比较两组LRP6、hs-CRP、IMT变化
治疗前两组LRP6、hs-CRP、IMT 水平比较差异均无统计学意义(均P>0.05);相较于治疗前,治疗后两组LRP6 水平升高,hs-CRP 水平、IMT 降低(均P<0.05);与对照组比较,治疗后观察组 LRP6 水平升高,hs-CRP 水平、IMT 降低,差异均有统计学意义(均P<0.05)。见表4。
表4 两组急性缺血性脑卒中颅内动脉狭窄患者治疗前后LRP6、hs-CRP、IMT变化比较()
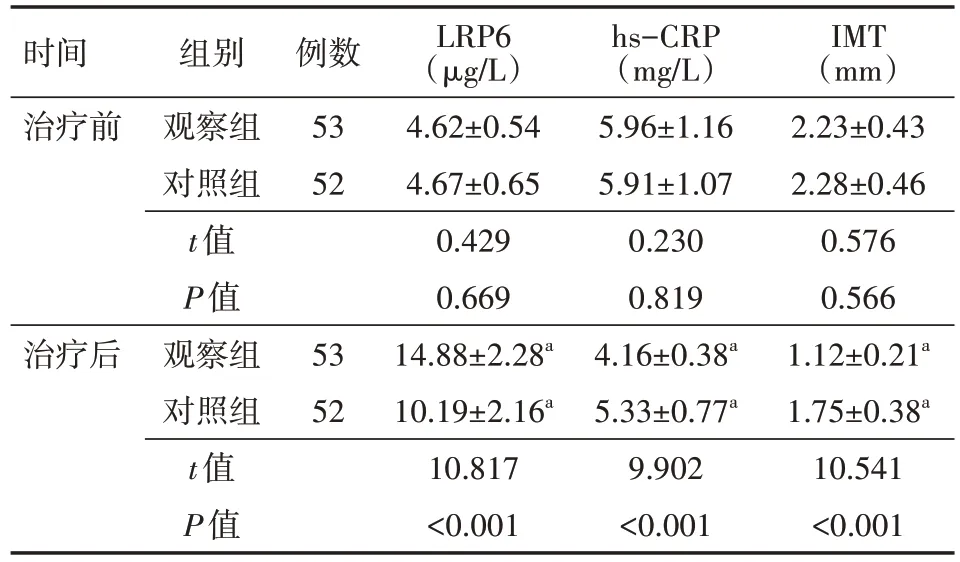
表4 两组急性缺血性脑卒中颅内动脉狭窄患者治疗前后LRP6、hs-CRP、IMT变化比较()
注:对照组口服阿托伐他汀钙片、阿司匹林肠溶片,观察组在对照组基础上给予缺血预适应治疗;LRP6 为低密度脂蛋白受体相关蛋白6,hs-CRP 为超敏C-反应蛋白,IMT 为颈动脉内膜中层厚度;与同组治疗前比较,aP<0.05
IMT(mm)2.23±0.43 2.28±0.46 0.576 0.566 1.12±0.21a 1.75±0.38a 10.541<0.001时间治疗前例数53 52治疗后组别观察组对照组t值P值观察组对照组t值P值53 52 LRP6(μg/L)4.62±0.54 4.67±0.65 0.429 0.669 14.88±2.28a 10.19±2.16a 10.817<0.001 hs-CRP(mg/L)5.96±1.16 5.91±1.07 0.230 0.819 4.16±0.38a 5.33±0.77a 9.902<0.001
6、比较两组预后情况
随访6 个月后,对照组失访3 例,观察组失访4 例。对照组(49 例)恢复良好22 例、轻度残疾16 例、重度残疾5 例、植物状态5 例、死亡1 例;观察组(49 例)恢复良好29 例、轻度残疾18 例、重度残疾1 例、植物状态1 例,无死亡病例。观察组预后良好率95.92%(47/49)高于对照组77.55%(38/49),差异有统计学意义(χ2=7.184,P=0.007)。
讨 论
阿托伐他汀钙片、阿司匹林肠溶片可用于治疗AIS,可改善/恢复缺血组织的血液循环,稳定血管粥样病变,改善高血脂症,调节血脂水平,并可抑制血小板聚集[13-16]。但治疗周期延长时患者体内形成不同抗体导致治疗效果降低。
AIS 颅内动脉狭窄患者恢复血流灌注后可加重神经元缺血性损伤,IP可促使脑组织生成内源性保护机制,其对后续致死性脑组织损伤可产生一定耐受性,并可促进内源性递质生成、释放,激活相关信号通路,抑制神经元凋亡,减小脑组织缺血灶,改善其功能障碍,减轻脑组织损伤[17-19]。研究显示IP可降低凋亡因子水平,改善神经功能,其作用机制与调控Notch1 信号通路有关[20-21]。IP 可减少氧自由基生成量,抑制炎性反应,维持NO 含量稳定性,减轻缺血/再灌注损伤[22-24]。针对双侧上肢进行IP 安全性较高,上肢局部加压可引起局部组织缺血、缺氧,激活机体内源性保护因子,抵抗脑组织缺血损伤,研究显示IP可减少炎性因子、氧化应激产物释放量,并可增加脑基底节/丘脑血流量,减轻脑水肿、缺血损伤[25-27]。本研究结果显示,观察组总有效率高于对照组,NIHSS、mRS 评分低于对照组,血管弹性指标改善程度优于对照组,提示IP 可提高AIS 颅内动脉狭窄治疗效果,改善神经功能损伤,提高患者综合生活能力。这可能是因为大脑缺血/再灌注损伤可影响脑组织氧合功能,促使脑组织损伤,IP可提高脑组织对缺血损伤的耐受性,可调节内源保护因子,通过多效能、多靶点方式抵抗脑组织损伤,并可减少神经元凋亡数目,提高神经功能。
颅内动脉狭窄与血管内皮功能障碍有关,血管内皮细胞、巨噬细胞合成/分泌vWF,其水平升高可增加血栓发生风险;ET-1可调节血管缩张功能,减低血管内皮依赖性舒张功能,促进血小板聚集;T细胞、巨噬细胞、多形核蛋白细胞激活后可生成氧自由基,促进NO生成,血管内皮功能损伤时NO水平降低[28]。本研究结果显示,治疗后观察组vWF、ET-1水平低于对照组,NO水平高于对照组,提示IP可改善患者血管内皮功能。分析原因可能为IP可激活机体自我保护机制,并调节相关内源性递质水平,调控部分信号通路表达,进而改善血管内皮功能障碍。AIS颅内动脉狭窄发生与炎性反应密切相关,LRP6属于炎性介质,可抑制血管平滑肌细胞生长/增殖,并可能调节Wnt 信号通路,进而改善动脉狭窄程度[29]。AIS发生过程中hs-CRP水平升高,并可促进炎性介质释放,提高内皮细胞黏附因子表达量,促使内皮功能紊乱,进而促进血管狭窄发生,同时hs-CRP可促进血管内皮细胞增殖、迁移,进一步增加IMT,最终引起血管狭窄,研究表明AIS患者血清hs-CRP水平、IMT均与动脉狭窄程度/分支血管数量/神经功能损伤呈正相关[30]。本研究结果显示,治疗后观察组LRP6水平高于对照组,hs-CRP水平、IMT低于对照组,提示IP可降低hs-CRP水平,增高LRP6水平,减低IMT,进而改善颅内动脉狭窄,减轻神经功能损伤。分析原因可能为IP可调节Wnt等炎性信号通路,降低炎性因子水平,通过神经、自身反应调节等纠正内皮功能紊乱,改善机体内环境,减缓颅内动脉狭窄发展进程。同时本研究发现观察组预后良好率高于对照组,提示IP可改善AIS颅内动脉狭窄患者预后。分析原因可能为IP可激发机体内在保护机制,对远端肢体进行缺血刺激可提高患者对缺血/再灌注损伤的耐受力,并可减轻缺血所致脑损伤,改善患者预后。
综上所述,IP 可提高AIS 颅内动脉狭窄治疗效果,减缓神经功能损伤,提高生活质量,改善血管弹性、内皮功能,抑制炎性反应,改善患者预后情况,具有一定临床应用价值。
利益冲突所有作者均声明不存在利益冲突

