白簕中性多糖对2型糖尿病小鼠肠道二糖酶的调节作用
刘悦,杨慧文,林榆子,潘静华,廖程娟,潘育方
(广东药科大学药学院,广东广州 510006)
2 型糖尿病(Type 2 Diabetes Mellitus,T2DM)属于慢性代谢紊乱疾病,患者因肝脏糖脂代谢受损,从而导致胰岛素抵抗和血糖升高[1]。最新流行病学调查数据显示[2],截至2020年我国的2 型糖尿病患病率已高达11.2%,患病人数位居世界第一。为了应对糖尿病,全球每年的投入超过8270 亿美元,其中中国政府每年投入近250 亿美元,占医疗总支出的13%,可见我国糖尿病防治工作仍面临巨大挑战。天然植物多糖是由10 个以上单糖分子通过糖苷键连接而成的天然高分子聚合物[3],参与生物体各项生命活动,来源广泛、低毒、副作用小,越来越多的研究表明,天然植物多糖具有良好的降糖效果,探究其在防治糖尿病方面的应用已成为热点。
白簕(Acanthopanax trifoliatus(L.) Merr)为五加科五加属攀援状灌木,民间以“簕菜”而著名。簕菜是人们日常生活中喜爱吃的野生蔬菜和营养保健食品,其作为蔬菜用于食疗有着悠久的历史。目前恩平簕菜已被评为“国家农产品地理标志产品”。本课题组在对白簕粗多糖进行分离纯化后,得到均一组分白簕中性多糖ATP1-1,其重均相对分子质量Mw为2,310,分布系数D为1.02,主要由葡萄糖、鼠李糖、半乳糖、甘露糖组成,摩尔比为5.52:0.63:0.62:0.56[4]。前期研究发现,ATP1-1 具有降糖功效,是一种潜在的降糖保健食品。然而由于较大的分子量和良好的水溶性,天然活性多糖大多口服生物利用度较差[5,6],ATP1-1 也具有类似的特点,因此通过肠道相关靶点发挥降糖作用可能是ATP1-1 改善糖尿病的机制之一。肠道上的α-葡萄糖苷酶是治疗2 型糖尿病的一个重要靶点,其活性增加可加速碳水化合物在肠道内的分解,使肠道对糖的吸收加快,最终引起餐后血糖升高[7,8]。小肠刷状缘上皮细胞上的二糖酶-蔗糖酶、麦芽糖酶皆属于α-葡萄糖苷酶,研究表明[9-11],植物多糖多具有较强的二糖酶抑制活性,其可通过抑制该酶使碳水化合物的消化延迟,进而导致小肠分泌细胞碳水化合物浓度增加,小肠分泌细胞中富含胰高血糖素样肽-1(GLP-1),碳水化合物的浓度增加可通过渗透作用进一步刺激GLP-1 的分泌,从而促进胰岛素生成和降低胰高血糖素分泌[12,13]。基于以上,本研究拟探讨ATP1-1 对2型糖尿病小鼠肠黏膜上二糖酶的影响,并对肠道上GLP-1 的表达进行测定,考察ATP1-1 是否通过影响肠道二糖酶进而对机体血糖产生多方面的调节作用,为白簕多糖在开发保健食品方面的应用提供理论基础。
1 材料与方法
1.1 材料
1.1.1 仪器与设备
超低温冰箱,中科美菱低温科技有限公司;5418R低温高速离心机,德国Eppendorf 公司;FA1004 分析天平,上海右一仪器有限公司;数显恒温水浴锅,北京精科华瑞仪器有限公司;Thermo Scientific Mulitskan Sky 全波长酶标仪,赛默飞(中国)有限公司;JXFSTPRP-24 全自动样品快速研磨仪,上海净信实业发展有限公司;Nano-100 微量分光光度计,杭州奥盛仪器有限公司;C1000TMThermal cycle PCR、C1000TouchTMThermal cycle 荧光定量PCR 仪,美国Bio-Rad 公司。
1.1.2 药物与试剂
白簕采购于广东省恩平市,经广东药科大学刘基柱副教授鉴定为五加科植物白簕(Acanthopanax trifoliatus(L.) Merr.),标本保存于广东药科大学中药学院标本馆。白簕中性多糖ATP1-1 具体提取方法见文献[4]。
链脲佐菌素,美国Sigma 公司;柠檬酸-柠檬酸钠缓冲液(pH 值4.5,vigonob);阿卡波糖,上海麦克林生化科技有限公司;葡萄糖、蔗糖,广东光华科技股份有限公司;麦芽糖,天津市大茂化学试剂厂;蔗糖酶、麦芽糖酶活性测定试剂盒、葡萄糖测定试剂盒、蛋白测定试剂盒,南京建成生物有限公司;磷酸钾缓冲液,北京雷根生物技术有限公司;血糖试纸、血糖仪(安稳型),长沙三诺生物传感技术股份有限公司;PrimeScriptTMRT Reagent Kit with gDNA Eraser 试剂盒、SYBR Green Pro Taq HS 预混型qPCR 试剂盒,武汉艾瑞科生物科技有限公司。
1.1.3 动物及饲料
SPF 级C57BL/6 雄性小鼠购于广东省医学实验动物中心,(18.0±2.0)g,实验动物生产许可证编号:SCXK(粤)2018-0002。所有动物均饲养于广东药科大学实验动物中心,实验动物使用许可证编号:SYXK(粤)2017-0125。所有方案均通过广东药科大学实验动物中心伦理委员会批准。
基础饲料购自广东省广州市广东药科大学动物实验中心。高脂饲料脂肪质量分数为33.8%,由北京博爱港生物技术有限公司制备。所用配方在文献[14]的基础上进行调整(质量分数):基础饲料58.5%、蔗糖15%、猪油10%、酪蛋白10%、奶粉5%、胆固醇1%、胆酸钠0.05%。
1.2 方法
1.2.1 模型制备
按文献[15]所述方法采用高脂饲料联合一次大剂量注射链脲佐菌素(Streptozotocin,STZ)诱导2 型糖尿病小鼠模型。选取60 只C57BL/6 雄性小鼠,SPF环境普通饲料适应性喂养1 周后,按体重随机分为正常组(n=10)和造模组(n=50)。正常组饲喂普通饲料,造模组饲喂高脂饲料。4 周后,小鼠禁食不禁水过夜,造模组腹腔注射STZ(130 mg/kg,pH 值为4.5的柠檬酸-柠檬酸钠缓冲液避光冰浴配制,现配现用),于注射后第7 天、第10 天将小鼠禁食6 h,测量其空腹血糖值(FBG),以FBG≥16.7 mmoL/L 筛选成模小鼠。
1.2.2 给药治疗
将成模小鼠按血糖随机均分为四组:模型组、二甲双胍组(185 mg/(kg·d))、ATP1-1 高剂量组(80 mg/(kg·d))、ATP1-1 低剂量组(40 mg/(kg·d)),另设正常组,给药8 周,模型组与正常组灌胃等量的生理盐水。实验期间每7 d 测量并记录小鼠体重、饮食饮水及空腹血糖。给药期间所有成模小鼠均持续以高脂饲料喂养。
1.2.3 口服葡萄糖、蔗糖、麦芽糖耐量试验
1.2.3.1 口服葡萄糖耐量试验(OGTT)
于给药第8 周,小鼠禁食不禁水6 h,测定所有小鼠空腹血糖值作为0 min血糖值,随后灌胃给予2.0 g/kg葡萄糖,测定15、30、60、90、150 min 的血糖值,并计算血糖-时间曲线下面积(AUC)评价糖耐量:

式中:
A、B、C、D、E、F——分别代表0、15、30、60、90、150 min 的血糖值。
1.2.3.2 口服蔗糖耐量试验(OSTT)
于给药第8 周,小鼠隔夜禁食不禁水12 h,测定所有小鼠空腹血糖值作为0 min 血糖值,随后各组小鼠灌胃给药,并于30 min 后给予4.0 g/kg 蔗糖溶液,测定30、60、90、120、150、180 min 的血糖值,并计算血糖-时间曲线下面积AUC评价糖耐量:

式中:
A、B、C、D、E、F、G——分别代表0、30、60、90、120、150、180 min 的血糖值。
1.2.3.3 口服麦芽糖耐量试验(OMTT)
于给药第8 周,小鼠隔夜禁食不禁水12 h,测定所有小鼠空腹血糖值作为0 min 血糖值,随后各组小鼠灌胃给药,并于30 min 后给予3.0 g/kg 麦芽糖溶液,测定30、60、90、120、180 min 的血糖值,并计算血糖-时间曲线下面积AUC评价糖耐量:
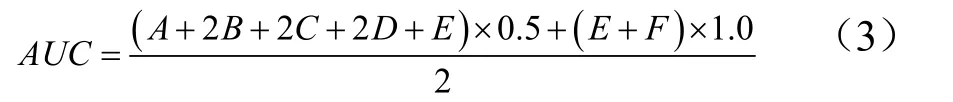
式中:
A、B、C、D、E、F——分别代表0、30、60、90、120、180 min 的血糖值。
1.2.4 ATP1-1 对蔗糖酶、麦芽糖酶活性的体内抑制作用
于给药治疗结束后,取小鼠的十二指肠、空肠、回肠各2 cm,生理盐水冲洗内容物并进行称重。沿中线纵向剪开各肠段,载玻片轻轻刮取肠黏膜,随后用预冷的生理盐水(m:V=1:9)冲洗至1.5 mL 离心管中,研磨仪-30 ℃,60 Hz,60 s,连续匀浆2 次。匀浆混悬液4 ℃,4 000 r/min,离心10 min,吸取上清。用Bradford 蛋白试剂盒测定上清液蛋白含量,并根据二糖酶活性试剂盒测定各肠段蔗糖酶、麦芽糖酶的活性情况。以在37 ℃ pH 值为6.0 的条件下,每毫克蛋白组织每分钟水解1 nmol蔗糖或麦芽糖定义为1个酶活力单位。
1.2.5 ATP1-1 对回肠上SI、GLP-1 表达的影响
取小鼠回肠测定蔗糖酶-异麦芽糖酶复合物(Sucrase-Isomaltase,SI)和GLP-1 的mRNA 表达,采用Trizol 试剂法提取总RNA,利用微量分光光度计检测样本核酸的OD 值,根据PrimeScriptTMRT Reagent Kit with gDNA Eraser 试剂盒合成cDNA,反应条件为:42 ℃,2 min。运用SYBR 法测定各基因表达情况,实时荧光定量PCR(qRT-PCR)反应条件为:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火30 s,40 个循环。以β-actin 为内参基因,引物序列见表1。各目的基因的相对表达量采用2-∆∆Ct法测定。

表1 引物序列Table 1 Sequences of the primers
1.2.6 ATP1-1 对蔗糖酶、麦芽糖酶活性的体外抑制作用
试验参照文献[16]并稍加修改,取健康C57BL/6 小鼠十二指肠,加入10 倍预冷的磷酸钾缓冲液,研磨仪-30 ℃,60 Hz,60 s,连续匀浆3 次。匀浆混悬液4 ℃,2 500 r/min,离心15 min,吸取上清液作为酶溶液。
10 mL 试管中加入缓冲液、各浓度白簕中性多糖溶液(10 000、7 000、5 000、4 000、3 000、2 000、1 000、400、200、50、10、4 μg/mL)或阿卡波糖溶液(400、300、200、100、50、25、10 μg/mL)、蔗糖56 mmol/L 或麦芽糖7 mmol/L 各500 μL,37 ℃水浴孵育5 min,添加500 μL 酶液,在37 ℃水浴下反应45 min,最后,沸水浴5 min 进行灭酶。以底物水解生成葡萄糖的量反映蔗糖酶和麦芽糖酶的活性。通过不同浓度ATP1-1 对蔗糖酶或麦芽糖酶的活性抑制率计算半数抑制浓度(IC50)。抑制率计算公式为:

式中:
H——抑制率,%;
A1——样品组吸光度;
A2——样品对照组吸光度;
A0——空白组吸光度;
A3——阴性对照组吸光度。
以阿卡波糖代替白簕中性多糖作为阳性对照。样品组:样品+底物+酶液;样品对照组:样品+底物+缓冲液;空白组:缓冲液+底物+酶液;阴性对照组:缓冲液+底物+缓冲。
1.3 数据分析
采用Excel 和Graphpad prism 6.0 进行统计分析和作表作图,数据处理后表示为平均值±标准差(X±SD)。两组数据采用Dunnet-t 进行比较,组间多组数据采用LSD 法进行多重比较。
2 结果与讨论
2.1 ATP1-1 对糖尿病小鼠体重、饮食饮水的影响
“三多一少”症状是观察糖尿病最直观的指标。如表2所示,与正常组小鼠相比,造模成功的小鼠体重下降了14.70%,饮食量、饮水量分别增加了18.89%、224.55%,具有明显的糖尿病多饮、多食、体重减轻症状。给药8 周后,各给药组小鼠与模型组小鼠相比,体重明显上升(p<0.05),饮食饮水量显著下降(p<0.01),且ATP1-1 高、低剂量组与二甲双胍组相比各指标均无显著性差异(p>0.05),其中各给药组对小鼠饮水量的改善最为明显,与模型组相比分别下降了40.66%、34.15%、37.58%。宿世震等[17]在研究南瓜多糖对2 型糖尿病小鼠糖脂代谢的影响中发现,造模后糖尿病小鼠出现多饮、多食、多尿、体重减轻的现象,且在给予南瓜多糖治疗后,以上症状均得到明显改善,这与本研究的结果相似,说明ATP1-1 可使糖尿病小鼠的体重及饮食饮水量趋向于正常小鼠。

表2 ATP1-1 对糖尿病小鼠的体重、饮食饮水的影响Table 2 Effects of ATP1-1 on body weight,diet and water intake in diabetic mice
2.2 ATP1-1 对糖尿病小鼠空腹血糖的影响
连续8 周监测各组小鼠血糖变化情况,如图1所示,与正常组相比,造模后各组小鼠空腹血糖值均明显升高,表现为高血糖。给药治疗8 周后,模型组血糖为23.65 mmol/L,与模型组相比,各给药组血糖均明显下降,二甲双胍效果最优,下降了40.94%,ATP1-1高、低剂量组血糖浓度分别下降了27.06%、19.96%(p<0.01)。正常组始终维持在5.73 mmol/L,给药治疗后虽未能达到正常水平,但有明显的改善效果。与化学药物相比,植物多糖[18]疗效好、毒副作用小、不良反应少,其在2 型糖尿病治疗方面应用的研究日渐增多,如沙蒿籽多糖、羊栖菜多糖、灵芝多糖、黄秋葵多糖、太子参多糖等[19-23],本实验结果表明白簕中性多糖ATP1-1 也可以有效降低2 型糖尿病小鼠空腹血糖值,具有开发价值。

图1 ATP1-1 对糖尿病小鼠空腹血糖的影响Fig.1 Effects of ATP1-1 on FBG in diabetic mice
2.3 ATP1-1 对小鼠糖耐量的调节作用
为了测定ATP1-1 对葡萄糖、蔗糖及麦芽糖耐受的影响,对各组小鼠进行了口服葡萄糖、蔗糖及麦芽糖耐量实验。如图2所示,在OGTT 试验中,口服给予葡萄糖15 min 后各组小鼠血糖达到峰值。30 min 后二甲双胍组与ATP1-1 高剂量组血糖开始回落,1 h 后各给药组血糖值明显下降。计算AUC 可知,模型组AUC 约为正常组的3.08 倍(p<0.01),给药治疗后,与模型组相比各组小鼠AUC 均明显降低(p<0.01),且ATP1-1 高、低剂量组结果与二甲双胍组相比均无明显差异(p>0.05),二者相比模型组,AUC 分别降低了17.67%、9.50%。葡萄糖耐量可反应机体对葡萄糖的耐受能力,葡萄糖耐量异常提示胰岛素敏感性降低和β细胞功能受损,此为2 型糖尿病发病的病理生理学基础上的关键决定因素[24]。AUC 作为反映血糖的一种指标,其比单点的血糖值更能全面地分析血糖波动的时间和程度,该值越小,表明糖耐量改善程度越高,机体血糖恢复能力强[25]。本实验结果提示ATP1-1 可改善2 型糖尿病小鼠葡萄糖耐量,且在该实验条件下,效果与玉米须多糖(20.05%)[26]、南瓜多糖(15.07%~27.97%)[17]等类似。
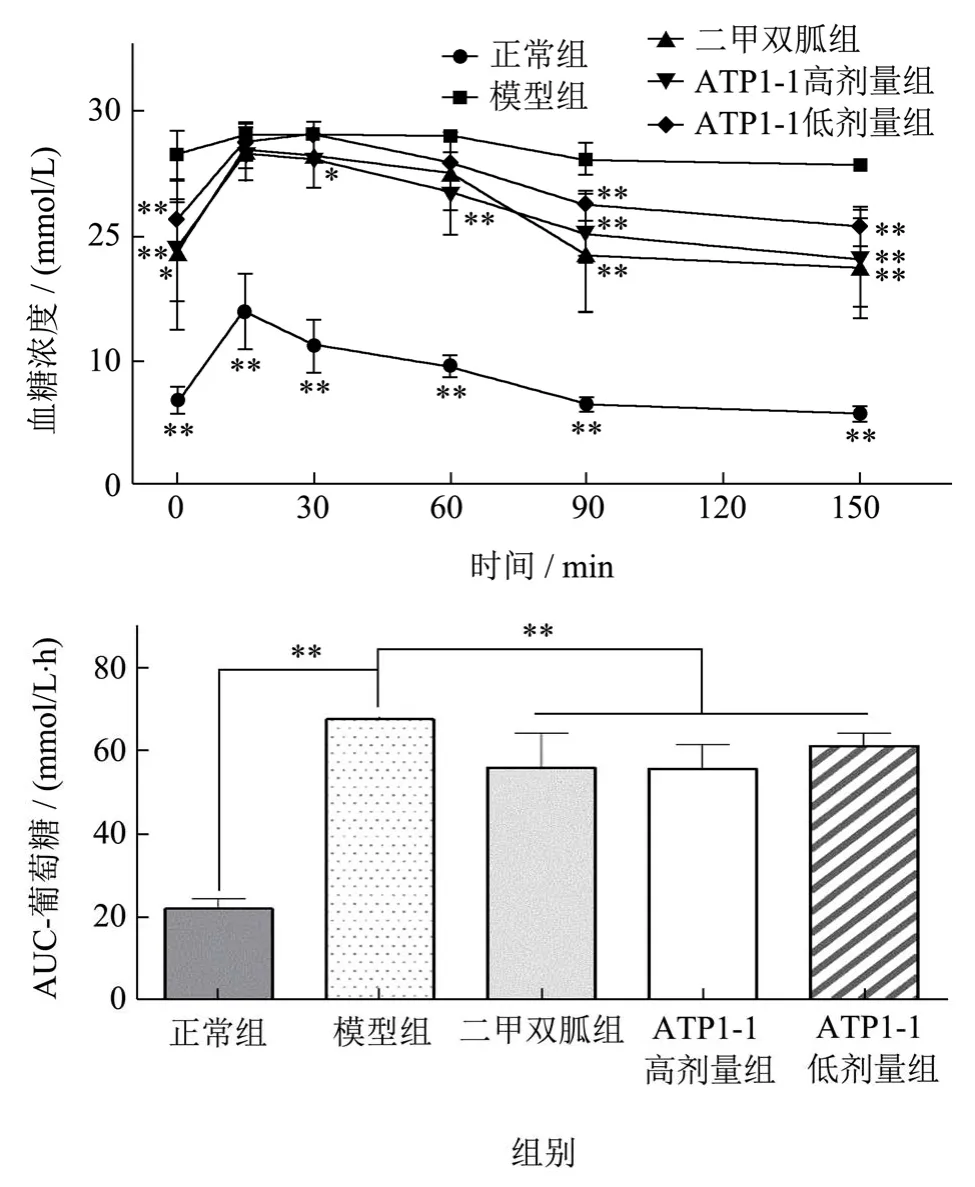
图2 各组小鼠葡萄糖耐量水平Fig.2 Oral glucose tolerance of different group mice
图3、图4分别为OSTT、OMTT 试验结果,口服给予蔗糖或麦芽糖30 min 后,各组小鼠血糖值达到峰值,其后给药组均以大于模型组的幅度下降,AUC均明显降低(p<0.05),尤其对蔗糖糖耐量效果最为明显(p<0.01)。高、低剂量ATP1-1 对蔗糖耐量实验的AUC 与模型组相比分别下降了16.19%、12.11%。2 型糖尿病小鼠的蔗糖糖耐量增高,意味着机体对高糖饮食中蔗糖的吸收调节能力增强,从而可抑制高糖饮食引起的循环血糖增高[27];糖尿病小鼠的麦芽糖耐量提高则意味着机体对麦芽糖的耐受力增加,可减缓麦芽糖的消化和吸收,改善胰岛素抵抗[28]。蔗糖、麦芽糖消化吸收下降可降低葡萄糖入血从而降低血糖,ATP1-1 可通过加快餐后血糖下降速率改善蔗糖与麦芽糖耐受,且呈剂量依赖性,该作用往往与减缓机体对二糖的消化,延迟吸收从而调节肠道上的葡萄糖摄取有关。

图3 各组小鼠蔗糖耐量水平Fig.3 Oral sugar tolerance of different group mice


图4 各组小鼠麦芽糖耐量水平Fig.4 Oral maltose tolerance of different group mice
2.4 ATP1-1 对T2DM 小鼠肠道二糖酶活性的影响
从表3可知,糖尿病小鼠各肠段的蔗糖酶活性、麦芽糖酶活性均明显高于正常组(p<0.05),给药治疗8 周后,ATP1-1 高、低剂量组各肠段的蔗糖酶、麦芽糖酶活性被显著抑制(p<0.05)。其中,高剂量ATP1-1 对十二指肠、空肠、回肠的蔗糖酶抑制率分别为48.29%、75.09%、31.41%;对麦芽糖酶抑制率分别为26.23%、18.34%、34.18%。ATP1-1 对蔗糖酶的活性抑制作用在空肠上最为明显(p<0.01),对麦芽糖酶的活性抑制作用在回肠上最为明显(p<0.01),且回肠上高、低剂量治疗后其二糖酶活性与正常组相比差异无统计学意义(p>0.05)。
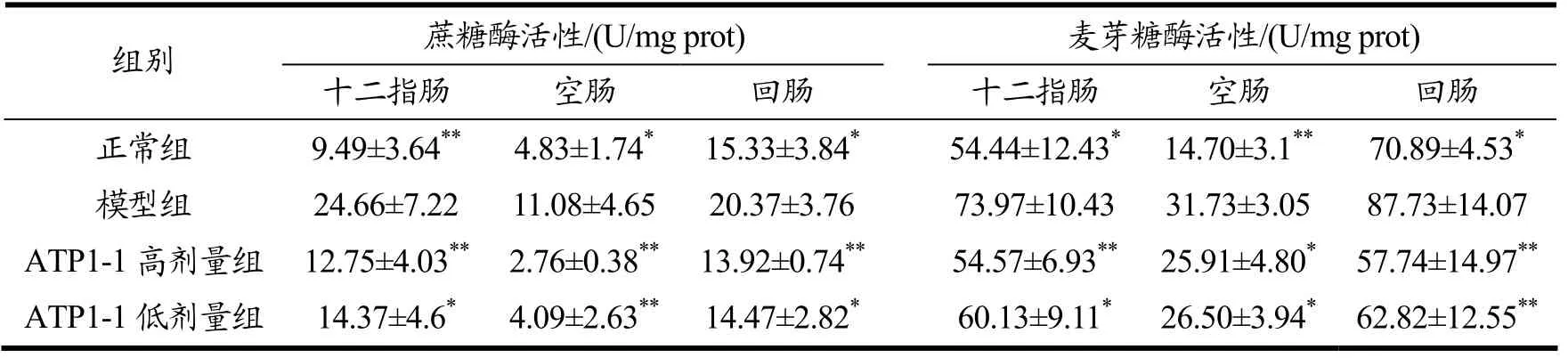
表3 ATP1-1 对小鼠肠黏膜蔗糖酶、麦芽糖酶活性的影响Table 3 Effects of ATP1-1 on the activities of invertase and maltase in mouse intestinal mucosa
α-葡萄糖苷酶位于小肠刷状缘膜上皮细胞,是水解蔗糖、麦芽糖等双糖的关键酶,是众多经典糖尿病治疗药物的作用靶点,在糖尿病的治疗中起着重要的作用[29]。糖尿病患者中α-糖苷酶活性与正常人相比会异常升高,抑制肠黏膜刷状缘α-糖苷酶活性,可减缓寡糖、双糖水解为单糖的速度,减缓单糖吸收入血,从而降低血糖[8]。蔗糖酶、麦芽糖酶均属于α-葡萄糖苷酶,顾舒静等[30]研究发现,黄芩苷对大鼠十二指肠、空肠和回肠的蔗糖抑制率分别为47.2%、14.4%和34.8%,对麦芽糖酶没有抑制作用;本试验结果表明,ATP1-1 对蔗糖酶、麦芽糖酶活性均有抑制作用,有助于延缓碳水化合物分解成单糖,抑制肠道对糖的吸收,维持血糖在正常水平。
2.5 ATP1-1 对回肠上GLP-1、SI 表达的影响
如图5、图6所示,糖尿病小鼠SI mRNA 表达量明显高于正常小鼠(p<0.01),GLP-1 mRNA 表达量明显低于正常组(p<0.01)。给药8 周后,与模型组相比,ATP1-1 高、低剂量组SI 表达分别降低了64.90%、24.87%(p<0.01);高剂量组GLP-1 表达增加了156.46%(p<0.01),低剂量组有上升趋势但无统计学意义。SI 存在于小肠绒毛刷状缘的黏膜表面,伴随着小肠上皮的成熟逐渐形成,包含了约60%~80%的麦芽糖酶活性、所有的蔗糖酶活性以及大部分的异麦芽糖酶活性[31]。GLP-1 可刺激胰岛素分泌、减少胰高血糖素的分泌、增强β细胞的增殖,抑制胃排空和增加饱腹感来减少对食物的摄入[32]。糖尿病小鼠中SI的表达增加,刺激了肠黏膜细胞膜的转运系统,导致小肠内单糖转运升高[33]。同时,抑制α-葡萄糖苷酶活性可导致回肠远端碳水化合物浓度增加,通过渗透作用,进一步刺激小肠肠促胰岛素GLP-1 的分泌增加[10]。结合本实验结果可见,ATP1-1 可通过下调SI表达,上调GLP-1 表达,从而影响肠道糖的吸收和机体糖代谢。

图5 各组小鼠回肠组织SI mRNA 表达水平Fig.5 The mRNA expression levels of SI in ileum tissues of different group mice
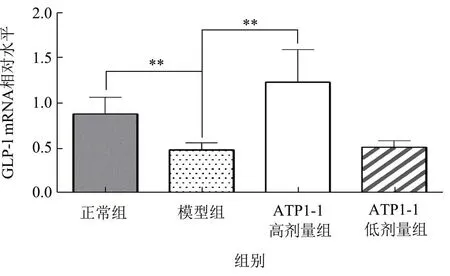
图6 各组小鼠回肠组织GLP-1 mRNA 表达水平Fig.6 The mRNA expression levels of GLP-1 in ileum tissues of different group mice
2.6 ATP1-1 对蔗糖酶、麦芽糖酶活性的体外抑制能力
α-葡萄糖苷酶抑制剂可通过延迟碳水化合物的肠道吸收,从而抑制餐后血糖水平的升高[34]。为了进一步验证ATP1-1 是否能直接抑制小鼠肠二糖酶,分别以蔗糖、麦芽糖作为底物,研究了ATP1-1 对小鼠十二指肠匀浆中蔗糖酶、麦芽糖酶活性抑制的影响。所有数据平行测定3 次,以阿卡波糖为阳性对照,结果如图7、图8所示,根据抑制率-浓度曲线计算半数抑制浓度IC50,阿卡波糖和ATP1-1 对麦芽糖酶的IC50值分别为42.61 μg/mL、265.00 μg/mL,对蔗糖酶的IC50值分别为2.16 μg/mL、3 381.00 μg/mL,提示ATP1-1 对此两种酶均有直接抑制作用,但抑制能力弱于阿卡波糖。ATP1-1 抑制麦芽糖酶的IC50远小于蔗糖酶,但当ATP1-1 浓度为10 mg/mL 时,其对蔗糖酶的抑制率可达46.80%,远高于对麦芽糖酶的抑制率15.92%,结果与体内活性抑制率相似,且植物多糖如绿茶多糖[35]对蔗糖酶的抑制率小于40%,番石榴叶多糖[36]对蔗糖酶、麦芽糖酶的抑制率仅为29.3%、20.6%,可见ATP1-1 不仅与上述多糖相似可直接抑制小鼠肠二糖酶活性,还具有较好的抑制效果。

图7 ATP1-1 及阿卡波糖对蔗糖酶的抑制率曲线Fig.7 Inhibition effects of ATP1-1 and acarbose on sucrase
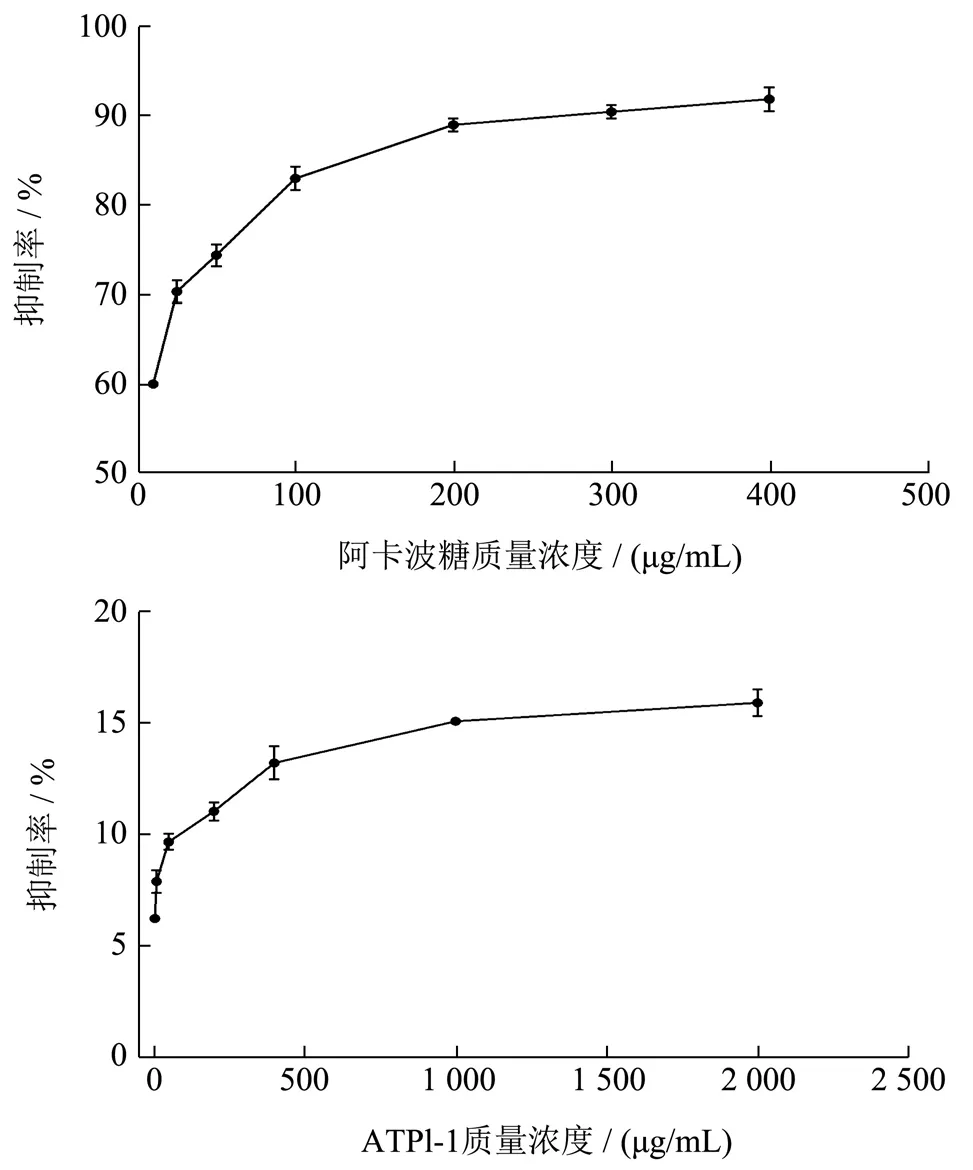
图8 ATP1-1 及阿卡波糖对麦芽糖酶的抑制率曲线Fig.8 Inhibition effects of ATP1-1 and acarbose on maltase
3 结论
白簕广泛分布于中国中部和南部,具有丰富的营养价值,在民间流行以簕菜作为保健蔬菜,是开发保健性食品的理想原料。本研究表明,白簕中性多糖ATP1-1 可抑制2 型糖尿病小鼠肠道二糖酶活性、下调SI表达,进一步影响GLP-1的表达及肠道上的糖吸收,从而改善2 型糖尿病小鼠的高血糖状态。

