鞣花酸对甲醛致小鼠肝损伤的保护作用
李金玲,李佳滨,元红权,蒋文艺,刘海强,秦雪梅,林春梅*
(1.吉林农业大学中药材学院,吉林长春 130118)(2.长春通源医院,吉林长春 130012)
在全球范围内,每年大约有200 万例的人因慢性肝炎、酒精性或非酒精性肝病、环境因素、以及药物引起的毒性,导致肝纤维化、肝硬化、以至于肝癌[1,2]。因此,肝病一直都受到科学家们的关注,甲醛(Formaldehyde,FA)是一种高活性的危险化学物质,不仅具有极强的反应性,可迅速与硫醇和大分子结合导致DNA 损伤[3],且与呼吸道疾病、过敏、白血病、脑癌等疾病的发生有着密切的关系[4-7],现甲醛已被国际癌症研究机构列为1 类人类致癌物[8]。此外,Duan等[9]研究发现,在体内,甲醛充当促氧化剂或降低抗氧化剂水平从而破坏氧化平衡,显著增加自由基含量,且过量的活性氧产生会导致脂质、蛋白质和碳水化合物的不可逆氧化修饰[10,11]。若甲醛经口腔进入机体会增加炎症细胞因子的释放,肝细胞的凋亡,粘附分子的表达和白细胞的浸润,在短时间内会引起肝功能异常,最终导致肝脏受损[12-14]。且目前尚无特异性解毒剂可用于治疗甲醛诱导的器官毒性。
大量的研究表明,补充具有抗氧化特性的天然化合物(如多酚、黄酮等)在预防肝脏损伤方面有着重要作用[15,16]。鞣花酸(Ellagic Acid,EA)是石榴中主要的酚类之一[17],具有广泛的抗氧化、抗炎、抗癌、抗凋亡等作用[18-21]。有研究表明,鞣花酸可以激活氧化防御系统,对自由基具有强效清除作用,并抑制脂质过氧化[22-24]。此外,鞣花酸可减少炎症因子的产生,如IL-6、IL-8 和TNF-α等[25]。本实验为了探究鞣花酸是否对甲醛诱导的肝损伤具有保护作用,采用灌服甲醛来建立小鼠肝脏损伤模型,并给予两种不同浓度鞣花酸溶液进行干预,探讨鞣花酸对甲醛诱导的小鼠肝脏损伤的作用及其机制,为减缓甲醛诱导的肝损伤提供实验基础。
1 材料与方法
1.1 材料
1.1.1 试剂
甲醛溶液(37%~40%),西陇化工股份有限公司;鞣花酸(纯度≥95%),Sigma 公司(货号:E2250);Bradford 蛋白含量检测试剂盒,江苏凯基生物技术股份有限公司(货号:KGA804);超氧化物歧化酶(SOD)检测试剂盒-WST,东仁化学科技(上海)有限公司(货号:S311);TRIzol reagent kit,美国Invitrogen 公司(货号:15596-026);Prime ScriptTM RT reagent kit with gDNA Eraser kit,宝生物工程(大连)有限公司(货号:RR047A);TB Green® Premix Ex Taq™ II kit,宝生物工程(大连)有限公司(货号:RR820A);苏木素伊红(HE)染色试剂盒,碧云天生物技术有限公司(货号:C0105)。
1.1.2 主要仪器
超微量分光光度计,美国Nano Drop 公司;微孔板分光光度计,美国伯腾仪器有限公司;荧光定量PCR 仪,德国耶拿分析仪器股份公司;HistoCore Arcadia H 热石蜡包埋机,德国Leica 公司;半自动轮转式切片机,德国Leica 公司;BX53F 光学显微镜,日本OLYMPUS 公司。
1.1.3 实验动物
32 只8 周龄SPF 级雄性ICR 小鼠(35~40 g),购于辽宁省长生生物技术股份有限公司,实验动物许可号SCXK(辽)2020-0001。适应性饲养一周后进行实验,实验期间小鼠自由饮食饮水。
1.2 方法
1.2.1 动物分组及模型制备
将32 只雄性ICR 小鼠随机分为四组:对照组(生理盐水)、甲醛模型组(333 mmol/L 甲醛溶液)、鞣花酸低剂量组(33 mmol/L 鞣花酸溶液)和高剂量组(66 mmol/L 鞣花酸溶液),分别连续灌胃14 d。每日上午给予对照组小鼠生理盐水,除对照组外,其它组分别给予小鼠333 mmol/L 甲醛溶液;下午给予对照组与模型组小鼠生理盐水,用药组小鼠分别给予不同浓度鞣花酸溶液。
1.2.2 肝脏指数的计算
分别称量解剖前小鼠的体重和解剖后小鼠的肝脏重量,根据以下公式进行计算:

式中:
A——肝脏指数;
m1——肝脏质量,g;
m0——小鼠质量,g。
1.2.3 肝组织病理学观察
解剖后取小鼠肝脏组织置于10wt%中性福尔马林溶液中,进行固定。将固定好的肝脏组织进行脱水、包埋,切片(5 μm),进行苏木精-伊红(H&E)染色,并在光学显微镜下观察各组小鼠肝组织的形态特征。
1.2.4 氧化损伤指标检测
脂质过氧化检测:取-80 ℃冷冻储存的肝脏组织,按照试剂盒说明书,将肝脏组织制成匀浆液,加入试剂,95 ℃孵育30 min 后,在波长532 nm 下测量OD值并进行计算。
超氧化物歧化酶活性检测:按照试剂盒说明书,制备肝脏匀浆液,配置WST 的工作液和酶的工作液,加入试剂后,在37 ℃培养20 min,用酶标仪在450 nm处读数并进行计算。
1.2.5 实时荧光定量PCR 检测
使用TRIzol 试剂盒提取小鼠肝脏的总RNA,测定其浓度后,按照Prime Script™RT 试剂盒和gDNA Eraser试剂盒的说明书,将2 μg总RNA反转为cDNA。根据TB Green®PremixEx Taq™II 试剂盒的要求,以逆转录形成的cDNA 为模板,采用表1所示引物,进行实验,并以GAPDH 引物作为目的基因转录表达的内参基因。

表1 荧光定量PCR 分析所用引物Table 1 Primer used for quantitative real-time PCR analysis
1.3 数据分析
利用GraphPad 7.0 版本,对得到数据进行单因素方差的分析(one-way ANOVA),计量资料以Mean±SEM.表示。其中,p<0.05,表明差异具有统计学意义;p<0.01,表示差异具有高度统计学意义。
2 结果与讨论
2.1 小鼠肝脏指数水平变化
在李亚琳[26]的研究中,随着甲醛染毒剂量以及染毒时间的增加,肝脏指数逐渐减小,说明甲醛增加了肝脏的代谢负荷,即可能通过影响附加生理或生化负荷的代偿能力,从而使其代谢能力降低,间接导致了肝脏组织的损伤。本实验中,小鼠肝脏指数如表2所示,虽然各组之间无显著性差异(p>0.05),但与对照组相比,甲醛模型组小鼠肝脏指数降低了3.63%;与模型组相比,给药组小鼠肝脏指数随药物浓度增加而升高,其中鞣花酸高剂量组增加了9.14%。小鼠肝脏指数的升高表明鞣花酸缓解了甲醛诱导的肝损伤。
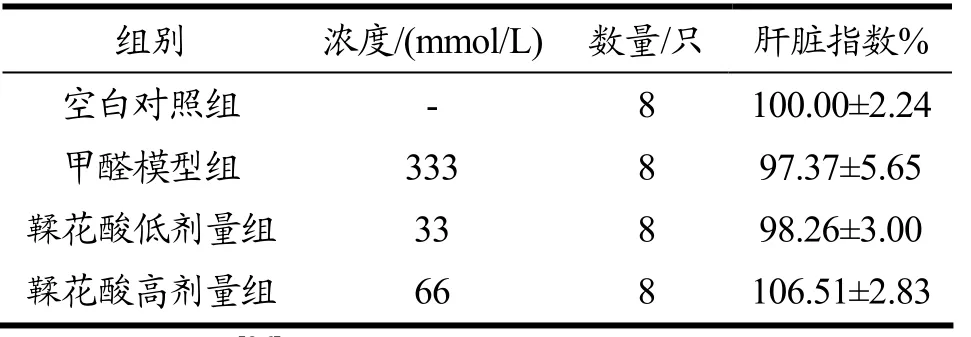
表2 小鼠肝脏指数Table 2 Liver index in mice
2.2 小鼠肝脏组织的形态学变化
如图1所示,与对照组相比,甲醛模型组小鼠肝索排列紊乱,肝细胞的形态异常(小空泡,双核,肝细胞核肿大),说明甲醛对肝脏造成了损伤。与模型组相比,经鞣花酸处理的小鼠肝索排列整齐,肝细胞中空泡减少,肝细胞质均匀分布,表明鞣花酸可减缓甲醛诱导的肝损伤。

图1 鞣花酸对甲醛诱导的小鼠肝损伤的组织学变化的影响(400x)Fig.1 Effect of ellagic acid on histopathological changes in formaldehyde-induced liver injury in mice
2.3 小鼠肝脏组织的氧化损伤分析
氧自由基反应和脂质过氧化反应在机体的新陈代谢中起着重要的作用,并且处于动态平衡,若平衡被打破,则会引起新陈代谢失常、形成氧自由基连锁反应,损害生物膜及其功能,以致形成细胞透明性病变造成组织、器官等损伤[27]。MDA 是脂质过氧化后形成的主要产物,并且作为判断氧化损伤的常用参数之一[28,29]。超氧化物歧化酶是用于证明与氧化应激相关损伤的抗氧化酶[30],它的活性变化被认为是氧化应激的标志。有研究表明,甲醛可以通过促进体内氧自由基的生成和降低抗氧化酶的活性而引起机体的氧化损伤[31]。Teng 等[32]将离体大鼠肝细胞暴露于甲醛中发现脂质过氧化水平和ROS 含量增加,导致肝细胞氧化损伤。在本研究中,与对照组相比,甲醛模型组小鼠肝组织的MDA 浓度62.84 nmol/mg,显著升高(p<0.01);相反,鞣花酸低剂量组小鼠肝组织的MDA 浓度为38.51 nmol/mg,鞣花酸高剂量组小鼠肝组织的MDA浓度为43.25 nmol/mg,与甲醛模型组相比,鞣花酸处理后,MDA 含量下降,分别下降了38.71%和31.17%,图2a。小鼠肝组织的中SOD 活性变化如图2b 所示,甲醛模型组小鼠肝组织的SOD 活性为0.84 U/mg,甲醛模型组SOD 活性较对照组降低了17.65%;鞣花酸低剂量组小鼠肝组织的SOD 活性为0.90 U/mg,鞣花酸高剂量组小鼠肝组织的SOD 活性为1.09 U/mg,与甲醛模型组相比,鞣花酸用药组SOD 活性呈剂量相关上升。图2c、2d 为小鼠肝脏组织中SOD1、SOD2mRNA的表达水平,可发现甲醛模型组SOD1和SOD2的表达水平与对照组相比降低到 0.58 和 0.56(p<0.01),与甲醛模型组相比,鞣花酸低剂量组SOD1和SOD2的表达水平升高到0.98 和0.98(p<0.01),鞣花酸高剂量组SOD1和SOD2的表达水平升高到1.23和1.11(p<0.01)。
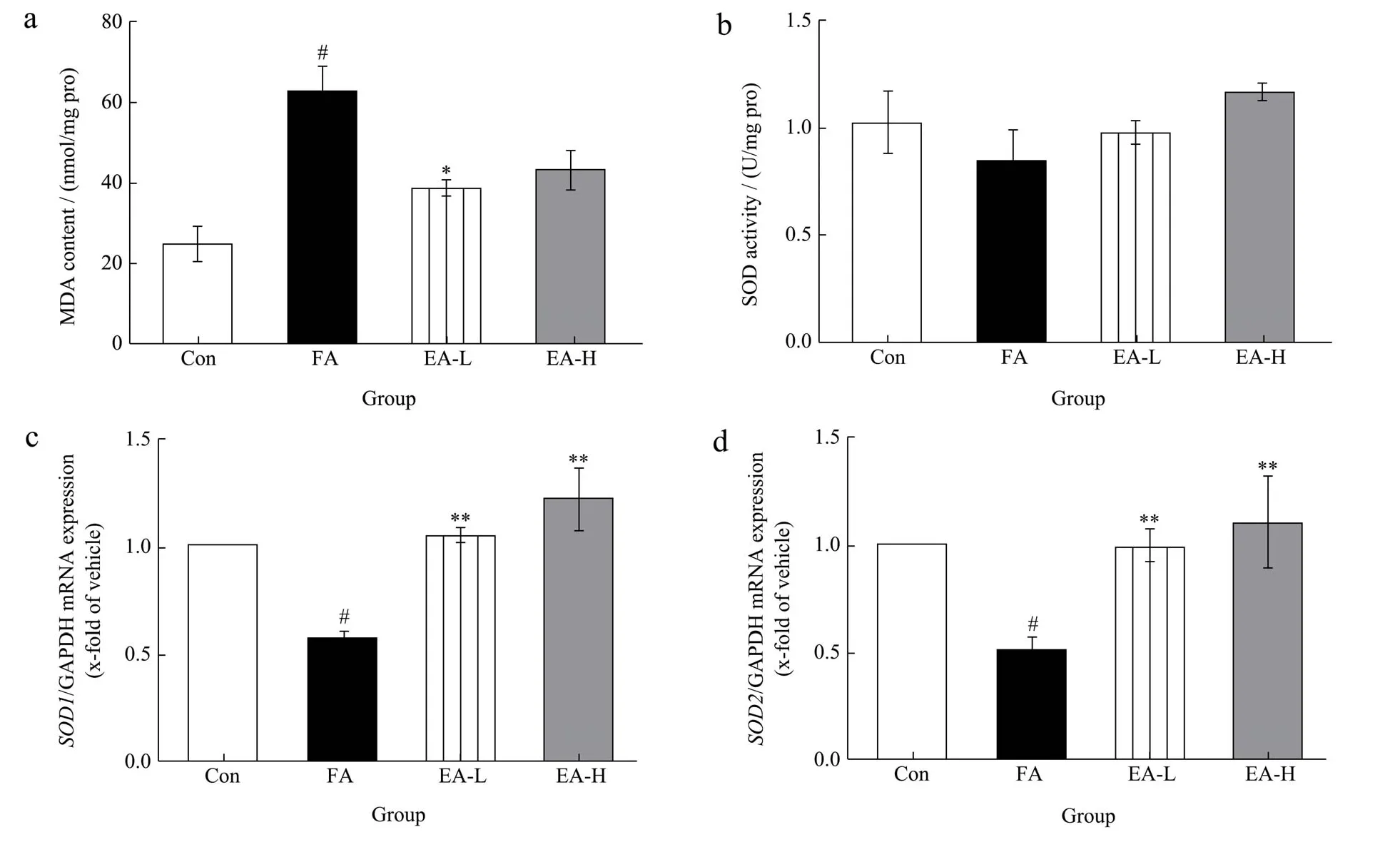
图2 小鼠肝脏组织氧化损伤水平变化Fig.2 The change of oxidative damage in mice liver
以上结果表明,甲醛暴露引起了小鼠肝组织中MDA 含量的升高、SOD 活性和SOD1、SOD2mRNA的表达水平的降低,说明肝脏发生脂质过氧化损伤,抗氧化防御机制被破坏,从而导致了肝脏的氧化损伤。而经鞣花酸干预后MDA 的含量下降,SOD 的活性和SOD1、SOD2mRNA 的表达水平上升,说明鞣花酸通过其抗氧化作用缓解了甲醛诱导的氧化应激损伤。
2.4 小鼠肝脏NF-κB 的表达水平分析
NF-κB 是许多信号通路中的关键因子,尤其是在炎症、免疫、细胞增殖和凋亡中。Li 等[33]利用脂多糖诱导肝损伤,通过免疫印迹分析磷酸化NF-κB 的情况,结果表明LPS 的攻击明显增加磷酸化NF-κB 的表达,说明NF-κB 信号传导在受损肝细胞中被激活。在本实验中,与对照组相比,甲醛模型组小鼠肝组织的NF-κBmRNA 的表达水平升高至1.54(p<0.01);相反,与甲醛模型组相比,鞣花酸用药组小鼠肝组织的NF-κBmRNA 的表达水平显著降低(p<0.01),低剂量组降低至0.78,高剂量组降低至0.49,图3所示。数据表明鞣花酸在甲醛诱导的肝损伤中可降低NF-κB信号传导来发挥保护作用。

图3 小鼠肝脏NF-κB 表达水平Fig.3 The gene expression level of NF-κB
2.5 小鼠肝脏炎症因子的表达水平分析
有研究表明,甲醛刺激细胞因子的产生,这些细胞因子影响参与炎症和巨噬细胞介导的免疫的iNOS的代谢[34]。Fethullah 等[35]的研究中指出暴露于甲醛的大鼠血清中IL-1β、IL-6、TNF-α和YKL-40 水平升高,表明甲醛类似于诱导细胞因子合成的激活剂,诱导炎症级联反应并增加关键细胞因子的水平。本实验中,与对照组相比,甲醛模型组小鼠肝组织的IL-1β、IL-6、TNF-αmRNA 的表达水平升高,分别升高到1.06、1.10和1.11;相反,与甲醛模型组相比,鞣花酸用药组小鼠肝组织的IL-1β、IL-6、TNF-αmRNA 的表达水平显著降低(p<0.01),其中鞣花酸低剂量组炎症因子表达水平分别降低至0.63(IL-1β)、0.87(IL-6)和0.85(TNF-α),鞣花酸高剂量组炎症因子表达水平分别降低至0.61(IL-1β)、0.38(IL-6)和0.79(TNF-α),图4所示。在本研究,甲醛引起小鼠肝组织中IL-1β、IL-6、TNF-αmRNA 的表达水平增加,说明甲醛导致肝脏出现炎症反应,而鞣花酸通过其具有的抗炎作用,降低了甲醛引起的肝脏组织的炎症反应。

图4 小鼠肝脏炎症因子的表达水平Fig.4 The gene expression level of inflammatory factor
2.6 小鼠肝脏凋亡因子的表达水平分析
甲醛导致ROS 的产生,诱导细胞凋亡和坏死[36,37]。Caspase 在细胞凋亡的早期阶段被激活,Caspase-3 充当细胞凋亡的终止子[38]。Bax 是线粒体应激诱导凋亡通路下游的效应分子[39]。Sapmaz 等[40]将成年大鼠暴露于甲醛中,使其吸入甲醛,并利用免疫组织化学检查大鼠气管上皮组织中Bax和Caspase-3 的表达,发现甲醛组Bax 和Caspase-3 蛋白表达水平较高,说明甲醛导致气管上皮细胞凋亡。所以在本实验中通过对凋亡因子(Bax 和Caspase-3)表达水平的分析,来测定肝细胞的凋亡情况。如图5所示,与对照组相比,甲醛模型组小鼠肝组织的Bax、Caspase-3mRNA的表达水平显著上升(p<0.01),分别上升到1.29 和1.27,与甲醛模型组相比,鞣花酸低剂量组和高剂量组小鼠肝组织的Bax、Caspase-3mRNA 的表达水平显著降低(p<0.01),低剂量组Bax和Caspase-3的表达水平显著降低至0.70 和0.96,低剂量组Bax和Caspase-3的表达水平显著降低至0.68 和0.93。甲醛染毒的模型组Bax和Caspase-3mRNA 的表达水平升高,诱导了肝脏细胞凋亡。经鞣花酸处理后Bax、Caspase-3mRNA的表达水平显著下降,减少了肝细胞的凋亡。

图5 小鼠肝脏凋亡因子的表达水平Fig.5 The gene expression level of Bax,Caspase-3 in mice liver
3 结论
实验结果表明甲醛暴露可引起小鼠肝脏组织发生氧化应激损伤,并诱导炎症反应发生,细胞凋亡,而经鞣花酸干预后损伤程度均有所缓解,说明鞣花酸通过其抗氧化,抗炎和抗凋亡的特性对甲醛诱导的小鼠肝损伤具有一定的保护作用。

