耳后切口去骨瓣减压术治疗大面积脑梗死临床疗效☆
夏家杰 姚斌 郑刚 宋大刚 孙陈军 陈锷峰 屠传建
大面积脑梗死占所有幕上缺血性卒中2%~8%[1],即使经过积极的内科治疗,其病死率仍可高达60%~80%,严重威胁患者生命健康[2]。外科减压手术不仅可以解除大面积脑梗死后脑疝带来的生命危险,而且及早干预还能够改善半暗带灌注,从而显著提高患者功能预后[3-4]。但目前对于不同切口去骨瓣减压手术对大面积脑梗死的疗效研究较少,本项研究旨在回顾大面积脑梗死患者接受去骨瓣减压手术后的并发症及疗效,为去骨瓣减压术选择手术切口提供参考。
1 对象与方法
1.1 研究对象 回顾2019年6月至2021年6月绍兴市中心医院神经外科手术治疗的大面积脑梗死患者临床资料,依据去骨瓣减压手术切口的不同分为标准大骨瓣组及耳后切口组。入组标准:①CT或MR提示脑梗死受累范围>1/2大脑中动脉供血区;②中线结构移位;③积极内科治疗下仍存在严重高颅压症状和/或病情进展;④18~80岁。排除标准:①出现双瞳散大固定、自主呼吸消失等脑死亡表现;②不可纠正的凝血功能障碍;③严重的心、肺、肝及肾等器官功能障碍者。本研究经本院伦理委员会审查通过。见图1。

图1 入组流程图
1.2 资料收集 收集患者的各项信息,包括年龄、性别、基础合并症、入院至手术时间(入院当天手术视作第0天)、术前格拉斯哥昏迷评分(Glasgow coma scale,GCS)[5]、术侧、手术时间、手术出血量、去骨瓣减压范围、切口不良愈合、切口感染、颞浅动脉损伤等。本项研究通过手术记录采集手术时间、手术出血量等信息,根据手术记录判断颞浅动脉的保留、结扎或电凝等处理方式,结扎或电凝颞浅动脉主干均视为损伤颞浅动脉。出院时记录患者切口愈合情况、是否存在切口感染。术后行头颅CT+三维重建,由神经外科两位高年资医生单独测量去骨瓣减压范围;去骨瓣减压范围(cm2)=术后头颅CT的减压窗长径(cm)×横径(cm)。术后3个月门诊或电话随访,采用改良Rankin量表(modified Rankin scale,mRS)[6]评估患者的神经功能结局情况,mRS≤2分作为预后良好的评判标准,mRS≥3分作为预后不良的评判标准。
1.3 手术方法 耳后切口组患者均行全身麻醉,取仰卧位,手术侧肩下垫高,头偏对侧位约60°,切口起自外耳道后4 cm、颧弓-枕外隆凸连线上1 cm,绕过顶结节后沿中线向前至前发迹。颅钻于鳞状缝与顶乳缝交界点钻孔,铣刀切除颞骨鳞部向下至该点与颧弓后切迹连线,向前平皮缘,向上旁开距离中线2 cm,其余部分紧邻皮缘下开窗,咬骨钳咬除蝶骨嵴向下平颧弓上缘。“U”型剪开硬脑膜,采用可缝合人工硬脑膜进行减张缝合。术后3个月采用皮肌瓣分离、颞肌下全剥离方式行颅骨修补术。见图2。标准大骨瓣组患者头偏对侧位约45°,切口起自颧弓上耳屏前1 cm,绕过耳廓和顶结节后沿中线向前至前发迹,形成大问号形状。骨瓣向前平皮缘,向上旁开距离中线2 cm,咬除蝶骨嵴向下平颧弓上缘,其余部分紧邻皮缘下开窗[7]。
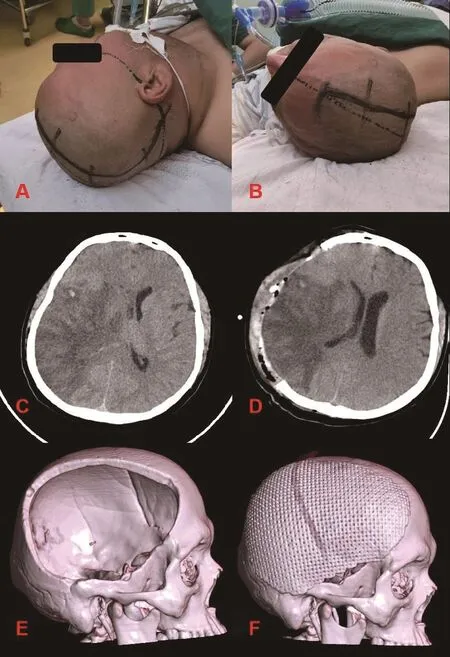
图2 右侧大面积脑梗死行耳后切口去骨瓣减压术、颅骨修补术前后影像
1.4 统计学方法 采用SPSS 20.0进行数据处理。正态分布计量资料采用±s表示,两组间比较采用独立样本t检验;非正态分布数据采用M(QL,QU)表示,采用Mann-WhitneyU检验。分类资料采用χ2检验或Fisher精确概率法。检验水准α=0.05。
2 结果
2.1 一般资料 共纳入45例患者,其中标准大骨瓣组25例,耳后切口组20例,两组患者的年龄、性别、术前GCS、入院至手术时间、高血压、糖尿病、房颤、术侧均无统计学差异(P>0.05)。见表1。

表1 两组患者的一般资料
2.2 疗效与随访 相较于标准大骨瓣组,耳后切口组的去骨瓣减压范围(t=11.96,P<0.001)显著增大,颞浅动脉损伤率(χ2=31.5,P<0.001)显著下降,差异有统计学意义。但两组的手术时间(t=0.932,P=0.357)、手术出血量(t=1.076,P=0.288)、切口不良愈合率(P=0.242)、切口感染率(P=1.000)、术后3个月预后良好率(P=0.362)差异无统计学意义。见表2。

表2 两组患者的手术指标、并发症及转归
3 讨论
治疗大面积脑梗死的去骨瓣减压术常采用“标准大骨瓣切口”,该术式是由20世纪70年代BECKER等[8]提出,引入国内后得到广泛应用;继而2010年RAGEL等[9]提出了“Kempe切口”,2016年YANG等[10]提出了“n型切口”。本文采用的耳后切口去骨瓣减压术[11]是在2019年提出的方法,系该术式在中国人群中的首次研究报告。
耳后切口的去骨瓣减压范围更大,既往研究也支持这一结论[12]。尽管去骨瓣减压前后径超过12 cm是大面积脑梗死患者有效减压的经典标准,但去骨瓣减压范围超过脑梗死区域,可有效避免减压术后脑疝的存在[13]。
耳后切口能减少颞浅动脉损伤,本项研究中标准大骨瓣切口损伤颞浅动脉主干概率达21/25。颞浅动脉起自下颌颈后方,在腮腺深面、耳颞神经前方上行,约在颧弓上2~3 cm处分为额支和顶支,分布全头近60%的面积,因此术中损伤颞浅动脉可能是术后切口愈合不良的原因之一。CHEN等[14]研究显示中国人的颞浅动脉通常位于骨性外耳道前方1.14 cm处,86.5%的颞浅动脉分叉位于在颧弓上方,常规的标准大骨瓣切口往往难以避免颞浅动脉的损伤。糖尿病是头皮切口愈合不良的高危因素[15],在本项研究中,17.78%(8/45)的大面积脑梗死患者合并糖尿病,提示大面积脑梗死患者尤其需要注意保护皮瓣血供。保留颞浅动脉,不仅可避免手术后造成的皮瓣缺血坏死,更能为后期可能进行的血运重建创造条件[3]。
既往研究表明耳后切口的切口并发症率、手术部位感染率更低[12,16]。本研究中患者的切口不良愈合率和切口感染率无显著差异。但是本研究中未得出这一结论,原因除样本量小外,还应考虑到在我国标准去骨瓣减压经过多年应用后技术较为成熟。目前对于去骨瓣减压术后患者,提倡在恢复良好且无手术绝对禁忌证的情况下,应早期行颅骨修补术[17]。既往研究[16]表明,耳后切口的颅骨修补手术失败率更低,这可能与颞浅动脉和枕动脉的保护相关。本项研究由于颅骨修补患者数量较少,并未对此着重研究。但需注意的是,既往研究和本研究中,耳后切口和标准大骨瓣切口的去骨瓣减压术对于大面积脑梗死患者的神经功能预后均无显著差别,去骨瓣减压虽然可通过增加梗死区外脑组织的灌注,改善脑功能,但仍不能挽救核心梗死区域的脑组织。
耳后切口的骨瓣切除过程尚未被详细描述。本项研究中,根据解剖学研究和临床实践,耳后切口的骨窗边缘不应超过于鳞状缝与顶乳缝交界点,以避免损伤乙状窦;同时需注意避免过多切除颞骨鳞部导致乳突气房暴露,对于乳突气房暴露者,及时采用骨蜡填塞;在翼点和蝶骨嵴的切除过程中,可利用骨膜剥离子辅助暴露。
本研究为小样本、单中心的回顾性分析,部分患者采用电话随访,这对于评估神经功能预后及切口愈合情况存在较大的偏倚。目前进行颅骨修补的患者数量较少,不同切口对颅骨修补的手术时机及并发症影响有待进一步研究。另外大面积脑梗死患者的颅骨切除范围也有待讨论验证。该术式的长期有效性和安全性有待多中心、大规模的前瞻性研究证实。
综上所述,耳后切口去骨瓣减压术可扩大去骨瓣减压范围,减少颞浅动脉损伤,在大面积脑梗死的手术治疗中有推广应用价值。

