累及脊髓的脑淀粉样血管病相关炎症1例☆
陈家杰刘玲春杨瑞晗杨顺宇刘达何静苏跃康孟强
脑淀粉样血管病(cerebral amyloid angiopathy,CAA)是由于β淀粉样蛋白(amyloid β,Aβ)沉积在软脑膜或皮层动、静脉引起的少见的血管病变[1]。脑淀粉样血管病相关炎症(cerebral amyloid angiopathy-related inflammation,CAA-ri)是CAA中的一种少见亚型,其Aβ不仅在血管内沉积,还可在血管壁和血管周围引起炎症反应,它是一种主要以精神症状、癫痫、认知功能减退等表现为主的中枢神经系统罕见血管炎[2-3]。而累及脊髓的CAA-ri则更为罕见,目前国内尚未见文献报告。本文报告1例累及脊髓的CAA-ri患者,来扩展该病的临床表型。
1 临床资料
患者,男,66岁,因“胡言乱语、反应迟钝3月伴双下肢无力半月,抽搐1次”于2021年1月25日至云南省第一人民医院就诊。患者3个月前无明显诱因出现头痛、胡言乱语、反应迟钝及发作性右侧肢体麻木无力。2020年11月就诊于外院,头颅MRI检查后(图1)诊断为“短暂性脑缺血发作”、“病毒性脑膜脑炎”,腰椎穿刺提示红细胞65×106/L,蛋白528 mg/L,IgG 103 mg/L,白细胞数正常。予抗血小板、抗病毒、甲强龙500 mg冲击等治疗后患者反应迟钝、头痛改善,头颅MRI提示病灶改善(图1)。后患者因突发一次意识丧失、肢体抽搐,持续30 min。再次至外院复诊,予抗癫痫、激素等治疗后症状无缓解。2021年1月15日患者出现尿潴留、双下肢无力,颈、腰椎MRI平扫示胸11椎体平面脊髓至脊髓圆锥内病变(图2),遂至我院。病程中饮食正常,大便难解、小便潴留,体质量无明显变化,睡眠可。既往史、家族史无特殊。个人史:吸烟史30年,10支/日;喝酒史30年,100 mL/d。否认外伤史。
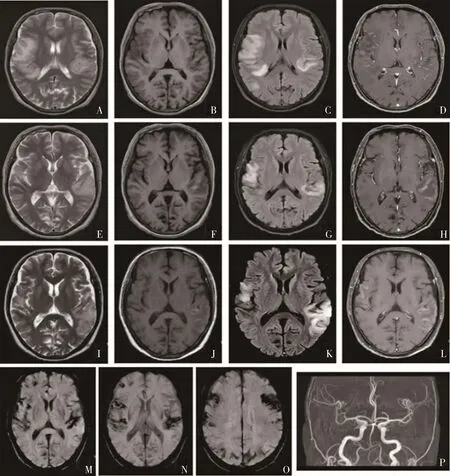
图1 患者头颅神经影像学表现
入院体检:生命体征平稳,内科查体无异常。神经科查体:意识模糊,查体欠合作,反应迟钝,言语流利,定向力、计算力和记忆力不能查,脑神经未见异常,双上肢肌张力正常,肌力5级,腱反射(++),双下肢肌张力减低,右下肢肌力2级,左下肢肌力1级,腱反射未引出,病理征阴性,感觉共济检查不合作,脑膜刺激征阴性。辅助检查:血常规、血培养、甲状腺功能、肝肾功能、心肌损伤标志物、肿瘤标记物全套、肌酶谱、抗中性粒细胞抗体谱、抗核抗体谱全套、尿微生物培养、肝炎病毒学、梅毒、人类免疫缺陷病毒、乳酸运动试验、心脏超声、脑脊液(压力、细胞学、常规、细菌、糖、氯化物、微生物培养、寡克隆带和AQP4)及TB-DNA未见异常。脑脊液蛋白定量741 mg/L(正常值150~450mg/L),脑脊液IgG 87.5 mg/L(正常值 4.8~58.6 mg/L),IgA 9.37mg/L(正常值0~2.0 mg/L),IgM 2.98 mg/L(正常值0.19~0.29 mg/L)。神经电生理体感诱发电位(SEP)示双上肢皮层记录P14波潜伏期延长,分化差;双下肢SEP皮层记录未引出反应,提示脊髓损伤可能。骨髓细胞病理分析与诊断提示骨髓象示三系增生,巨核系伴成熟障碍,未见异常细胞。头颅磁共振成像(MRI)可见双侧额颞顶叶非对称性皮质-皮质下长T1、长T2信号;磁共振颅脑动脉成像(MRA)未见异常;磁共振磁敏感加权成像(SWI)示多个脑叶皮质及白质出血(图1),脊髓MRI示胸11椎体平面脊髓至脊髓圆锥内长T2信号(图2)。因诊断困难,在充分知情同意下行左颞叶病灶活检术(图3)。根据患者的临床表现,体征、辅助检查和病检结果,最终患者诊断为脑淀粉样血管病相关炎症(CAA-ri),继续予甲泼尼龙针0.5 g静脉冲击治疗,递减后给予强的松60 mg/d顿服,每周减量5 mg/d,并抗癫痫、抗感染等支持治疗。患者激素治疗过程中病情及影像学一度好转,但总体病情逐渐加重,多次复查均有新发病灶或病灶范围扩大,3个月后电话随诊患者死亡,总病程7个月。

图2 CAA-ri累及脊髓患者脊髓神经影像学结果

图3 患者神经病理活检结果
2 讨论
迄今为止仍没有关于CAA-ri发病率、患病率等流行病学调查的文献报告,国内外研究大多为病例报告。2004年ENG等[4]首次报告了7例脑淀粉样血管病相关炎症(CAA-ri)患者,其临床表现主要为认知功能下降、神经功能缺损(如偏瘫、偏盲、失语)、癫痫发作以及头痛。2016年,AURIEL等[5]提出了该病诊断标准:①患者急性、亚急性或者慢性起病;②发病年龄≥40岁;③至少出现1种以下症状,头痛、行为或意识改变、局灶性神经功能障碍、癫痫(非急性脑出血继发);④MRI可见单发或多发的脑白质异常信号;⑤SWI提示≥1处皮质或皮质下出血病灶(包括脑出血、脑微出血、皮层表面铁沉积);⑥排除肿瘤,感染或其他病因;满足以上,则可诊断为很可能的CAA-ri;若满足以上①至⑥任意一条,有病理学证实的皮质或软脑膜血管Aβ蛋白沉积以及血管内或血管周围炎症,则可确诊为CAA-ri。目前国内因患者对脑活检接受度低,活检操作、病理诊断技术等实际操作过程复杂等原因,导致许多病例多为临床可能的诊断。本例患者为老年男性,慢性起病,首发神经系统症状为头痛、反应迟钝、胡言乱语及发作性左侧肢体无力。MRI示脑叶皮质及皮质下多发异常信号并出血,增强可见脑组织部分脑回样强化。腰椎穿刺脑脊液中曾发现红细胞,蛋白及免疫球蛋白轻度增高。病理活检示病灶脑组织内有出血,血管炎性细胞浸润以及淀粉样物质沉积。该病诊断明确。同时本例患者在病程中出现双下肢瘫痪,尿潴留,神经电生理和MRI提示本病可累及脊髓。目前国内罕见有累及脊髓的CAA-ri病例报告。
CAA-ri是脑淀粉样血管变性的一种特殊类型,CAA的病理特征为淀粉样蛋白沉积在血管壁内,而CAA-ri除了血管壁内淀粉样蛋白沉积外,还可在血管壁或血管周围引起炎性反应[6],并可形成特征性的血管周围淋巴套袖[7]。目前报告了CAA-ri炎性表现的两种亚型:CAA-ri(具有血管周围炎症但不影响血管壁)和ABRA(amyloid-β-related angiitis)血管壁炎症,这两种亚型可单发也可同时发生,提示其发病机制可能有部分重叠[8]。该患者行活检之后确诊CAA-ri,且符合ABRA亚型。CAA中淀粉样蛋白大多在大脑血管和软脑膜上沉积,偶可累及小脑,但在脑干和脊髓沉积很少见[1,9]。关于国际上CAA淀粉样蛋白累及脊髓的报告不多,TOKUDA等[10]报告1例反复脑叶出血的CAA患者,通过尸体解剖发现主要在脊髓腹侧的血管也出现了淀粉样表现。但YAMADA等[11]描述了123个尸检大脑,包括CAA 70例中,仅显示1例脊髓血管的淀粉样血管病,提示累及脊髓的CAA仍然罕见。CAA-ri累及脊髓的机制目前尚不清楚,推测可能为:CAA-ri主要为Aβ蛋白沉积在血管壁引起炎症反应,可能该患者脊髓Aβ蛋白产生过多或降解、移除过少,而引起罕见的脊髓内CAA-ri。
目前仍然缺乏充分的CAA-ri治疗的循证医学研究。现有的CAA-ri研究报告推荐首选类固醇激素治疗,并建议症状稳定及缓解后延长激素治疗1~2年[1]。病情严重或确诊为ABRA亚型时,可加用环磷酰胺静脉注射治疗3~6个月[1]。超过一半的CAA-ri患者免疫抑制治疗可得到改善,但大多数患者预后不良,并将近60%的患者死亡或治疗依赖[12]。该病大部分患者为单相病程,约四分之一的患者出现复发[13],而且复发通常发生在之前受累的病灶范围[14],本例患者复发病灶也符合该规律。但该例患者对治疗反应不佳,未尝试使用免疫抑制剂及其他免疫治疗方法,出院3个月后死亡,推测其死亡原因可能为脑组织病变加重或合并其他系统感染。所以,早期识别和治疗该疾病很重要。总而言之,如果医生在临床工作中遇到类似患者,应该考虑该病的可能性,尽管该病较为罕见,尽快完善脑组织活检以确诊,从而可能帮助患者改善预后。

