布洛芬颗粒在中国健康受试者体内的人体生物等效性研究
张迅杰,咸瑞卿,由鹏飞,巩丽萍,李春焕,赵艳霞,彭 丽,石 峰*
(1.山东省食品药品检验研究院 国家药品监督管理局仿制药研究与评价重点实验室 山东省仿制药一致性评价工程技术研究中心,山东 济南 250101;2. 华润双鹤利民药业(济南)有限公司 质量部,山东 济南 250200)
布洛芬(又名异丁苯丙酸)是芳基丙酸类衍生物中第一个用于临床的非甾体类解热镇痛药(NSAID)[1-2],具有较强的抗炎、抗风湿及解热镇痛作用,用于缓解轻至中度疼痛如头痛、关节痛、偏头疼、痛经等,也可减轻普通感冒或流行性感冒引起的发热[3]。布洛芬作为有效的环氧化酶(COX)抑制剂,尤其对COX-2有特异性的抑制作用,从而抑制炎症部位原发性前列腺素合成酶(PGS)合成,降低 PGS引起的组织充血、肿胀及对周围神经痛觉的敏感性,达到抗炎镇痛作用[4];同时,由于其对前列腺素(PG)合成的抑制,使体温调节定点恢复至正常水平,皮肤血管扩张而发挥解热作用[5-7]。本研究建立一种测定血浆中布洛芬浓度的超高效液相色谱串联质谱(UPLC-MS/MS)方法,进行布洛芬颗粒在中国健康受试者空腹及餐后状态下体内药动学及人体生物等效性研究,为布洛芬一致性评价提供依据。
1 仪器与试药
1.1 仪器
AB SCIEX Triple Quad 5500液相色谱-质谱联用系统(美国AB SCIEX公司);3K15台式高速冷冻离心机(德国Sigma公司);Allegra X-15R台式高速冷冻离心机(96孔板,美国贝克曼库尔特公司);MDF-U5412N医用低温箱(日本松下公司);Milli-Q Advantage A10超纯水器(美国Millipore公司);DG-2500R多管漩涡混合仪(上海巴玖实业有限公司)。
1.2 试药
布洛芬对照品(纯度:97.9 %,中国食品药品检定研究院);布洛芬-d3对照品(化学纯度:98 %,同位素内标纯度:99.9 %,加拿大TRC公司);甲醇,乙腈(色谱纯,德国Merk公司);甲酸(色谱纯,美国ACS恩科化学公司);N, N-二甲基甲酰胺[DMF,色谱纯,赛默飞世尔科技(中国)科技有限公司];受试制剂:布洛芬颗粒(规格:0.2 g,批号:200603N);参比制剂:布洛芬颗粒(规格:20 %,1 g,批号:J94880,Kaken Pharmaceutical Co., Ltd.)。
1.3 数据处理软件
Analyst 1.6.3(美国AB SCIEX公司);Watson LIMS 7.5 SPS1(美国赛默飞世尔公司)。
2 方法与结果
2.1 对照品溶液的配制
2.1.1 布洛芬对照品溶液的配制 取适量布洛芬对照品,精密称定,加DMF制成浓度为 2.0 mg/ml的布洛芬对照品溶液,-20 ℃避光保存。
2.1.2 内标(布洛芬-d3)溶液的配制 精密称取布洛芬-d3对照品适量,加DMF制成浓度为 2.0 mg/ml的内标储备液;精密移取内标储备液适量,用DMF溶液稀释得浓度为100 µg/ml的内标工作溶液I;精密移取100 µg/ml内标工作溶液I适量,用0.1 %甲酸乙腈溶液稀释,得浓度为0.5 µg/ml的内标工作溶液,-20 ℃避光保存。
2.2 样品预处理
取2 ml深孔96孔板,每孔加100 µl血浆样品,向其中加0.5 µg/ml内标工作溶液400 µl,涡旋混匀5 min,置4 ℃台式高速冷冻离心机(96孔板)中离心10 min(4750 r/min) ,取上清100 µl,转移至另一2 ml深孔96孔板,向新的96孔板中加入10 %乙腈水溶液300 µl稀释,涡旋混匀5 min,待测。
2.3 分析条件
2.3.1 UPLC条件 色 谱 柱:Infinity Lab EC-C18(2.1 mm×50 mm,2.7 µm);柱温:40 ℃ ;流动相为 0.001 %甲酸水(A相)和乙腈(B相);梯度洗脱程序见表1。流速:0.5 ml/min;进样量:3 µl。

表1 梯度洗脱程序
2.3.2 质谱条件 电离方式:电喷雾离子源(ESI),负离子模式;离子源温度:550 ℃ ;检测模式:多反应监测(MRM)模式;离子化电压:-4500 V ;入口电压(EP):-10 V;碰撞室出口电压(CXP):-29 V;喷雾气压力(Gas1):50 psi;辅助加热气压力(Gas2):55 psi;气帘气压力:35 psi。布洛芬监测离子对为m/z 205.1/161.1,碰撞能量(CE):-10 V,去簇电压(DP):-50 V;布洛芬-d3监测离子对为m/z 208.1/164.2,CE:-10 V,DP:-50 V。
2.4 试验设计
本项目筛选48例受试对象,身体质量指数(BMI)为18.0~28.0 kg/m2;受试者均进行健康体格检查,心电图、实验室项目(血生化、血常规、传染性疾病筛查等)、胸片及试验相关各项检查、检测均正常或无临床意义的异常;女性受试对象为非哺乳期,无妊娠状态;所有受试对象均自愿参加本次临床试验,且均已签署书面知情同意书并理解研究程序,能按试验方案要求完成本研究项目。
本次临床研究采用单中心、随机、开放、单剂量、两周期、两序列、交叉、单次给药试验设计,进行空腹及高脂餐后两种状态下的制剂间生物等效性研究。空腹组24例受试者,餐后组24例受试者,空腹组和餐后组均随机分为两组,每组12人,按照给药顺序表分别给予受试制剂和参比制剂。所有受试者给药方法:空腹或高脂餐后30 min口服,240 ml温水服用 。给药剂量为0.2 g。第I周期12例受试者口服受试制剂0.2 g,另12例受试者餐后口服参比制剂0.2 g,2 d后交叉给药进行第II周期研究。空腹试验:给药 0 h (给药前 1 h内)和 5 min,15 min,0.5 h,0.75 h,1 h,1.25 h,1.5 h,2 h,3 h,4 h,6 h,8 h,10 h,12 h,共 15个时间点,分别采集静脉血4 ml;餐后试验:给药0 h (给药前1 h内)和给药后5 min,15 min,0.5 h,0.75 h,1 h ,1.25 h,1.5 h,2 h,3 h,4 h,6 h,8 h,10 h,12 h,14 h,共 16个时间点,分别采集静脉血4 ml,空腹或餐后采集的静脉血均置EDTA-K2抗凝真空采血管中, 室温放置,1 h内离心(2000 g、4 ℃)10 min。室温分离血浆,置超低温冰箱(≤-60 ℃)中冷冻保存,用于血药浓度测定。
3 结果与分析
3.1 方法学考察[8]
3.1.1 线性范围 用移液器取适量空白血浆,用移液器加入不同浓度的布洛芬对照品溶液,配制浓度分别为0.200,0.400,1.00,3.00,9.00,18.0,24.0,30.0 µg/ml的布洛芬血浆样品。分别按2.2项下方法处理样品,按2.3项下分析条件测定。每个分析批的标准曲线采用双校正样品拟合,以布洛芬与布洛芬-d3的色谱响应比值为纵坐标(y),以血浆中布洛芬的浓度为横坐标(x,µg/ml),采取加权(W=1/X2)最小二乘法进行线性回归,求得回归方程为y=0.299040x+0.00232731(n=11),拟合度r2为0.9988,校正样品回算浓度均在要求范围之内,说明布洛芬在0.200~30.0 µg/ml范围内线性良好,由此计算的药物浓度准确可靠。本方法的定量下限为0.200 µg/ml,并满足信噪比S/N>10。
3.1.2 残留 通过在注射高浓度样品后注射空白基质样品(空白血浆)来评价残留,结果见图1。图A为定量上限(30.0 µg/ml)样品离子色谱图,布洛芬和布洛芬-d3经色谱分离后,均能得到较好的响应值与峰形。图 B为注射定量上限(30.0 µg/ml)样品后的空白血浆样品色谱图。将图 A 与图 B进行比较,发现空白血浆样品的色谱图在布洛芬和布洛芬-d3的色谱峰附近没有干扰峰出现,说明该方法的残留小,对布洛芬和布洛芬-d3的定量均无影响。图C为受试者服用布洛芬4 h后的血浆样品离子色谱图,结果表明该方法在用于实际血浆样品测定时在相应保留时间处无飘移。
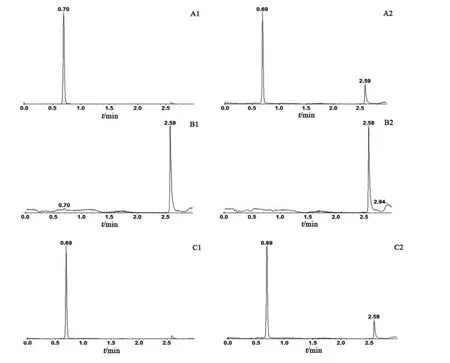
图1 各样品的离子色谱图
3.1.3 精密度与准确度 配制含布洛芬定量下限(0.200 µg/ml)和低、中、高(0.600,4.00,20.0 µg/ml)4个浓度水平的质控样品,按 2.2项下方法处理样品,在至少2 d内测定3个不同分析批,评价本方法的批内、批间准确度和精密度,结果见表2。结果表明该方法精密度、准确度均良好,符合中国药典2020年版四部《通则9012生物样品定量分析方法验证指导原则》。
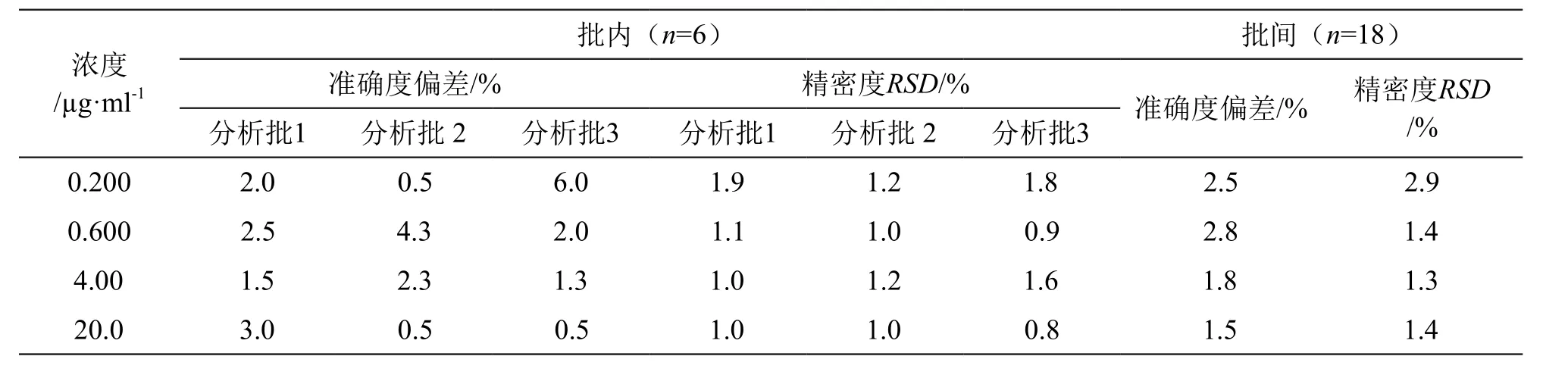
表2 准确度与精密度
3.1.4 选择性、基质效应和提取回收率
3.1.4.1 选择性 取6个受试者的空白血浆制备空白基质样品与定量下限样品,空白基质样品除用400 µl 0.1 %甲酸乙腈溶液代替内标工作溶液外,其余步骤按2.2 项下方法进行预处理,定量下限样品按2.2项下方法进行前处理,进样分析。本研究6个受试者的空白基质干扰组分在布洛芬和布洛芬-d3保留时间处的响应均为0,表明该方法具有良好的选择性,能区分布洛芬和布洛芬-d3与基质中的内源性组分。
3.1.4.2 基质效应 取6个受试者的空白基质、1个高血脂空白基质及1个溶血空白基质制备不添加待测物和内标的空白基质样品,按2.2项下方法处理,向处理后的空白基质样品中分别加入低质控浓度(LQC,0.600 µg/ml)和高质控浓度(HQC,20.0 µg/ml)布洛芬和布洛芬-d3的混合溶液,配制基质效应评价样品,进样分析,所得布洛芬和布洛芬-d3响应与相同理论浓度的纯溶液样品的布洛芬和布洛芬-d3响应比较,用内标归一化的基质因子的变异系数(CV)评价基质效应,结果见表3。结果6个受试者、高脂及溶血空白基质样品的内标归一化基质因子的CV均不超过15 %,表明该方法的基质效应符合要求。

表3 基质效应评价结果
3.1.4.3 提取回收率 取空白基质,按2.2项下方法处理,加入布洛芬和布洛芬-d3,进样测定,比较二者的峰面积均值,考察布洛芬(低、中、高 3个质量浓度)和布洛芬-d3的提取回收率。3种浓度布洛芬的提取回收率分别为115.3 %,113.3 %,116.5 %,布洛芬-d3的提取回收率为114.5 %。结果表明该方法提取回收率较高,在处理过程中不会对定量结果造成影响。
3.1.5 稳定性 用新鲜制备的校准标样及质控样品,考察放置不同储存条件下的样品中布洛芬的稳定性。分别考察了血浆样品反复冻融循环5次(冷冻条件:-80 ℃,融化条件:室温)、室温条件下放置27 h、蛋白沉淀后血浆样品在自动进样器温度(8 ℃)条件下放置98 h及血浆样品在冷冻条件下(-80 ℃,-20 ℃)放置61 d的稳定性,结果见表4。由表4可见,布洛芬血浆样品在考察条件下稳定。
表4 不同条件下的稳定性考察结果(±s,n=3)
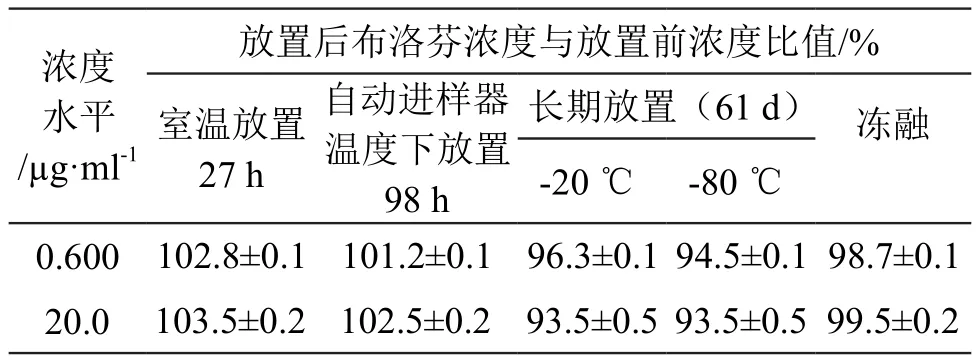
表4 不同条件下的稳定性考察结果(±s,n=3)
浓度水平/µg·ml-1放置后布洛芬浓度与放置前浓度比值/%室温放置27 h自动进样器温度下放置98 h -20 ℃ -80 ℃0.600 102.8±0.1 101.2±0.1 96.3±0.1 94.5±0.1 98.7±0.1长期放置(61 d) 冻融20.0 103.5±0.2 102.5±0.2 93.5±0.5 93.5±0.5 99.5±0.2
3.2 布洛芬颗粒药动学性质及生物等效性
使用本研究建立的UPLC-MS/MS方法对血浆中布洛芬浓度进行测定,评价空腹和餐后条件下两制剂之间是否具有生物等效性。以时间为横坐标、测定的布洛芬血药浓度为纵坐标,分别绘制空腹和餐后条件下受试制剂及参比制剂的布洛芬平均血药浓度-时间曲线,见图 2。

图2 健康受试者在空腹(A,n=24)和餐后(B,n=24)条件下单剂量口服布洛芬颗粒受试制剂(T)或参比制剂(R)的平均血药浓度-时间曲线图
采用Phoenix WinNonlin 8.2软件计算两种布洛芬颗粒剂的药动学参数(AUC0-t、AUC0-∞、Cmax、λz、t1/2、AUC_%Extrap),结果见表5。主要药动学参数(AUC0-t、 AUC0-∞、Cmax)经对数转换后进行多因素方程分析,同时采用(1-2α)计算两种制剂的主要药动学参数几何均值比的90 %置信区间(CI),评价两种制剂的生物等效性。24例受试者空腹口服布洛芬颗粒受试制剂和参比制剂的Cmax、AUC0-t、AUC0-∞几何均值比的90 % CI分别落在86.03 %~102.50 %、100.50 %~108.15 %和100.53 %~108.09 %范围内,24例受试者餐后口服布洛芬颗粒受试制剂和参比制剂的Cmax、AUC0-t、AUC0-∞几何均值比的90 % CI分别落在94.05 %~109.26 %、96.71 %~102.74 %和96.59 %~102.48 %范围内,均在80.00 %~125.00 %等效区间内(包括边界值),符合生物等效性评价标准。此外,本试验中空腹给药后布洛芬Cmax、AUC0-t、AUC0-∞的个体内变异CV分别为17.80 %,7.41 %,7.33 %;餐后给药组的个体内变异CV分别为14.83 %,5.96 %、5.83 %,均小于30 %,不属于高变异药物。经对数转换后的AUC0-t、AUC0-∞和Cmax多因素方差分析结果显示给药周期、给药序列、个体、制剂间的差异均具有统计学意义(P<0.05)。结果表明本研究中两种制剂在空腹和餐后条件下口服给药均生物等效。
表5 空腹和餐后口服受试制剂和参比制剂后血浆中布洛芬药动学参数(±s,n=24)

表5 空腹和餐后口服受试制剂和参比制剂后血浆中布洛芬药动学参数(±s,n=24)
注:*tmax用中位数(最小值,最大值)表示
参数 空腹(CV/%) 餐后(CV/%)受试制剂 参比制剂 受试制剂 参比制剂*tmax/h 1.00(0.25,3.00) 0.25(0.25,1.50) 4.00(2.00,8.00) 4.00(0.25,8.00)Cmax/μg·L-1 21.8±4.21(19.3) 23.3±4.74(20.3) 10.7±2.25(21.1) 10.6±2.57(24.3)AUC0-t/μg·L-1·h-1 71.83±16.08(22.38) 69.02±16.34(23.68) 65.27±13.79(21.13) 65.76±16.37(24.90)AUC0-∞/μg·L-1·h-1 72.89±16.27(22.32) 70.04±16.53(23.60) 66.45±14.13(21.26) 67.12±16.93(25.23)λz/h-1 0.36±0.06(17.97) 0.35±0.05(15.34) 0.32±0.06(19.45) 0.32±0.06(20.37)t1/2/h 1.99±0.37(18.74) 2.00±0.30(15.22) 2.25±0.50(22.24) 2.31±0.60(25.89)AUC_%Extrap/% 1.47±0.54(36.50) 1.48±0.46(31.14) 1.76±0.96(54.83) 1.94±1.29(66.32)
4 讨论
本研究建立的测定人血浆中布洛芬含量的方法具有灵敏度高、准确可靠、选择性好、基质效应小、快速简便等优点。该方法使用0.1 %甲酸乙腈对血浆样品进行蛋白质沉淀,并将内标直接溶解于沉淀剂中,使操作步骤更简化,减少了有机试剂的消耗。为获得更高灵敏度和更好峰形,选用0.001 %甲酸水和乙腈为流动相。此外为了减小该分析方法的基质效应,将蛋白沉淀离心后的上清进行3:1稀释(稀释液:10 %乙腈水)。本试验为布洛芬颗粒及布洛芬缓释胶囊等制剂的生物等效性研究提供了数据参考,适用于布洛芬的血药浓度检测及药动学研究,可为布洛芬颗粒及布洛芬相关制剂一致性评价提供依据。
受试者高脂高热餐后口服布洛芬颗粒后,布洛芬的平均最大血浆浓度Cmax明显降低, tmax较空腹服药明显延迟,这可能是由于胃排空速率受食物的影响,使药物在胃中停留时间延长,从而降低了药物的吸收速度和程度,这与国外研究的布洛芬片剂高脂饮食后的tmax与Cmax的变化趋势一致[9]。此外,高脂高热饮食后服药较空腹条件下服药AUC0-t减少,餐后服药的tmax明显延迟。因此食物对布洛芬颗粒的吸收速度和程度均有影响。

