重组葡萄糖脱氢酶酶学性质研究
张秀华,刘英梅,郭新艳,张小刚,张艳艳,张晓元,刘 飞
(山东省药学科学院 山东省生物药物重点实验室 山东省多糖类药物工程实验室 多糖类药物发酵与精制国家地方联合工程实验室,山东 济南 250101)
氧化还原反应是酶法催化中的一类重要反应,在手性醇、羟基酸、手性胺等制备过程中均有发生,氧化还原反应中需要大量的辅酶NAD(P)H参与,而辅酶价格昂贵,限制了其工业应用。因此利用酶法高效、低成本地再生还原态辅酶,实现辅酶循环是氧化还原反应实现工业化应用的关键[1-2]。
葡萄糖脱氢酶(EC 1.1.1.47,glucose 1-dehydrogenase,GDH)主要来自于芽孢杆菌属,能特异性地催化D-葡萄糖生成葡萄糖酸,并伴随辅酶NAD(P)+向还原型辅酶NAD(P)H的转化,因此在辅酶循环系统中,GDH通常为生物催化氧化还原反应提供还原氢[3-4]。GDH是一种细胞内蛋白,在多种菌株种都有表达,但不同来源的GDH生化特性(活性、酶学特性)不同[5],因此针对不同的催化反应需筛选不同来源的酶。
3A-羟基-7-氧代-5B-胆烷酸是酶法催化生成熊去氧胆酸的底物,该底物不溶于水,易溶于有机溶剂,且在碱性条件下溶解性较好,而酶与缓冲液均溶解于水相体系,因此该反应需在水相和有机相双相体系中进行。GDH是该反应中辅酶再生的关键,筛选一种耐碱、耐有机溶剂的GDH是酶法工业化生产熊去氧胆酸的关键。
为解决酶法催化3A-羟基-7-氧代-5B-胆烷酸生成熊去氧胆酸反应中辅酶再生问题,本实验室前期从土壤中筛选得到一株产GDH的枯草芽孢杆菌,在大肠杆菌Escherichia coli BL21 (DE3)中进行了重组表达。本文对重组葡萄糖脱氢酶(rGDH)最适反应温度、最适pH、辅酶依赖性、有机溶剂耐受性、金属离子耐受性、动力学常数等酶学性质进行了研究,以为其工业化应用提供支持。
1 仪器与材料
1.1 仪器
1.2 试剂
烟酰胺腺嘌呤二核苷酸(简称辅酶I,NAD+),还原型烟酰胺腺嘌呤二核苷酸磷酸(简称还原型辅酶II,NADPH),烟酰胺腺嘌呤二核苷磷酸(NADP+,上海源叶);蛋白分子量标记物(Thermo Fisher Scientific);异丙基硫代-β-D-半乳糖苷(IPTG,索莱宝生物科技有限公司),Ni NTA Beads(常州天地人和生物科技有限公司);其他试剂均为国产或进口分析纯。
1.3 菌株与培养基
E. coli DH5α,E. coli BL21 (DE3),重组大肠杆菌E. coli BL21-pET22b-GDH均为本实验室保存。液体LB培养基(g/L):蛋白胨10,酵母粉5,氯化钠10;固体LB培养基含1.5 %~2 %琼脂粉;TB培养基(g/L):蛋白胨12,酵母粉24,甘油4,磷酸二氢钾2.31,磷酸氢二钾12.54。
2 方法
2.1 rGDH蛋白的表达及纯化
将E. coli BL21-pET22b-GDH工程菌接种至含50 μg/ml氨苄霉素的LB液体培养基中,37 ℃振荡培养过夜。将其作为种子液以5 %接种量转接入TB培养基中,37 ℃培养至OD600为0.6时,加入终浓度为0.5 mmol/L的IPTG进行诱导,降低温度至16 ℃继续培养20 h。收集菌体进行超声破碎(功率400 W,超声5 s,间歇5 s,超声时间20 min),12 000 r/min离心15 min,收集上清,0.22 μm滤膜过滤,得粗酶液。
粗酶液采用镍离子亲和层析柱进行纯化,平衡缓冲液为50 mmol/L NaH2PO4、300 mmol/L NaCl、10 mmol/L咪唑(pH 8.0),洗涤缓冲液为50 mmol/L NaH2PO4、300 mmol/L NaCl、25 mmol/L咪唑(pH 8.0),洗脱缓冲液为50 mmol/L NaH2PO4、300 mmol/L NaCl、250 mmol/L咪唑(pH 8.0)。分别收集穿透峰、洗涤峰和洗脱峰进行SDS-PAGE电泳分析,收集rGDH蛋白峰,除盐,得到纯化后的rGDH蛋白。
2.2 rGDH酶活测定
rGDH酶活测定参考张波涛[6]方法并略有改进。总反应体系为200 μl,分别加入终浓度为75 mmol/L的Tris-HCl(pH 8.0)、2 mmol/L的NADP+、0.1 mol/L的D-葡萄糖,室温放置2 min,加入适量酶液检测2 min内340 nm处吸光值的变化。配制浓度为0,0.1,0.2,0.3,0.4,0.5 mmol/L的系列NADPH标准溶液,在340 nm处测定吸光值,以NADPH标准溶液浓度为横坐标,以吸光值为纵坐标绘制标准曲线,由标准曲线计算反应产生NADPH的量。在上述条件下每分钟生成1 μmol NADPH所需的酶量定义为一个酶活单位(U)。蛋白质含量采用Bradford法测定,以牛血清白蛋白为标准品。按下式计算酶比活。
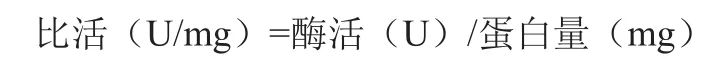
标准曲线绘制:根据标准曲线计算NADPH的量。
2.3 rGDH最适反应温度及温度稳定性测定
按2.2项下方法测定rGDH在不同温度(25~65 ℃,温度间隔为5 ℃)下的相对酶活力,以最高相对酶活力对应的温度定义为rGDH的最适反应温度。将酶液置于25~65 ℃下保温1 h,按2.2项下方法测定残留酶活力,以存放于4 ℃的样品酶活作为最高酶活。
2.4 rGDH最适反应pH及pH稳定性测定
在最适温度下,按2.2项下方法测定rGDH在不同pH缓冲液[100 mmol/L 柠檬酸-Na2HPO4缓冲液(pH 3.0~7.0),100 mmol/L Tris-HCl缓冲液(pH 7.5~9.0),100 mmol/L Gly-NaOH 缓冲液(pH 9.5~13)]中的相对酶活力,将最高相对酶活对应的pH定义为rGDH的最适反应pH。将酶分别放置在不同pH的缓冲液中,4 ℃放置24 h,按2.2项下方法测定残留酶活力,从而判断rGDH在不同pH 值下的稳定性。
苏婷婷在前面,杰克跟在后面,杰克不解地:婷婷,你听我说,我没想到会是这样。苏婷婷面无表情:我说过了,你这一套对付我可以,对付我爸不行!杰克耸耸肩:我搞不明白?难道你不是你爸生的?苏婷婷停下来,转过身无奈地:杰克,要不咱们分手吧?杰克愣了,严肃地摇着头:N O N O!婷婷,我爱你,真的爱你!用中国话说,海枯石烂!天长地久!在天愿作比翼鸟,在地还作比翼鸟。说着,他伸开胳膊,做出飞鸟状。苏婷婷上前搂住他的脖子,杰克顺势把她抱起来,向前跑去:咱们飞了!
2.5 金属离子和EDTA对rGDH酶活的影响
将纯化后的重组rGDH与终浓度为2 mmol/L的不同金属离子(Cu2+、Mg2+、Na+、Co2+、Ba2+、Ni2+、Mn2+、Zn2+、Fe2+、Al3+)、EDTA溶液混合,40 ℃保温1 h,按2.2项下方法测定残余酶活力。同样条件下不加金属离子和EDTA处理的酶活定义为100 %,当残余酶活力为80 %以下即定义为有抑制作用[7]。
2.6 rGDH有机溶剂稳定性测定
将纯化后的重组rGDH与等体积的不同有机溶剂(乙醇、正丁醇、甲醇、正戊醇、正己烷、N,N’-二甲基甲酰胺、丙酮、环己酮、异丙醇、乙酸乙酯)混合,按2.2项下方法测定酶活力,将同样条件下只加缓冲液处理的酶活定义为100 %。当残余酶活力为50 %以下即定义为该有机溶剂对酶有明显的抑制作用。
2.7 rGDH底物谱分析及动力学参数测定
按2.2项下方法,分别以D-葡萄糖、D-木糖、D-半乳糖、乳糖、麦芽糖、蔗糖、D-甘露糖、D-果糖为底物,测定rGDH的相对酶活力。将最高相对酶活力所对应的底物定义为最适底物。以不同浓度的D-葡萄糖(0.05~0.5 mol/L)为底物,按2.2项下方法,采用Origin 2018软件进行非线性拟合,计算rGDH对D-葡萄糖的Km值。
2.8 rGDH辅酶偏好性分析
按2.2项下方法,以D-葡糖糖为底物,分别以NAD+和NADP+为辅酶,分别测定纯化后的rGDH酶活,确定rGDH辅酶偏好性。
3 结果
3.1 rGDH蛋白的诱导表达及纯化
重组菌经超声破碎、离心后得到粗酶液, 粗酶液经镍离子亲和层析柱纯化,经SDS-PAGE分析检测,结果见图1。结果显示穿透峰和洗涤峰中均为杂蛋白,纯化后的rGDH为单一条带(泳道4),在最适反应条件下测得其比活为12 U/mg。

图1 rGDH 纯化后SDS-PAGE结果
3.2 rGDH最适反应温度及温度稳定性
结果见图2。由图2可见,rGDH最适反应温度为40 ℃,在35~50 ℃范围内酶催化活力较高。研究发现,rGDH温度稳定性较差,在40 ℃以下可保持较高酶活力,但当温度大于40 ℃时酶活力急剧下降,当温度达到55 ℃时酶活力几乎完全丧失。
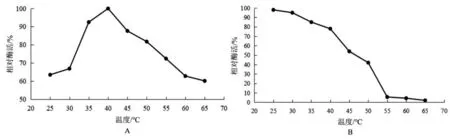
图2 rGDH最适反应温度及温度稳定性
3.3 rGDH最适反应pH及pH稳定性测定
结果见图3。由图3可见,rGDH最适反应pH为10.5,在pH 9.5~11范围内酶催化活力较高,说明该酶耐碱性较强。同样,该酶的pH稳定性也较差,仅在pH 9~11范围内保持较高酶活力,当pH过高或过低时酶活力均急剧下降。
图3 rGDH最适反应pH及pH稳定性
3.4 金属离子和EDTA对rGDH酶活的影响
结果见图4。结果表明,Zn2+、Ba2+、Mn2+、EDTA、Al3+、Fe2+均对rGDH酶活有促进作用,其中以Zn2+的酶活促进作用最强,相对酶活力可达140 %。Ni2+、Na+、Co2+对酶活影响不明显,Mg2+、Cu2+对rGDH酶活有抑制作用,其中以Cu2+抑制作用最强,相对酶活仅50 %。

图4 金属离子和EDTA对rGDH酶活的影响
3.5 rGDH有机溶剂稳定性
结果见图5。由图5可见,几乎所有有机溶剂会降低rGDH酶活,其中以正己烷影响作用最小,rGDH与正己烷混合后,酶活力仍保持在95 %以上,说明该酶对正己烷具有较好的耐受性;而在异丙醇、丙酮、乙酸乙酯、甲醇、乙醇、正戊醇、环己酮、正丁醇、N, N’-二甲基甲酰胺中rGDH残留酶活不足30 %,说明有机溶剂对rGDH酶活有很大影响。

图5 rGDH有机溶剂稳定性
3.6 rGDH底物谱分析及动力学参数测定
结果见图6。由图6可见,rGDH底物特异性较强,当以D-葡萄糖为底物时其催化活性最高,rGDH对乳糖的催化活性是对D-葡萄糖催化活性的48 %,而对D-木糖、D-半乳糖、麦芽糖、蔗糖、D-甘露糖、D-果糖几乎无催化活性。通过Origin 2018进行非线性拟合,计算得到rGDH对D-葡萄糖的Km值为0.3 mol/L。
3.7 rGDH辅酶偏好性分析
结果见图7。由图7可见,该酶在催化NAD+和NADP+两种底物时均具有较高的酶活,说明rGDH是一种NAD+、NADP+双辅酶依赖型葡萄糖脱氢酶,可同时用于还原性辅酶NADH和NADPH的再生,但对NAD+的亲和力更强。

图7 rGDH辅酶偏好性分析
4 讨论
GDH应用非常广泛,在临床上可作为血糖测定的诊断用酶,在医药工业领域可为生物催化反应提供还原氢,进行辅酶再生[7]。近年,随着合成生物学的发展,GDH的研究也较多。本研究从土壤中筛选得到一株产GDH的枯草芽孢杆菌,提取其基因组后利用PCR扩增出GDH基因序列。将扩增得到的基因序列与Genebank中已报道的序列进行序列比对,发现该酶与已报道的MH192986葡萄糖脱氢酶氨基酸同源性达82 %,但后者未报道其酶学特性。
本课题中筛选得到的rGDH酶活高,比活达到12 U/mg,高于目前报道的水平[6,8-11]。酶学性质测定显示该酶对有机溶剂正己烷有很高的耐受性,相对酶活达95 %,同时该酶耐碱性良好,在pH 9.0~11.0范围内有很高酶活,耐碱性优于Ding等[12]报道的从球形芽孢杆菌G10中克隆的耐碱性GDH。良好的有机溶剂耐受性和耐碱性为熊去氧胆酸的转化奠定了良好的基础,具备了适合工业应用的理想特性。在制备熊去氧胆酸转化偶联辅酶再生体系中,添加rGDH后熊去氧胆酸的产率达98 %,是未添加rGDH的40倍,表明rGDH可为生物催化反应提供辅酶再生,解决了生物催化反应中辅酶限制问题。
为进一步提升该酶的工业应用价值,后续研究将基于定向进化[13]和理性设计[14]理念,提升rGDH催化稳定性和对其他有机溶剂的耐受性。

