不同释放机制硝苯地平缓释片的生物等效性差异比较
傅咏梅,卢伟玲,黄后楷
(国药集团广东环球制药有限公司,广东 佛山 528305)
硝苯地平是一种二氢吡啶类钙拮抗剂,作为一线药物,广泛应用于高血压的治疗,但其半衰期短(2~3 h),在服药30~45 min 即达到血药峰值,易引起较大的血压波动[1]。目前,市场上临床用于高血压患者平稳降压的硝苯地平制剂多为缓控释制剂,国际市场上常用的剂量有10 mg(日本上市)、20 mg(日本上市)、30 mg(欧美上市)、40 mg(日本上市)、60 mg(欧美上市)、90 mg(欧美上市)。硝苯地平缓释片(30 mg)目前主要是在欧盟和美国上市,产品主要运用了骨架包芯压片缓释技术和激光打孔缓释技术2 种缓控释技术,2 种技术的产品互不等效,在FDA Orange Book 中生物等效性代码分别是AB1 和AB2。本文以硝苯地平缓释片(30 mg)为主要产品,从上市原研药品特性、仿制制剂的研究开发等方面对2 种缓释技术分别进行综述,旨在为分析两者生物等效性差异提供参考依据。
1 激光打孔技术
1.1 上市产品
药品规格为30 mg的产品,上市产品主要有德国拜耳公司和美国辉瑞公司,其中德国拜耳公司的产品商品名较多,分别为Adalat GITS(2000年中国上市)、Adalat LA(1998年德国上市)、Adalat OROS(1992年在西班牙和挪威上市)、Adalat CR(1996年希腊上市)等,拜耳公司的产品未在美国上市。美国上市的产品是辉瑞公司的Procardia XL(美国1989年上市,未进口至国内)。
1.2 技术特点和体外溶出曲线
该产品采用经典的渗透泵技术,片芯为双层片,由含药层和助推层构成,包衣膜为具有半透膜特性的醋酸纤维素。当水分从半透膜进入片芯后,助推层中的高分子材料聚氧乙烯(PEO)吸水膨胀,产生较高的溶胀压和渗透压,推动含药层中的药物混悬液从释药孔中恒速释放出来,释药速度不受胃肠道蠕动、pH、食物、胃排空时间等因素的影响,可控制药物呈零级释放(后述FDA 的资料显示只有一家公司采用了骨架外加膜控包衣技术,做到了与激光打孔技术生物等效性一致)。在美国FDA 橙皮书生物等效性代码为AB2的产品,其典型的体外溶出曲线见图1。

图1 FDA橙皮书硝苯地平缓释片(AB2)典型体外溶出曲线Figure 1 Typical in vitro dissolution curves of nifedipine sustained release tablets(AB2)in FDA orange book
1.3 国外仿制制剂的研究情况
以“nifedipine”“bioequivalent”或“bioequivalence”为关键词在PubMed 医学文献检索服务系统进行检索,对美国FDA 生物等效性申报资料综合分析研究,以探讨硝苯地平非渗透泵片仿制制剂与硝苯地平渗透泵片生物等效的关系。
1.3.1 PubMed 医学文献检索信息 Merck Generics Italia 公司开发的Nifedipina(意大利上市)[2],为日服一次的硝苯地平单层骨架片。在与硝苯地平控释片的生物等效性试验中发现,与对照药Adalat OROS(激光打孔产品)相比,餐后服用Nifedipina 后药物在体内仅有约0.5 h的时滞,与Adalat OROS 的1.5 h 的滞留时间差异较为明显;Nifedipina 的AUC0~last和Cmax分别为Adalat OROS 的1.4 倍和4 倍,Nifedipina 出现明显的“剂量倾斜”(dose-dumping)现象(见图2)。因此,餐后的条件下,nifedipina 与Adalat OROS 在生物等效性上存在明显差异。

图2 Nifedipina(T)和Adalat OROS(R)30 mg 单剂量餐后给药的药时曲线Figure 2 Drug time curves of single dose postprandial administration of nifedipina(T)and Adalat OROS(R)30 mg(n=12)
D.R.Drug Research S.R.L 公司开发的一款溶蚀型骨架片CORAL(意大利上市)[3],为日服一次的剂型。与Adalat OROS 的体内相关性试验中发现,在餐前和餐后的情况下,CORAL 均未出现如Adalat OROS(激光打孔产品)的时滞情况。对比餐前和餐后的血药浓度,CORAL在餐后服药约5 h的血药浓度上升明显,出现“剂量倾斜”现象;与之相反,Adalat OROS 不管在餐前还是餐后的条件下,血药浓度未有明显变化(见图3)。实验者指出,CORAL的溶出行为因为具有pH依赖性,随着pH 的升高溶出加快,而食物的摄入能使胃内pH升高及延长胃排空时间,有利于CORAL 的溶蚀,导致血药浓度的明显升高。

图3 CORAL(T)和Adalat OROS(R)餐前及餐后给药的4周期交叉设计的药时曲线Figure 3 Drug time curves of four cycle crossover design for pre meal and post meal administration of CORAL(T)and Adalat OROS(R)(n=24)
Abrahanmsson Bertil[4]等进行了食物对亲水骨架型硝苯地平缓释片(ER)和渗透泵型硝苯地平控释片(辉瑞Procardia XL)药物吸收的影响实验,结果显示:在餐前条件下,亲水缓释骨架的硝苯地平体内吸收程度比渗透泵片要低;在餐后条件下,亲水缓释骨架的硝苯地平体内吸收程度明显升高,且超过渗透泵片,表明亲水骨架片剂的溶蚀受食物的影响并导致药物吸收的加快,血药浓度的升高。
Pharmatec International 公司研发的Nifedicron(意大利曾上市,已撤市)[5]是一款日服一次、装有多个微小药片的胶囊,能避免释放行为受pH变化的影响,旨在降低食物对药物吸收的影响。从Nifedicron 的体外溶出实验结果不难发现Nifedicron在pH 1.0到pH 8.0的4种介质的溶出曲线较为一致(见图4),反映了Nifedicron的体外溶出未受pH变化的影响。然而,在考察高脂饮食对药物吸收的实验时发现Nifedicron 受食物的影响较为明显,血药浓度上升明显,为对照药Adalat OROS的3倍,出现“剂量倾斜”的现象(见图5)。

图4 Adalat OROS(R)和Nifedicon(T)体外4种介质的溶出曲线Figure 4 In vitro dissolution curves of Adalat OROS(R)and Nifedicon(T)in four mediums

图5 Nifedicron(T)和Adalat OROS(R)分别在餐前和餐后给药的药时曲线Figure 5 Drug time curves of Nifedicron(T)and Adalat OROS(R)administered before and after meal respectively(n=24)
Schug B S 等[6]在溶蚀型高分子骨架片的研究基础上,运用肠溶包衣技术,开发了Slofedipine XL。体外溶出实验结果表明,Slofedipine XL 在pH1.0 和pH 4.5 介质中基本不溶出,在pH 6.8 和pH 8.0 的溶出曲线相似(见图6)。在体内等效性实验中,与Adalat OROS(激光打孔技术)的AUC 和Cmax不受pH、食物影响不同,Slofedipine XL 由于包有肠溶衣膜,餐后服药的时滞现象更为明显,长达15 h,与Adalat OROS 的最高血药浓度时间Tmax(5 h)差异明显,存在明显的生物不等效(见图7)。

图6 Adalat OROS(R)和Slofedipine XL(T)在体外4 种介质的溶出曲线Figure 6 In vitro dissolution curves of Adalat OROS(R)and Slofedipine XL(T)in four mediums

图7 Adalat OROS(R)和Slofedipine XL(T)在餐前和餐后给药的药时曲线Figure 7 Drug time curves of Adalat OROS(R)and Slofedipine XL(T)administered before and after meal(n=24)
Genpharm ULC 公司的Gen-Niferdipine[7]是由Os‐motica Pharmaceuticals 公司研发的第一个口服渗透泵剂型的硝苯地平仿制制剂(曾于美国和加拿大上市)。Gen-Niferdipine 与Adalat XL(激光打孔)的单室双层结构不同,其渗透性活性物质与药物主成分混合,为单室单层的初级渗透泵剂型(EOP),外层包有半透性衣膜。在体内生物等效性实验中,Gen-Niferdipine 在餐前或餐后都出现与Adalat XL 类似的滞留情况,AUC0~tlast、AUC0~9h、AUC0~inf与Adalat XL 相比有显著的降低(见图8-9、表1),实验者认为可能与EOP制剂结构有关,药物与活性渗透物质的混合导致药物无法完全释放。

图8 Gen-Niferdipine(T)与Adalat XL(R)餐前给药药时曲线Figure 8 Drug time curves of Gen-Niferdipine(T)and Adalat XL(R)administered before meal(n=26)

图9 Gen-Niferdipine(T)与Adalat XL(R)餐后给药药时曲线Figure 9 Drug time curves of Gen-Niferdipine(T)and Adalat XL(R)administered after meal(n=26)
表1 Gen-Niferdipine(T)与Adalat XL(R)60 mg单剂量餐前、餐后给药生物等效性数据Table 1 Bioequivalence data of Gen-Niferdipine(T)and Adalat XL(R)60 mg single dose pre and post meal administration(±s,n=26)

表1 Gen-Niferdipine(T)与Adalat XL(R)60 mg单剂量餐前、餐后给药生物等效性数据Table 1 Bioequivalence data of Gen-Niferdipine(T)and Adalat XL(R)60 mg single dose pre and post meal administration(±s,n=26)
参数AUC(0-t)/(ng·h·mL-1)AUC(0-9)/(ng·h·mL-1)AUC(0-∞)/(ng·h·mL-1)Cmax/(ng·mL-1)餐前Gen-Niferdipine(T)528.9±218.6 53.7±28.5 572.6±24.1 24.19±11.1 Adalat XL(R)569.3±268.7 92.0±35.7 649.6±367.1 23.70±9.53餐后Gen-Niferdipine(T)516.1±195.4 82.1±36.5 552.2±216.3 27.67±11.83 Adalat XL(R)641.6±254.0 147.1±55.5 669.2±262.7 34.23±13.07
另有Mylan Pharmaceutical 的Mylan-Nifedipine XL(加拿大上市)[8],同样为单室单层的EOP 剂型,其药物的释放呈一级释放过程(非零级释放)。
综上所述,运用包括溶蚀片、包含多个小片的胶囊、亲水骨架片、包有肠溶衣的溶蚀骨架片以及单室单层的初级渗透泵剂型等技术的硝苯地平仿制制剂,在大多数情况下,受食物摄入的影响,并不能获得与渗透泵剂型的体内一致性。值得注意的是,有些仿制制剂,如缓释骨架片,受食物的影响较为显著,易出现“剂量倾斜”现象。
1.3.2 FDA 生物等效性申报资料 美国FDA Orange Book 中与参比制剂Procardia XL 生物等效(AB2)的产品注册信息见表2。
将表2中Mylan Pharmaceutical Inc.公司[9]生产的Mylan Nifedipine ER(T)30 mg和Valeant Pharmaceuticals North America LLC 公司[10]生产的Biovail's Nifedipine XL 60 mg 生物等效性研究资料的部分数据进行列表,见表3-5。

表2 FDA Orange Book与参比制剂Procardia XL生物等效的产品注册信息Table 2 Registration information of products bioequivalent with reference preparation Procardia XL in FDA orange book
表3 Mylan Nifedipine ER(T)和Procardia XL(R)30 mg×2随机单剂量双交叉餐前生物等效性数据Table 3 The bioequivalence data of Mylan Nifedipine ER(T)and Procardia XL(R)30 mg×2 randomized single dose double crossover pre meal(±s,n=41)

表3 Mylan Nifedipine ER(T)和Procardia XL(R)30 mg×2随机单剂量双交叉餐前生物等效性数据Table 3 The bioequivalence data of Mylan Nifedipine ER(T)and Procardia XL(R)30 mg×2 randomized single dose double crossover pre meal(±s,n=41)
参数AUC(0-t)/(ng·h·mL-1)AUC(0-∞)/(ng·h·mL-1)Cmax/(ng·mL-1)Mylan Nifedipine ER(T)(批号:2C009G)825±56.8 842±57.5 45.7±51.1 Procardia XL(R)(批号:57P016A)790±51.6 803±52.0 38.3±48.5
表4 Mylan Nifedipine ER(T)和Procardia XL(R)30 mg×2随机单剂量双交叉餐后生物等效性数据Table 4 The bioequivalence data of Mylan Nifedipine ER(T)and Procardia XL(R)30 mg×2 randomized single dose double cross‐over post meal(±s,n=19)

表4 Mylan Nifedipine ER(T)和Procardia XL(R)30 mg×2随机单剂量双交叉餐后生物等效性数据Table 4 The bioequivalence data of Mylan Nifedipine ER(T)and Procardia XL(R)30 mg×2 randomized single dose double cross‐over post meal(±s,n=19)
注:A、B、C分别代表同一受试者的服药顺序。
参数AUC(0-t)/(ng·h·mL-1)AUC(0-∞)/(ng·h·mL-1)Cmax/(ng·mL-1)A=Procardia XL(R)(批号:47P125A)949±47.3 1 013±43.2 46.2±46.5 B=Mylan Nifedipine ER(T)(批号:2C009G)1 040±51.5 1 082±51.4 65.4±60.4 C=Mylan Nifedipine ER(T)(批号:2C009G)1 042±59.5 1 082±58.2 54.1±52.7
表5 Biovail's Nifedipine XL(T)和Procardia XL(R)60 mg随机单剂量4周期交叉临床生物等效性数据Table 5 The bioequivalence data of Biovail's Nifedipine XL(T)and Procardia XL(R)60 mg randomized single dose four cycle crossover clinic(±s,n=35)

表5 Biovail's Nifedipine XL(T)和Procardia XL(R)60 mg随机单剂量4周期交叉临床生物等效性数据Table 5 The bioequivalence data of Biovail's Nifedipine XL(T)and Procardia XL(R)60 mg randomized single dose four cycle crossover clinic(±s,n=35)
参数AUC(0-t)/(ng·h·mL-1)AUC(0-∞)/(ng·h·mL-1)Cmax/(ng·mL-1)Biovail's Nifedipine XL(T)餐前1 075.4±48.7 1 124.2±50.2 56.2±43.6 Procardia XL(R)餐前1 213.4±47.7 1 287.8±51.4 51.8±42.3 Biovail's Nifedipine XL(T)餐后1 037.0±54.3 1 117.0±54.2 57.3±44.2 Procardia XL(R)餐后1 165.6±40.4 1 206.3±42.3 58.4±39.6
Mylan 公司的Mylan Nifedipine ER 与参比制剂Procardia XL均是采用渗透泵技术,其生物等效性数据表明其无论餐前和餐后的AUC 和Cmax差异均较小,不受食物摄入的影响。
值得注意的是上述Valeant Pharmaceuticals North America LLC's 公司的Biovail's Nifedipine XL 与Pro‐cardia XL 属AB2 等效,但其采用了羟乙基纤维素、羟丙甲纤维素、乙基纤维素骨架和甲基丙烯酸聚合物包衣技术进行研制,从片剂的外观来看是非激光打孔的剂型,餐前和餐后数据表明该制剂不受食物的影响,提示采用骨架外加膜控包衣技术可应用于硝苯地平渗透泵制剂的仿制。但同时Valeant Pharmaceuticals North America LLC's 公司申报资料显示其产品体外溶出数据与原研制剂差异明显(见图10),提示体外溶出曲线与临床生物等效没有绝对的必然联系,尤其是释药机理不一致的两款制剂产品。

图10 Biovail’s Nifedipine XL(T)和Procardia XL(R)30 mg的体外溶出度Figure 10 In vitro dissolution data of Biovail’s Nifedipine XL(T)and Procardia XL(R)30 mg
以Procardia XL 为参比制剂的产品,餐前和餐后Cmax和AUC 未显示有大的变化;仿制药与参比制剂除了Valeant Pharmaceuticals North America LLC's 公司的Biovail's Nifedipine XL 机制不同外,其他产品均采用相同的机制达到生物等效;另外,对于缓控释制剂,体外溶出f2不具有绝对的参考意义,体外溶出不等效(f2=24)的情况下也可做到与参比制剂等效。需要说明的是Valeant Pharmaceuticals North America LLC's公司的Biovail's Nifedipine XL 的释药机理从辅料分析上可认为是骨架外加肠溶膜控技术(聚丙烯酸树脂)。
2 骨架缓释技术
2.1 参比制剂
药品规格为30 mg 的参比制剂为德国拜耳公司的Adalat CC(美国1993年上市,未进口至中国,美国外的地区上市名称为Adalat Eins)。药品规格为10、20、40 mg的参比制剂为日本拜耳公司的Adalat-CR。
2.2 技术特点和体外溶出曲线
Adalat-CR采用两层骨架包芯压片缓释技术,辅料为羟丙基纤维素、乳糖、玉米淀粉、交联PVP、微晶纤维素、二氧化硅、硬脂酸镁、羟丙甲纤维素、聚乙二醇、氧化铁、二氧化钛。片芯为包芯片,由缓释层包裹速释层,内外两层皆为含药层。
Adalat CC 在美国FDA 生物等效代码为AB1,其典型的体外溶出曲线见图11;Adalat-CR[11]的典型体外溶出曲线见图12。

图11 Adalat CC(AB1)典型的体外溶出曲线Figure 11 Typical in vitro dissolution curve of Adalat CC(AB1)

图12 Adalat-CR的典型体外溶出曲线Figure 12 Typical in vitro dissolution curves of Adalat-CR
2.3 国外仿制制剂的研究情况
对美国FDA 生物等效性资料申报资料及日本硝苯地平缓释片的Interview Form(简称“IF”)进行查询,对采用骨架缓释技术(非渗透泵制剂)生产的原研产品及仿制产品的生物等效性试验结果进行分析。
2.3.1 FDA 生物等效性资料申报资料 美国FDA Or‐ange Book 中与参比制剂Adalat CC 生物等效(AB1)的产品注册信息见表6。

表6 FDA Orange Book中与参比制剂Adalat CC 生物等效性的产品注册信息Table 6 Registration information of products bioequivalent with reference preparation Adalat CC in FDA orange book
Watson Laboratories Inc 公司[12]生产的30 mg Afeditab CR 和Valeant Pharmaceuticals North America LLC's 公司[13]生产的30 mg 和60 mg Biovail's Nifedip‐ine ER 的生物等效性研究资料的部分数据见表7-12。
表7 Afeditab CR(T)和Adalat CC(R)30 mg随机单剂量3交叉餐后生物等效性数据Table 7 The bioequivalence data of Afeditab CR(T)and Adalat CC(R)30 mg randomized single dose triple crossover post meal(±s,n=26)

表7 Afeditab CR(T)和Adalat CC(R)30 mg随机单剂量3交叉餐后生物等效性数据Table 7 The bioequivalence data of Afeditab CR(T)and Adalat CC(R)30 mg randomized single dose triple crossover post meal(±s,n=26)
参数AUC(0-t)/(ng·h·mL-1)AUC(0-∞)/(ng·h·mL-1)Cmax/(ng·mL-1)Afeditab CR(T)餐前459.8±233.7 489.3±228.7 43.6±28.1 Afeditab CR(T)餐后504.1±270.0 511.6±271.9 84.5±44.5 Adalat CC(R)餐后545.8±252.7 551.3±251.5 84.7±38.7
表8 Afeditab CR(T)和Adalat CC(R)30 mg开放四周期随机4交叉餐后生物等效性数据Table 8 The bioequivalence data of Afeditab CR(T)andAdalat CC(R)30 mg open four cycle randomized four crossover post meal(±s,n=26)
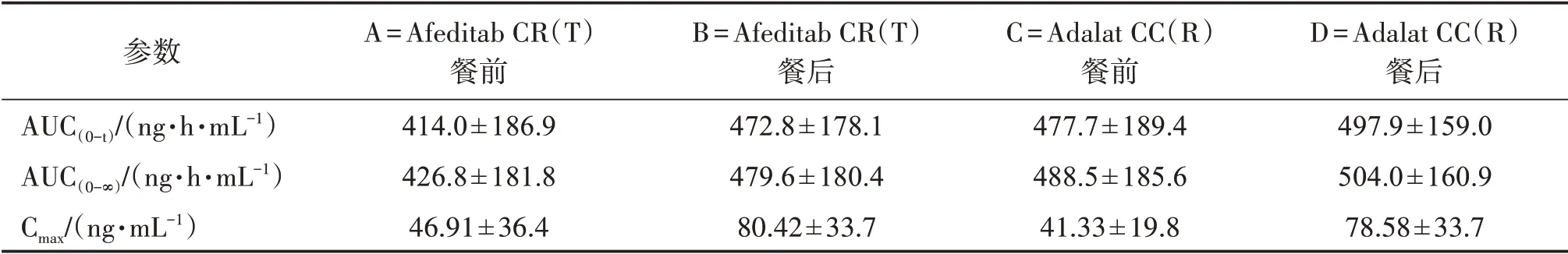
表8 Afeditab CR(T)和Adalat CC(R)30 mg开放四周期随机4交叉餐后生物等效性数据Table 8 The bioequivalence data of Afeditab CR(T)andAdalat CC(R)30 mg open four cycle randomized four crossover post meal(±s,n=26)
注:A、B、C、D分别代表同一受试者的服药顺序。
参数AUC(0-t)/(ng·h·mL-1)AUC(0-∞)/(ng·h·mL-1)Cmax/(ng·mL-1)A=Afeditab CR(T)餐前414.0±186.9 426.8±181.8 46.91±36.4 B=Afeditab CR(T)餐后472.8±178.1 479.6±180.4 80.42±33.7 C=Adalat CC(R)餐前477.7±189.4 488.5±185.6 41.33±19.8 D=Adalat CC(R)餐后497.9±159.0 504.0±160.9 78.58±33.7
表9 Biovail’s Nifedipine ER(T)和Adalat CC(R)30 mg随机单剂量2交叉餐前生物等效性数据Table 9 The bioequivalence data of Biovail’s Nifedipine ER(T)and Adalat CC(R)30 mg randomized single dose two crossover pre meal(±s,n=66)

表9 Biovail’s Nifedipine ER(T)和Adalat CC(R)30 mg随机单剂量2交叉餐前生物等效性数据Table 9 The bioequivalence data of Biovail’s Nifedipine ER(T)and Adalat CC(R)30 mg randomized single dose two crossover pre meal(±s,n=66)
参数AUC(0-t)/(ng·h·mL-1)AUC(0-∞)/(ng·h·mL-1)Cmax/(ng·mL-1)Biovail's Nifedipine ER(T)餐前507.8±64 543.8±63 50.2±64 Adalat CC(R)餐前551.7±56 612.0±50 59.0±51
表10 Biovail’s Nifedipine ER(T)和Adalat CC(R)30 mg单剂量三交叉3周期餐后生物等效性数据Table 10 The bioequivalence data of Biovail’s Nifedipine ER(T)and Adalat CC(R)30 mg single dose three crossover three cycle post meal(±s,n=21)

表10 Biovail’s Nifedipine ER(T)和Adalat CC(R)30 mg单剂量三交叉3周期餐后生物等效性数据Table 10 The bioequivalence data of Biovail’s Nifedipine ER(T)and Adalat CC(R)30 mg single dose three crossover three cycle post meal(±s,n=21)
注:A、B、C分别代表同一受试者的服药顺序。
参数AUC(0-t)/(ng·h·mL-1)AUC(0-∞)/(ng·h·mL-1)Cmax/(ng·mL-1)A=Biovail's Nifedipine ER(T)餐后617.9±46 622.9±45 106.6±41 B=Adalat CC(R)餐后627.0±47 633.4±47 94.2±49 C=Biovail's Nifedipine ER(T)餐前486.9±51 501.6±51 40.8±49
表11 Biovail’s Nifedipine ER(T)and Adalat CC(R)60 mg 随机单剂量双交叉餐前生物等效性数据Table 11 The bioequivalence data of Biovail’s Nifedipine ER(T)and Adalat CC(R)60 mg randomized single dose double crossover pre meal(±s,n=66)

表11 Biovail’s Nifedipine ER(T)and Adalat CC(R)60 mg 随机单剂量双交叉餐前生物等效性数据Table 11 The bioequivalence data of Biovail’s Nifedipine ER(T)and Adalat CC(R)60 mg randomized single dose double crossover pre meal(±s,n=66)
注:A、B分别代表同一受试者的服药顺序。
B=Adalat CC(R)餐前1150.7±52 1203.8±52 105.8±52参数AUC(0-t)/(ng·h·mL-1)AUC(0-∞)/(ng·h·mL-1)Cmax/(ng·mL-1)A=Biovail’s Nifedipine ER(T)餐前1105.4±50 1135.4±46 89.4±50
表12 Biovail’s Nifedipine ER(T)and Adalat CC(R)60 mg单剂量3交叉3周期餐后生物等效性数据Table 12 The bioequivalence data of Biovail’s Nifedipine ER(T)and Adalat CC(R)60 mg single dose three crossover three cycle post meal(±s,n=18)

表12 Biovail’s Nifedipine ER(T)and Adalat CC(R)60 mg单剂量3交叉3周期餐后生物等效性数据Table 12 The bioequivalence data of Biovail’s Nifedipine ER(T)and Adalat CC(R)60 mg single dose three crossover three cycle post meal(±s,n=18)
注:A、B、C分别代表同一受试者的服药顺序。
参数AUC(0-t)/(ng·h·mL-1)AUC(0-∞)/(ng·h·mL-1)Cmax/(ng·mL-1)A=Biovail’s Nifedipine ER(T)餐后1227.0±44 1237.1±44 213.9±36 B=Adalat CC(R)餐后921.8±39 938.9±39 87.2±42 C=Biovail’s Nifedipine ER(T)餐后1217.1±48 1228.2±48 187.5±43
Watson Laboratories Inc's 和Valeant Pharmaceuti‐cals North America LLC's两家公司的硝苯地平缓释片和德国拜耳的“Adalat CC”都是采用缓释骨架技术,从生物等效性试验结果来看,餐后条件下的AUC 和Cmax比餐前条件下的要明显升高,反映了缓释骨架受食物的影响较为显著。
2.3.2 日本IF 资料调研日本拜耳Adalat-CR(规格有10 mg、20 mg、40 mg)是日本公认的原研制剂,其剂型也是采用缓释骨架的包芯片。本文汇总了東和薬品株式会社、日医工株式会社和沢井製薬株式会社的IF 中有关餐前和餐后生物等效试验的数据(见表13-15),结合对上述厂家的硝苯地平缓释片的处方信息,重点分析制剂剂型对Cmax和AUC 2个药动学参数变化趋势的影响。
表13 東和薬品株式会社硝苯地平缓释片生物等效数据Table 13 Bioequivalence data of nifedipine sustained release tablets of Towa Pharmaceutical Co.,Ltd.(±s,n=40)

表13 東和薬品株式会社硝苯地平缓释片生物等效数据Table 13 Bioequivalence data of nifedipine sustained release tablets of Towa Pharmaceutical Co.,Ltd.(±s,n=40)
处方辅料[14]:片芯为乳糖水合物、羟丙纤维素、微晶纤维素、乙基纤维素;黏合剂为聚维酮;润滑剂为硬脂酸镁;包衣层为羟丙甲纤维素、聚乙二醇6000、滑石粉、氧化钛、氧化铁、氧化铁黄。
产品名称ニフェジピンCR錠10 mg Adalat-CR 10ニフェジピンCR錠20 mg Adalat-CR 20ニフェジピンCR錠40 mg Adalat-CR 40餐前AUC48/(ng·h·mL-1)214.6±96.8 220.4±94.2 403.0±230.0 419.0±259.0 700.2±355.4 716.9±335.3 Cmax/(ng·mL-1)14.83±6.83 16.32±7.34 25.33±11.80 27.98±14.19 43.77±23.34 49.15±25.18餐后AUC48/(ng·h·mL-1)247.9±173.6 257.4±167.4 467.1±193.9 492.0±195.7 848.4±423.1 803.2±369.5 Cmax/(ng·mL-1)22.45±17.95 22.85±19.20 44.00±17.28 49.55±22.93 110.41±38.87 108.54±45.93
表14 沢井製薬株式会社硝苯地平缓释片生物等效数据Table 14 Bioequivalence data of nifedipine sustained release tablets of Sawai Pharmaceutical Co.,Ltd.(±s,n=20)

表14 沢井製薬株式会社硝苯地平缓释片生物等效数据Table 14 Bioequivalence data of nifedipine sustained release tablets of Sawai Pharmaceutical Co.,Ltd.(±s,n=20)
处方辅料[15]:乙基纤维素、轻质无水硅酸、氧化钛、氧化铁、硬脂酸镁、滑石粉、低取代羟丙基纤维素、羟丙甲纤维素、聚维酮、聚乙二醇6000、其他2种组分(未公布)。
产品名称ニフェジピンCR錠10 mg Adalat-CR 10ニフェジピンCR錠20 mg Adalat-CR 20ニフェジピンCR錠40 mg Adalat-CR 40餐前AUC48/(ng·h·mL-1)174.8±95.3 199.4±131.5 315.2±124.8 333.6±151.8 794.4±369.2 742.4±275.1 Cmax/(ng·mL-1)11.5±5.9 12.0±5.0 26.2±12.4 26.6±12.9 54.0±13.7 52.3±19.7餐后AUC48/(ng·h·mL-1)205.1±95.9 204.0±79.1 432.7±297.3 428.5±257.2 957.1±401.2 948.6±306.1 Cmax/(ng·mL-1)22.4±14.0 21.9±11.1 49.5±30.8 49.8±29.1 79.1±25.0 80.8±21.5
表15 日医工株式会社硝苯地平缓释片生物等效数据Table 15 Bioequivalence data of Nifedipine sustained release tablets of Nichi-Iko Pharmaceutical Co.,Ltd.(±s,n=20)

表15 日医工株式会社硝苯地平缓释片生物等效数据Table 15 Bioequivalence data of Nifedipine sustained release tablets of Nichi-Iko Pharmaceutical Co.,Ltd.(±s,n=20)
处方辅料[16]:赋形剂为羟丙甲纤维素;黏合剂为聚维酮;润滑剂为滑石粉、无水硅酸、硬脂酸镁;涂层为羟丙甲纤维素、聚乙二醇、乙基纤维素、低取代羟丙纤维素;着色剂为二氧化钛、三氧化二铁;其他2种组分(未公布)。
产品名称ニフェジピンCR錠10 mg Adalat-CR 10ニフェジピンCR錠20 mg Adalat-CR 20ニフェジピンCR錠40 mg Adalat-CR 40餐前AUC48/(ng·h·mL-1)174.8±95.3 199.4±131.5 315.2±124.8 333.6±151.8 794.4±369.2 742.4±275.1 Cmax/(ng·mL-1)11.5±5.9 12.0±5.0 26.2±12.4 26.6±12.9 54.0±13.7 52.3±19.7餐后AUC48/(ng·h·mL-1)205.1±95.9 204.0±79.1 432.7±297.3 428.5±257.2 957.1±401.2 948.6±306.1 Cmax/(ng·mL-1)22.4±14.0 21.9±11.1 49.5±30.8 49.8±29.1 79.1±25.0 80.8±21.5
从東和薬品株式会社、日医工株式会社和沢井製薬株式会社的硝苯地平缓释片的处方辅料构成分析,3个厂家的硝苯地平缓释片均属于骨架型制剂。4 款硝苯地平缓释片仿制制剂及原研制剂Adalat-CR 体外溶出曲线与原研制剂Adalat-CR 相似。与原研制剂类似,仿制制剂的餐后给药的Cmax和AUC 较餐前给药有升高趋势,Cmax尤为显著,同样反映了食物能影响缓释骨架类药物的体内吸收。
3 结语
采用骨架缓释制剂技术的硝苯地平缓释片,说明书的用法用量需规定餐前服用以避免产品受食物的影响。骨架缓释技术工艺宜选用Adalat CC或Adalat-CR为参比制剂,但两者均未获批进口,参比制剂的获得相对较难;Adalat CC 或Adalat-CR 均为缓释骨架包芯压片工艺,因此研发时需增加包芯压片设备,对关键的包芯压片设备性能要求较高。
当选择Adalat GITS(或Procardia XL)为参比制剂,且用法用量保持一致,为了降低餐前和餐后生物不等效的风险,不宜选用骨架缓释制剂技术进行仿制,应该选用相同的激光打孔渗透泵技术。若选用与上述参比制剂释药机理不同的工艺路线,如Valeant Pharma‐ceuticals North America LLC 公司的Nifedipine XL,该产品可能运用了骨架加膜控肠溶包衣技术,FDA 申报资料中显示其溶出曲线与渗透泵片完全不一致(见图10,f2=24),故在进行体外处方筛选时,因没有目标参数,需要进行人体预实验来验证是否等效,不可避免地增加了研发成本。

