基于UPLC-MS/MS广靶代谢组学技术分析不同陈化年限广陈皮化学成分的差异
颜仁梁,梁永枢,沈小钟
(广东食品药品职业学院,广东 广州 510520)
陈皮为芸香科植物橘Citrus reticulataBlanco及其栽培变种的干燥成熟果皮,陈皮作为药用历史悠久,始载于《神农本草经》,名橘柚,列为上品。2020年版《中国药典》载有陈皮、广陈皮2 个药材品种,其中,广陈皮(Citrus reticulate‘Chachi’)主产于广东新会,新会陈皮最为道地,具有理气健脾、燥湿化痰的功效,现代药理研究表明,陈皮具有抗氧化、抗肿瘤、降脂等作用[1-2]。
传统中医药理论及历代本草论述中均认为陈皮“陈久者良”,指出陈皮需放置陈久方能作为药用。关于陈皮陈化时限的界定,历代本草说法不一,有1 a、2 a、3 a 至数十年、几十年不等,也有“陈久”“陈年”“多年”“经年”等不能明确具体时间的说法[3]。陈皮主要含黄酮类[4-6]、生物碱类[7]、挥发油[8-10]及多糖[11]类成分,目前研究者对不同贮藏年限陈皮化学成分研究主要集中在黄酮类及挥发性成分上[8,10,12],常采用的液质联用法[13-16]或气质联用法[9,17-18]。
鉴于陈皮临床用药量大,具有较大药用价值,本研究采用超高效液相色谱串联质谱(UPLC-MS/MS)结合植物广靶代谢组学技术整体表征3 种不同陈化时间下广陈皮化合物差异性,利用主成分分析(PCA)和偏最小二乘判别分析法(PLS-DA)等多元统计方法鉴定主导差异的标志性代谢物,发掘潜在的规律,并对相关的代谢通路进行了分析,为深入研究陈皮陈化机制提供理论依据。
1 仪器与材料
U3000 超快速液相色谱仪(美国Thermo Scien‐tific 公司);TripleTOF5600 质谱仪(美国AB SCIEX公司);Concentrator plus 真空浓缩仪(德国Eppen‐dorf 公司);Microfuge22R 台式高速冷冻离心机(美国Beckman Coulter 公司);KQ5200DE 超声波清洗器(昆山市超声仪器有限公司);M16710-33 漩涡振荡器(美国Thermo Scientific公司)。
质谱乙腈(美国Thermo Fisher 公司);质谱甲醇(美国Thermo Fisher 公司);甲酸(美国Sigma-Aldrich公司)。
21 个广陈皮样本均采自广东省江门市新会陈皮核心产区,部分由世纪茗家新会柑生态专业种植合作社提供,经广东食品药品职业学院梁永枢副研究员鉴定为芸香科植物广陈皮Citrus reticulate‘Chachi’干燥成熟果皮,陈化年份分别为2020年(1 a)、2018年(3 a)和2016年(5 a)新会陈皮,每年7 个样本,分为3组。样品及其采样地与年份见表1。
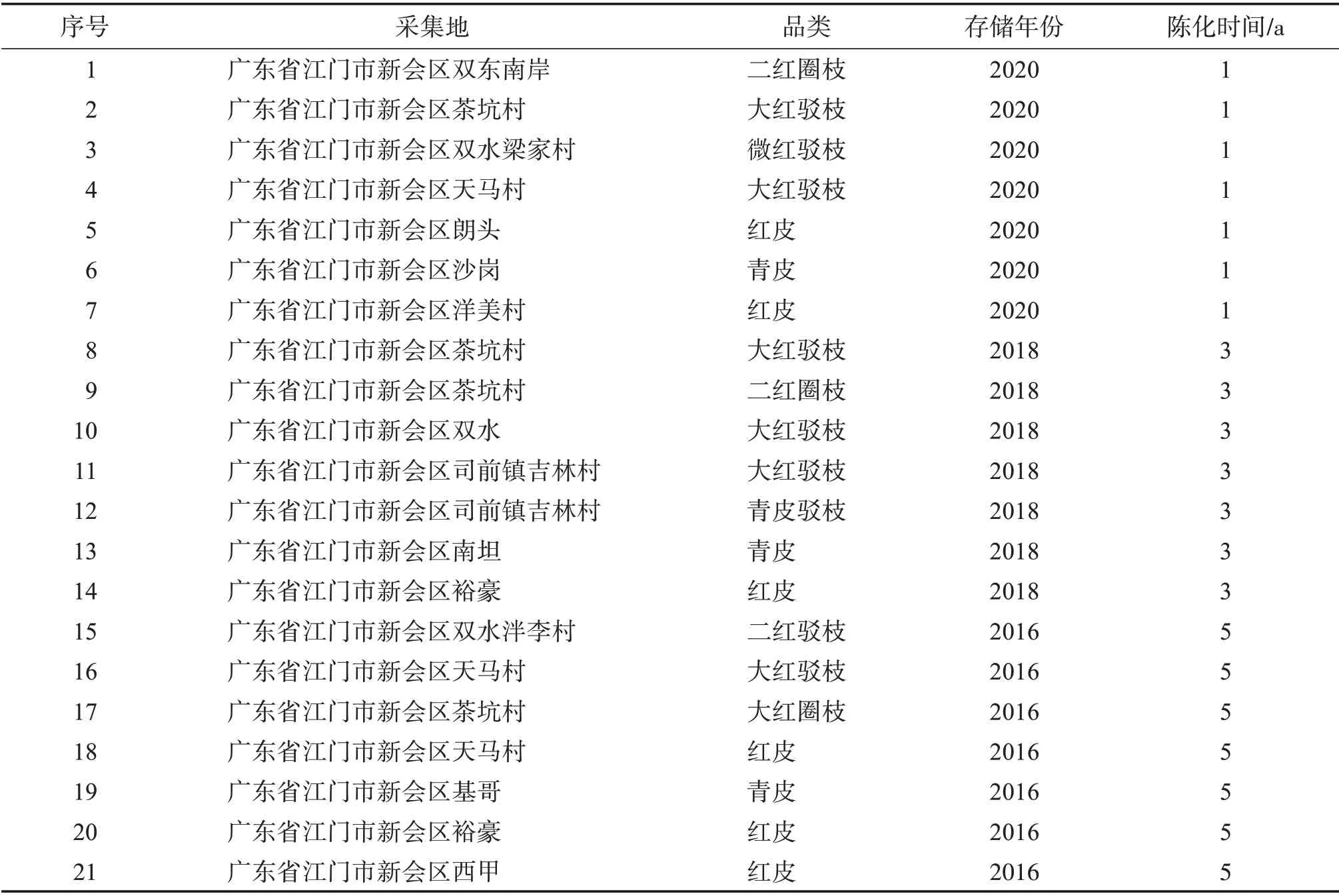
表1 新会陈皮及其采样地和年份信息Table 1 Sampling location and storage year information of xinhui Citri reticulatae Pericarpium“Chachi”
2 方法
2.1 样品制备
称取300 mg 左右样品,加入3 mL 色谱甲醇,超声30 min后,离心(5 000 r/min),取出上清,残渣再加入3 mL 色谱甲醇,超声30 min,离心(5 000 r/min),合并上清,上清浓缩至3 mL,过0.22 μm 滤膜后进样10 μL,用UPLC-MS检测。
2.2 色谱和质谱采集条件
2.2.1 色谱条件 色谱柱为Waters ACQUITY BEH C18Column(150 mm×2.1 mm,1.7 µm),柱温为35 ℃,流速为0.300 mL/min,流动相:0.1%甲酸水为流动相A,乙腈为流动相B,梯度洗脱程序见表2。

表2 流动相梯度洗脱方案Table 2 Gradient elution procedure of mobile phase
2.2.2 质谱条件 分别采用电喷雾电离(ESI)正离子和负离子模式进行检测。离子源气1(Gas 1):50,离子源气2(Gas 2):50,气帘气(CUR):25,离子源温度:500 ℃(正离子)和450 ℃(负离子),离子喷雾电压浮动(ISVF):5 500 V(正离子)和4 400 V(负离子),TOF MS 扫描范围:100~1 200 u,子离子扫描范围:50~1 200 u,TOF MS 扫描积累时间:0.2 s,子离子扫描积累时间:0.01 s,二级质谱采用基于信息采集(IDA)获得并采用高分辨模式,去簇电压(DP):±60 V,碰撞能量:(35±15)eV。
2.3 数据处理
通过Analysis Base File Converter软件将LC-MS获得的原始数据转换成ABF格式,将ABF格式文件导入MS-DIAL 4.60 软件进行预处理,包括峰提取、去噪音、反卷积,峰对齐,导出CSV 格式的三维数据矩阵(原始数据矩阵),三维矩阵包括的信息有:样品信息、保留时间、质核比和质谱响应强度(峰面积),导出时峰面积除去该样品的称样量。将提取的峰信息与数据库进行比对,运用MassBank(http://www.massbank.jp/),ReSpect(http://spectra.psc.riken.jp/),GNPS(https://gnps.ucsd.edu/)3 个质谱数据库进行全库检索比对鉴定。鉴于代谢组数据一般都是多维多变量间高度相关的,使用传统的单变量分析方法无法快速、充分、准确地发现数据内潜在的信息。因此本试验要运用化学计量学原理和多元统计的方法,对采集的多维数据进行降维与归类分析,采用R 软件(ropls 包)对三维数据矩阵进行主成分分析(principal component analysis,PCA)、偏最小二乘判别分析(partial least squares discriminant analysis,PLS-DA),鉴定出3 组广陈皮样品间的差异性代谢产物。使用R 软件绘制热图(pheatmap 包)进行层次聚类分析(HCA),以表征3组广陈皮样品间代谢物的积累模式。采用KEGG数据库(https://www.genome.jp/kegg/pathway.html)对鉴定的广陈皮化合物进行代谢通路分析。
3 结果与分析
3.1 广陈皮代谢组化合物的鉴定
UPLC-MS/MS 首先以正、负离子模式对混样质控QC 样品进行检测,质控样本TIC 曲线重叠性高、质谱峰保留时间和强度一致,表明所建方法可靠、仪器稳定性较好。所获得的代谢物高分辨二级质谱数据经与公共数据库比对,共鉴定562个化合物,其中黄酮化合物109 个[如:3′-羟基-4′,5,6,7,8-五甲氧基黄酮(3′-demethylnobiletin)、5-羟基-6,7,8,4′-四甲氧基黄酮(gardenin B)]、苷类成分86 个、萜类50 个、酸性物质及其衍生物54 个,此外还包含少量脂类(7 个)、蒽酮(5 个)等物质,其中鉴定分数(total score)大于90%的成分31个,见表3。不同离子模式下UPLC-MS/MS总离子流图如图1A,1B所示。

图1 不同陈化时间广陈皮化合物正离子(A)和负离子(B)模式总离子图谱Figure 1 Total ion maps of compounds from Citri reticulatae Pericarpium “Chachi” under different aging years under positive ion model(A)and negative ion model(B)
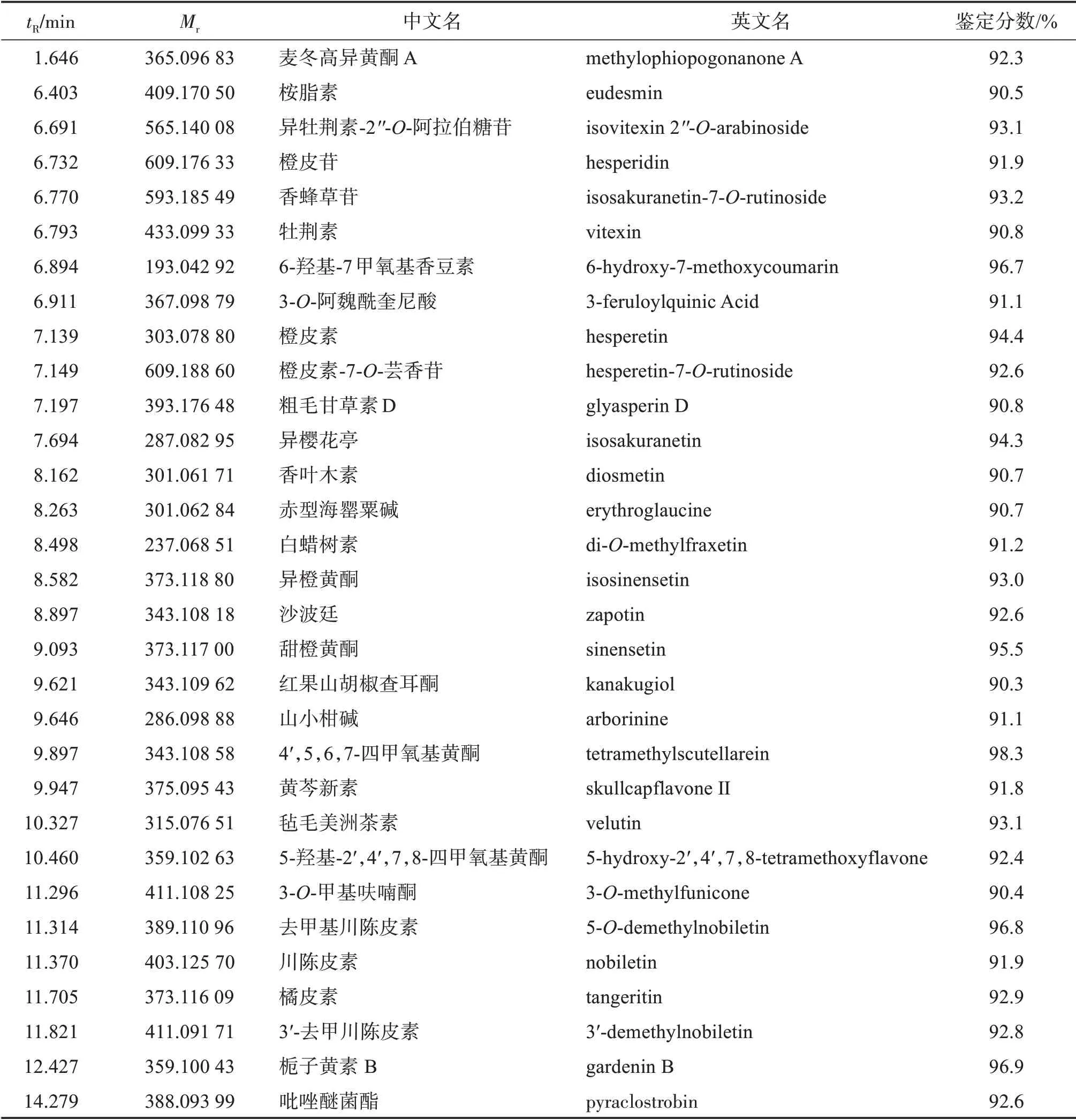
表3 不同陈化时间广陈皮鉴定分数大于90%以上的代谢物Table 3 Metabolites with scores above 90 identified in Citri reticulatae Pericarpium“Chachi”under different aging years
3.2 广陈皮代谢组代谢通路分析
对鉴定的562 个成分进行KEGG 代谢通路分析,共发现119个成分能映射到KEGG 数据库,其中涉及的代谢通路有14条,分别为不饱和脂肪酸的生物合成(biosynthesis of unsaturated fatty acids)、黄酮类生物合成(flavonoid biosynthesis)、黄酮和黄酮醇的生物合成(flavone and flavonol biosynthesis)、角质、软木脂和蜡的生物合成(cutin,suberine and wax biosynthesis)、玉米素生物合成(zeatin biosynthesis)、淀粉和蔗糖代谢(starch and sucrose metabolism)、脂肪酸伸长率(fatty acid elongation)、色氨酸代谢(tryptophan metabolism)、半乳糖代谢(galactose metabolism)、α-亚麻酸代谢(alpha-linolenic acid metabolism)、苯丙烷生物合成(phenylpropanoid biosynthesis)、脂肪酸降解(fatty acid degradation)、脂肪酸生物合成(fatty acid biosynthesis)、嘌呤代谢(purine metabolism)。
3.3 广陈皮代谢组多元变量统计分析
采用的多元变量统计分析包括主成分分析(PCA),偏最小二乘法-判别分析(PLS-DA)。代谢组数据经标准化处理后进行PCA 分析,PCA 得分见图2,表明各组样本成分有一些重叠,所建立方法可一定程度上表征不同陈化年限广陈皮代谢物的差异性。由于PCA 分析不能忽略组内误差、消除与研究目的无关的随机误差,过分关注于细节、忽略了整体和规律,最终不利于发现组间差异和差异化合物。所以,又进行了PLS-DA分析。
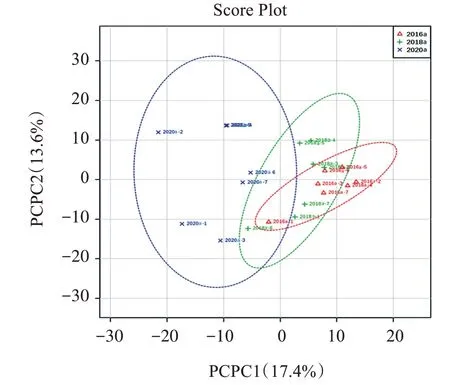
图2 广陈皮广靶代谢组PCA分析Figure 2 Widely targeted metabonomic PCA analysis of Citri reticulatae Pericarpium“Chachi”
本研究广陈皮代谢组PLS-DA分析结果见图3,R2为0.999 37,表示模型可靠,分析显示,不同组间代谢物积累模式存在明显的差异,同一组的样本代谢物积累趋势较为一致且高度聚合一支。说明3组样品的代谢轮廓存在差异,总体说明不同年份的广陈皮是有差异的。PLS 与PCA 分析时,前5种代表性化合物为:四甲基高黄芩素、栀子黄素B、5-O-去甲肾上腺素、6-羟基-7-甲氧基香豆素、橙黄酮。PLS-DA 载荷图见图4,结果显示,24-表罗汉松甾酮A、蒜藜芦碱、五味子酚、咖啡醇、robustic acid、水化氧化前胡素是对这个模型贡献比较大的物质。
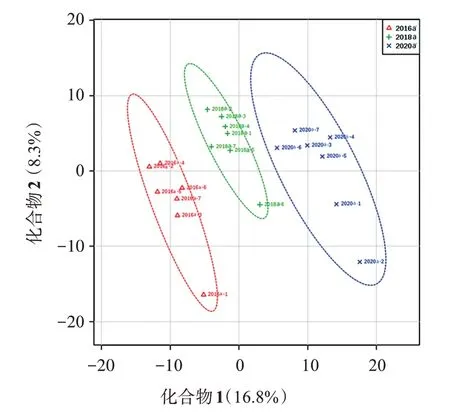
图3 广陈皮代谢组PLS-DA分析Figure 3 Widely targeted metabonomic PLS-DA analysis of Citri reticulatae Pericarpium“Chachi”
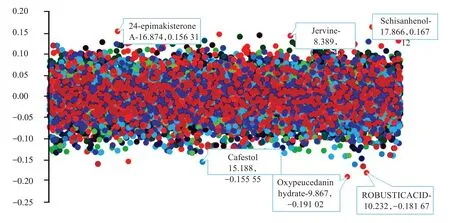
图4 广陈皮代谢组PLS-DA分析载荷图Figure 4 Widely targeted metabonomic PLS-DA analysis loading diagram of Citri reticulatae Pericarpium“Chachi”
3.4 不同陈化年限广陈皮差异代谢物分析
本研究中,差异代谢物是指在倍数检验中|log2FC|值大于0.58(FC 大于1.5)并且T检验中P值小于0.05,并且在PLS-DA 中变量投影重要度值(variable importance for the projection,VIP)大于1的物质。VIP值可以衡量各代谢物组分含量对样本分类判别的影响强度和解释能力,辅助标志代谢物的筛选(阈值通常设为1)。本研究结果显示:不同陈化年限广陈皮代谢物中有387 种是共有的,占总检出成分的68.86%;另外,3组样品间的差异代谢物175 个,占总检出成分的31.14%,其中陈化5 a 组与1 a组比较差异代谢物最多有126个(其中千屈茶碱-D3、苦丁冬青苷D、粉防己碱等75 个化合物含量增加,千金藤素、桑皮苷C、蔓荆子黄素等51 个化合物含量下降),陈化3 a 组与1 a 组比较差异代谢物有105个(其中千屈茶碱-D3、原阿片碱、秋水仙碱等78个化合物含量增加,蔓荆子黄素、桑皮苷C、阔叶千里光碱等27 个化合物含量下降),陈化5 a 组与3 a组比较差异代谢物最少,仅41 个(其中二氢吴茱萸新碱、天门冬氨酸、地骨皮乙素等31 个化合物含量下降,三角叶薯蓣皂苷、苦丁冬青苷D、andrastin A 等10 个化合物含量增加),各组差异代谢物分布情况见图5。

图5 不同陈化年限广陈皮差异代谢物比较韦恩图Figure 5 Venn diagram for differential metabolite comparison of Citri reticulatae Pericarpium “Chachi” under different aging years
聚类分析结果以热图表示,热图表现的是一个数据矩阵,通过使用颜色梯度使数据间的差异实现可视化,通过数据缩放,保留较大差异,同时也能突显较小差异。不同颜色的区域代表不同的聚类分组信息,同组内的代谢模式相似,可能具有相似的功能或参与相同的生物学过程。因此,通过将代谢模式相同或者相近的代谢物聚成类,可以用来推测已知或未知代谢物的生物学功能。在175个差异代谢物中有42个化合物映射到KEGG 数据库,涉及不饱和脂肪酸的生物合成、角质、软木脂和蜡的生物合成、脂肪酸伸长率、α-亚麻酸代谢、色氨酸代谢、脂肪酸降解、苯丙烷生物合成、脂肪酸生物合成这8条代谢通路。
42 个差异代谢物的热图分析结果见图6,其在各组中的含量比较结果见表4。

表4 不同陈化年限广陈皮42个KEGG差异代谢物信息Table 4 Information of 42 KEGG different compounds detected in Citri reticulatae Pericarpium“Chachi”under different aging years
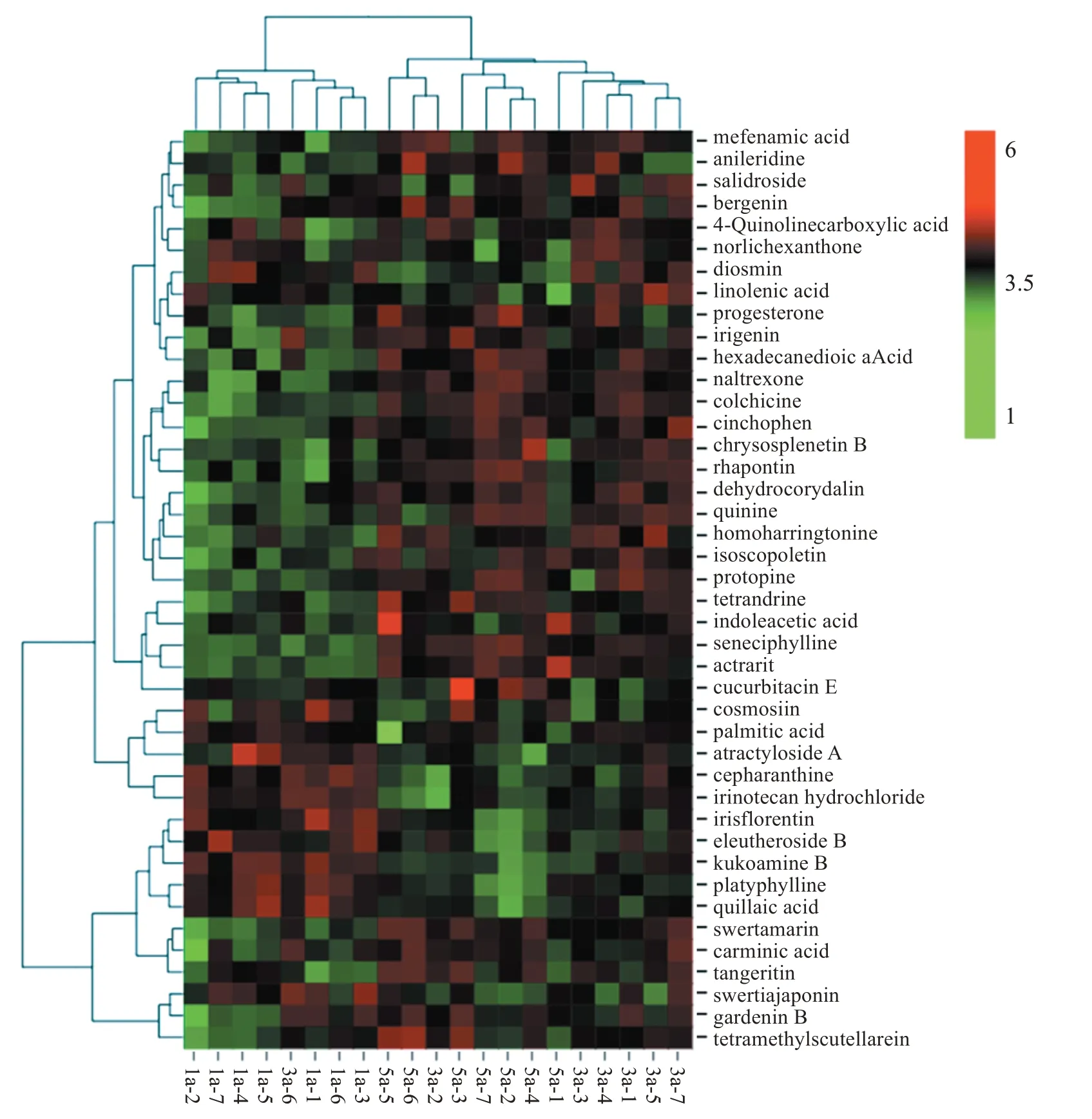
图6 广陈皮广靶代谢组热图分析Figure 6 Widely targeted metabonomic clustering heat map analysis of Citri reticulatae Pericarpium“Chachi”
4 讨论
本研究利用广靶代谢组学技术对3种陈化年限的21 个广陈皮样品进行成分分析,共检测到562 个化学成分,主要成分为黄酮类(109 个)和苷类(86个)等,略高于曹烙文等[19]利用顶空固相微萃取-全二维气相色谱-飞行时间质谱结合化学计量学方法检测到的约500 种广陈皮化合物。分析发现其中119 个成分能映射到KEGG 数据库,涉及不饱和脂肪酸的生物合成、黄酮类生物合成、黄酮和黄酮醇的生物合成等14 条代谢通路,与文献报道一致[20]。本研究采用广靶代谢组学技术对不同陈化年限广陈皮化学成分进行分析,结合进行应用多元统计分析和热图区分,建立一种快速鉴别广陈皮成分的方法,为通过成分确定广陈皮真实的陈化年份奠定了科学基础。
本研究发现的562 个广陈皮化学成分中,不同陈化年限广陈皮差异代谢物有175个,说明5 a陈化过程中约2/3的成分保持稳定,1/3是差异代谢物,不同陈化年限广陈皮代谢物有较大差异,在五年的陈化过程中,随着陈化时间的增加,广陈皮化学成分逐渐趋于稳定,差异代谢物的聚类分析结果也显示了这一特征。另外,本文研究结果表明,与陈化1 a组比较,陈化3 a组和陈化5 a组差异化学成分较多,而且以含量增加的成分数量多于含量减少的成分数量;与陈化3 a组的差异化学成分比较,陈化5 a组差异代谢物以含量减少为主,说明广陈皮陈化3~5 a间化学成分有一个相对较多的顶峰阶段。有学者[13]报道采用超高效液相色谱四极杆/飞行时间质谱(UPLC-QTOFMS)的代谢组学技术鉴定出31 种代谢物来区分不同贮藏年份的新会陈皮与普通陈皮,其中仅3′-羟基-4′,5,6,7,8-五甲氧基黄酮、5-羟基-6,7,8,4′-四甲氧基黄酮(去甲基橘皮素)这两个化合物与本试验发现的175 种差异代谢物相一致;另外,他们研究发现,代谢物水平在陈化3~10 a 后升高,在陈化15~30 a 后降低,与本试验结果不一致。因为本试验仅对陈化5 a内的广陈皮样本进行研究,随着存储年限再延长,广陈皮成分是否会产生新的差异?亟待下一步验证研究。
3 组不同陈化年限成品差异化学成分分析结果显示,在175 个差异代谢物中有42 个化合物映射到KEGG 数据库,涉及不饱和脂肪酸的生物合成、角质、软木脂和蜡的生物合成、脂肪酸伸长率、α-亚麻酸代谢、色氨酸代谢、脂肪酸降解、苯丙烷生物合成、脂肪酸生物合成等8 条代谢通路。在活性差异化合物方面,随着陈化时间的增加,3 组共有的差异代谢物奎拉酸和地骨皮乙素均呈现下降趋势,次野鸢尾黄素、阔叶千里光碱等成分含量降低,但千屈茶碱-D3、粉防己碱、原阿片碱、秋水仙碱、土大黄苷、十六烷二酸、纳曲酮、獐牙菜苦苷、野鸢尾黄素、奎宁、甲芬那酸、去氢紫堇碱、橘皮素、高三尖杉酯碱、胭脂红酸含量均升高,暗示这些增加的成分可能是广陈皮陈化质优的物质基础,如橘皮素(tangeritin)是Notch-1 的有效抑制剂,具有保护神经[21]、抑制脂肪生成[22]等作用;原阿片碱(protopine)具有抗肿瘤[23]、抗炎活性[24];秋水仙碱(colchicine)具有降脂[25]、抗炎[26]等作用,广陈皮陈化后使用增效降燥机制是否与这些成分变化有关,有待进一步研究。

