镀锌钢在模拟沿海 - 工业大气中的腐蚀行为
李 波,何锦航,余思伍,白 洁,肖仁贵,仇 伟,刘孟磊,彭盛燕,廖 霞
(1. 贵州省电力科学研究院,贵州 贵阳 550000;2. 贵州大学化学与化工学院,贵州 贵阳 550025)
[收稿日期] 2022-01-16
[基金项目] 贵州省电力科学研究院课题(GZKJXM20191302)资助
[通信作者] 刘孟磊(1996-),硕士,研究方向为金属腐蚀,电话:18860360231,E - mail:1733041235@qq.com
0 前 言
金属材料由于硬度大、力学性能好而被广泛应用,但是金属材料的腐蚀问题是人类生产活动面临的一大难题。镀锌钢比碳钢的耐蚀性好,因而更受欢迎。汽车、桥梁、建筑物尤其是电力系统,依赖大量的镀锌钢材[1]。钢材的腐蚀每年都会造成巨大的经济损失,电力设备的腐蚀甚至会造成电力系统的瘫痪以及人员的伤亡[2],因此研究镀锌钢的腐蚀规律以及机理有很重要的意义,而且这对于金属的定期维护提供了理论依据。一般的腐蚀有海洋腐蚀、土壤腐蚀和大气腐蚀。大气腐蚀的现象比较普遍,一般大气腐蚀的影响因素有温度、湿度、污染物离子以及降雨量,其中污染物离子是影响腐蚀速率最严重的因素之一,尤其是Cl-和SO2[3-5]。镀锌钢的腐蚀前期与锌的腐蚀相似,后期为碳钢的腐蚀[6]。据文献报道[7],随Cl-浓度的增大,镀锌钢的腐蚀速率先增大后减小。锌锈的主要成分为ZnO和难溶物质Zn5(OH)8Cl2H2O[8]。当镀锌层被破坏,基体的碳钢通过缝隙的电解质溶液开始腐蚀[9]。当镀锌钢表面足够湿润时,样品表面为电化学腐蚀,锌充当牺牲阳极保护碳钢基体[10]。当镀锌钢表面电解质溶液开始减少,样品表面开始干燥时,锌层失去了牺牲阳极的能力[11]。SO2对镀锌钢的腐蚀机理是SO2溶于水生成H2SO3,酸性电解质对金属产生析氢腐蚀[12, 13]。SO2在溶液中减小溶液阻力,增大溶液电导率[14]。随着工业生产的发展,工业大气与海洋环境的复合构成对金属腐蚀的严重威胁,但目前有关Cl-和SO2对镀锌钢的协同腐蚀作用还没有太多的文献报道。本工作用NaHSO3溶液来模拟SO2的腐蚀环境,利用干/湿交替腐蚀方法,探究镀锌钢在不同含量的Cl-和SO2共同存在下的协同腐蚀规律。
1 试 验
1.1 样品准备
采用镀锌钢板(锌层厚度为70 μm,内层为Q235碳钢)。将镀锌钢板切割成尺寸为30 mm×30 mm×2 mm和10 mm×10 mm×1 mm的大小,分别用于腐蚀增重和电化学测试,实验过程中每种样品用3个样品进行平行实验。样品非工作面用胶带密封。用400号砂纸将样品工作面打磨,无水乙醇或丙酮清洗,用冷风吹干,在干燥箱中放置24 h备用。用NaHSO3来模拟SO2的腐蚀,以0.03 mol/L NaHSO3的电解质溶液为底液,分别加入不同浓度的NaCl溶液,各实验组的NaCl浓度如表1所示,实验所用溶液采用分析纯试剂和去离子水配制。

表1 腐蚀液的浓度与种类
1.2 干/湿交替实验流程
干/湿交替腐蚀流程如下:(1)用CP 124C电子微天平(精度0.1 mg)称量样品的初始质量m0;(2)将电解液按40 μL/cm2滴加到样品表面并铺展均匀;(3)放入HRY - 150恒温恒湿实验箱, 箱内环境条件设定为温度30 ℃和相对湿度(RH)60%;(4)12 h后,取出样品再次称重m1,然后补加等量的蒸馏水;(5)重复第(3)和第(4)步骤。1个循环过程称为1个CCT。
1.3 电化学测量
利用上海辰华电化学工作站进行电化学测量,采用经典的三电极体系,以铂金为对电极,以饱和甘汞电极(SCE)为参比电极,以暴露面积为1 cm2的锈蚀样品为工作电极,进行极化曲线和电化学阻抗谱(EIS)测量。在10 mV /min的恒定扫描速率下获得极化曲线,开路电位相对于自腐蚀电位的范围为-30~30 mV。EIS的频率范围为100 kHz~10 mHz,开路电位下振幅为10 mV。电化学测量的电解质溶液为干/湿交替所用的电解质溶液,所有测量均在室温下进行[(25±2) ℃]。
2 结果与分析
2.1 宏观形貌分析
图1为不同样品在不同腐蚀时间下的宏观形貌。当腐蚀周期为1 CCT时,样品表面覆盖一层薄薄的半透明薄膜,此时主要是锌的腐蚀产物,产物较少。6号样品的表面有盐颗粒,这是由于6号样品所用的电解质溶液浓度较大,干燥期间氯化物在样品表面不均匀沉积。当腐蚀周期为5 CCT时,样品表面的白锈较多。当腐蚀周期为15 CCT时,1~4号样品表面依然被白锈覆盖,NaCl浓度较高的5号和6号样品出现红锈。随着腐蚀的进行,当腐蚀周期为30 CCT时,2~6号样品均出现红锈,1号样品为硫酸盐环境下的,始终没有观察到红锈。镀锌钢的表面为锌,基体为Q235碳钢。白锈是锌的腐蚀产物,红锈为碳钢的腐蚀产物。在腐蚀初期和电解质浓度较小时,样品表面发生的是锌的腐蚀;随着腐蚀的进行,锌层被破坏,基体碳钢开始腐蚀,出现红锈。电解质溶液中NaCl浓度越大,红锈出现得越早,说明不同浓度的氯离子对镀锌钢的腐蚀程度影响很大。
2.2 腐蚀动力学
用不同浓度的电解质溶液(如表1)来进行NaCl和NaHSO3对镀锌钢的协同腐蚀试验,探究在不同NaCl浓度时镀锌钢的腐蚀增重情况。图2为干/湿交替腐蚀条件下镀锌钢腐蚀增重。图2a表明,镀锌钢样品的腐蚀增重随腐蚀时间的延长而增大,其中1号样品和2号样品的增重没有明显变化,镀锌钢腐蚀生成的腐蚀产物为白锈,主要成分为ZnCl2、ZnO、Zn(OH)2、Zn5(OH)8Cl2等[15],锈层为一层保护膜,疏水性较强,保护能力较好,阻止了基体的进一步腐蚀。其他样品的腐蚀增重较大,是由于Cl-渗透性较强,穿过锈层,破坏样品的保护膜。因此随着Cl-浓度的增大,腐蚀程度加剧。当腐蚀周期为1~10 CCT时,腐蚀增重变化不明显,而且样品质量不稳定,有轻微的波动,是因为前期生成的锈层不稳定,容易分解。后期腐蚀增重较大,而且此时开始产生红锈,说明此时基体碳钢开始腐蚀。后期5号和6号样品的腐蚀增重增加较为明显,与文献[16]的随着Cl-浓度的增大,腐蚀速率先增大后减小的现象不同。分析认为,本实验腐蚀增重随着Cl-浓度的增大而增大,说明后期高浓度的Cl-和NaHSO3的协同作用较强。
为了进一步了解不同大气环境下的镀锌钢质量随干/湿交替次数(CCT)的变化过程,用金属在大气中腐蚀常用的幂指数表达式[17]来进行计算,如式(1)所示:
ΔW=ANn
(1)
其中ΔW表示单位面积的腐蚀增重(mg/cm2),N为干湿交替循环组次数(CCT),A为单位面积试样在第一个循环时的腐蚀增重(mg/cm2),n为幂指数, 通常为常数。
从表2中可以看出,R2>0.9说明拟合程度较好,该方程可以用来表示腐蚀增重的趋势。从图2b中可以看出,后期数据拟合较好,比较符合幂指数函数,前期数据规律性不大。前期主要是锌腐蚀,锌生成的产物一部分能溶解,因此增重不太稳定,后期主要是碳钢的腐蚀,铁锈比较稳定。n的值能反应样品腐蚀的加速情况[18],n<1说明腐蚀减速,n>1说明腐蚀加速,从表2中可以看出,1~3号样品是减速腐蚀,4~6号样品是加速腐蚀,随着Cl-浓度的增大,参数n越来越大,腐蚀速率越来越大。
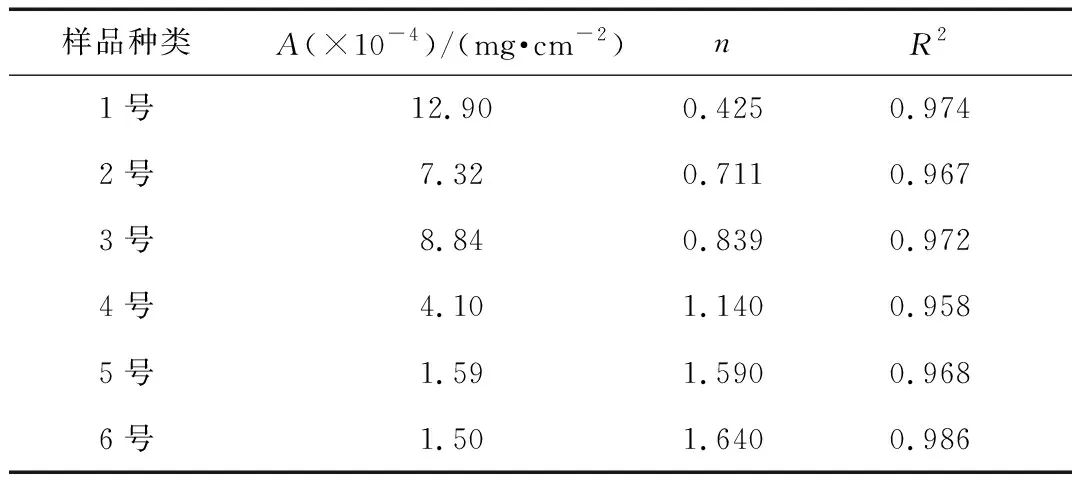
表2 模拟不同大气腐蚀条件下腐蚀增重拟合幂指数函数的各个参数
平均腐蚀速率用式(2)表示[19]:
(2)
式中:va是平均腐蚀速率,mg/(cm2·次-1);W是腐蚀样品质量,mg/cm2;N是干湿交替循环组次数(CCT);m为取样时期(m=1时,意味着样品经过一次干/湿循环,反过来m=2, 3, 4, 5, 6, 7,……,意味着样品分别经历过2, 3, 4, 5, 6, 7,……,次干/湿循环)。
图3显示了样品va随干/湿交替次数的变化规律,随着腐蚀时间的延长,镀锌钢的va先减小,再增大。在腐蚀初期,因为镀锌钢是裸露的,此时样品接触的O2浓度最大,导致金属起始腐蚀速率较大,随着腐蚀的进行,腐蚀速率急速下降,这是因为锌腐蚀生成的腐蚀产物致密性较强,能隔绝O2和腐蚀介质,对锈层的保护性很好;而且锌作为牺牲阳极,对碳钢有一定的阴极保护作用;到了腐蚀后期,腐蚀速率增大,是由于Cl-渗透锈层腐蚀钢基体,出现红锈,红锈的保护性没有锌锈的保护性好,因此腐蚀速率增大。1号和2号样品的后期腐蚀速率波动较大,是因为锌锈层不稳定,容易形成和分解,故腐蚀增重也不稳定。4号和5号样品后期的波动较小,因为红锈成分比较稳定,不易分解和流失,故腐蚀增重稳定增大。
2.3 电化学测量
2.3.1 极化曲线
图4为6种模拟大气腐蚀环境中,锈蚀样品随CCT变化时的极化曲线。从图4可以看出,前期的腐蚀电位比较小,随着腐蚀的进行,腐蚀电位逐渐增大,说明锈层的耐腐蚀性逐渐增强,与文献[20]分析的结果一致。1号和4号样品的阳极极化曲线出现了一段钝化状态,主要因为锌腐蚀生成的产物有ZnO,它是一种难溶于水的半导体薄膜,覆盖在样品表面,能阻止金属的溶解,使金属由活化状态变成钝化状态,此时金属的腐蚀速率极低。4号样品的腐蚀周期从5 CCT到15 CCT时,腐蚀电位增大,因为金属钝化后,都会伴随着电位在较大范围内的正移。当钝化膜被破坏时,金属表面开始溶解,阳极电流密度增大,金属恢复活性溶解状态[21]。此时镀锌层失去了钝化膜的保护作用,随着腐蚀的进行,碳钢基体开始腐蚀,产生的红锈越来越多,样品表面的锈层越来越厚,致密性逐渐增强,保护性能更好,腐蚀电位再次增大,比如4号样品的15 CCT到30 CCT。随着腐蚀的进行,腐蚀电位逐渐增加,阳极极化曲线Tafel斜率的绝对值比阴极低,说明其腐蚀反应受阴极氧化还原控制。
2.3.2 腐蚀电流密度
图5为不同环境下的腐蚀样品的腐蚀电流密度随循环次数的变化规律。腐蚀电流密度Jcorr与样品的极化电阻Rp的关系可以用Stern - Geary方程[22][如式(3)]表示:
(3)
其中Jcorr为腐蚀电流密度(μA/cm2),Rp为极化电阻(μΩ)。常数B取决于腐蚀过程中阳极和阴极反应动力学系数的大小。因此,Jcorr与腐蚀速率成正比,在1~3号样品中,Jcorr前期平稳,后期平稳下降,随着Cl-浓度的增大,4号和5号样品中Jcorr前期急速下降,然后上升,后期再次下降。前期下降是因为在电化学腐蚀过程中,金属可能在钝化状态,Jcorr此时极低。随着腐蚀的进行,样品的锌层被破坏,内部的碳钢基体开始腐蚀,腐蚀速率加快,产生大量红锈,覆盖在样品表面,最后阻碍样品的阳极溶解。6号样品前期Jcorr较大,是由于Cl-浓度较高,对金属的腐蚀能力很强,早已破坏锌层,故其腐蚀速率很大,而后期由于其产生的腐蚀产物较厚,覆盖在样品表面,抑制了腐蚀,因此后期的Jcorr出现下降。
2.3.3 电化学阻抗
在干/湿循环腐蚀实验后,样品在腐蚀电位下测量的阻抗特性如图6所示,图中为根据锈蚀镀锌钢样品的实验数据点拟合的曲线,幅频曲线和相频曲线作为干湿循环次数N的函数。在Bode谱中,|Z|值越高,相位角越大,说明电荷转移电阻越大,锈层的致密性越高。从相频曲线中峰的位置可以看出,在腐蚀前期峰在高频的位置,说明高频区主要是溶液电阻,随着腐蚀的进行,峰的位置逐渐向低频区转移。从图6可以看出,随着腐蚀的进行,镀锌钢在低频时的阻抗值逐渐增大,说明锈层的保护作用随着干湿循环次数N的增加而增大。在初始阶段(1 ~ 5 CCT),镀锌钢的高频和低频阻抗接近,15 CCT和30 CCT的低频和高频差值逐渐增大,说明电荷转移电阻增大,并且远远大于溶液电阻,在低频时锈层/钢界面的电荷转移电阻占主导地位。从相频曲线可以看出,随着腐蚀的进行,镀锌钢的峰值相位角都在增大,说明电解质渗透到锈层的阻力在逐渐增大。
2.4 锈层截面形貌分析
图7为不同腐蚀时间下锈蚀镀锌钢样品的微观截面形貌。1号为不加氯化钠的样品,3号为加入氯化钠的样品。3号样品的氯化钠浓度比较适量,对于含盐样品的研究比较具有代表性。当电解质溶液不含NaCl时,在腐蚀初期,表面无明显腐蚀产物存在,在腐蚀中期,样品表面有轻微的腐蚀产物,随着腐蚀的进行,镀锌钢表面有一定程度的腐蚀。当电解质溶液中含有一定量的NaCl时,在腐蚀前期,锈层比较疏松,空隙较大,不利于保护样品基体;随着腐蚀的进行,锈层变得致密,此时锌的腐蚀产物覆盖在样品表面。锈层能隔绝O2和腐蚀介质,此时腐蚀速率较小,对基体的保护作用较好;在腐蚀后期,致密的锈层已被破坏,此时已产生红锈,腐蚀将进一步进行。在腐蚀初期,主要是锌的腐蚀,生成的致密产物层会保护样品基体,阻止进一步的腐蚀,随着腐蚀的进行,Cl-渗透性较强,保护层逐渐被破坏,基体碳钢开始腐蚀。
2.5 腐蚀机理
镀锌钢的耐腐蚀性主要是基于锌的牺牲阳极保护作用和锌腐蚀产物的保护作用。镀锌钢的腐蚀分为3个阶段,在腐蚀的第1阶段时,电解质中O2含量比较充足,金属离子迁移没有阻力,样品表面的锌层开始腐蚀,锌的金属活性较大,容易被氧化成ZnO,锌腐蚀的产物为白色的锌锈[23],主要成分为ZnO、ZnCl2、Zn(OH)2、Zn5(OH)8Cl2、Zn5SO4(OH)6·nH2O。ZnO比较致密,在样品表面形成钝化膜,抑制金属的溶解,从而保护样品的进一步腐蚀;在腐蚀的第2阶段,当样品表面有电解质溶液时,镀锌钢的腐蚀为电化学腐蚀,锌充当牺牲阳极来保护碳钢基体。当电解质溶液变薄时,不足以支撑锌与铁的电化学反应时,基体钢通过缝隙溶液开始腐蚀,此时开始产生红锈。在腐蚀的第3阶段,碳钢基体开始腐蚀,此时的腐蚀机理和碳钢相同。
镀锌钢在一般大气中的初期腐蚀是锌的溶解和氧的还原。生成腐蚀产物为ZnO、 Zn(OH)2。由于空气中存在CO2气体,溶解在水中变成CO32-,Zn(OH)2进一步生成Zn5(OH)6(CO3)2。
3Zn(OH)2+2Zn2++2CO32-→Zn5(OH)6(CO3)2
(4)
本研究电解质溶液中含有Cl-和HSO3-,HSO3-电解生成SO32-,进一步氧化为SO42-。Zn(OH)2在Cl-和SO42-的存在下生成Zn5(OH)8Cl2、Zn5SO4(OH)6·nH2O。锌的腐蚀产物比较难溶,且致密性强,覆盖在镀锌钢表面,隔绝O2和腐蚀介质,对样品起到一定的保护作用。
4Zn(OH)2+Zn2++SO42-+nH2O→Zn4(OH)6SO4·nH2O
(5)
4Zn(OH)2+2Cl-+Zn2++H2O→Zn5(OH)8Cl2·H2O
(6)
当锌层被破坏后,锌作为牺牲阳极对碳钢起到阴极保护作用。当腐蚀进一步进行至锌层失去保护作用后,基体碳钢开始腐蚀,此时腐蚀行为与规律和碳钢一样。此时阳极是铁的溶解,阴极为氧的还原。
Fe3++Cl-+OH-→FeOCl+H+
(7)
4H2SO4+2O2+4Fe→4FeSO4+4H2O
(8)
Cl-为主要的腐蚀因素,Cl-半径较小,渗透性较强,能破坏保护层,腐蚀样品基体。Cl-与锌反应生成的ZnCl2为可溶的,当加入新鲜去离子水时,ZnCl2溶解,此时的Cl-没有消耗,继续参与反应。NaHSO3促进了镀锌钢腐蚀的进行,增加了阴阳离子的数量,增大了电解液的导电性,HSO3-还能氧化为H2SO4,增大溶液的酸性,因此溶解样品的保护膜,从而促进腐蚀的进行。Cl-渗透锈层并腐蚀基体,NaHSO3提供酸性环境,二者协同促进镀锌钢的腐蚀,而且Cl-浓度越大,二者协同作用越强,镀锌钢的腐蚀越严重。当锌层被破坏,基体钢通过缝隙溶液开始腐蚀,Fe的腐蚀产物是红锈,成分为FeOOH,覆盖在样品表面,比较稳定,不易分解。铁的腐蚀产物没有锌的腐蚀产物致密性好,因此在腐蚀后期,腐蚀速率增大。
3 结 论
(1)在腐蚀初期,样品表面为薄层的半透明薄膜,随着腐蚀的进行,样品表面产生白锈,形成致密的锈层,在腐蚀后期,镀锌钢表面出现红锈,Cl-浓度越大,产生红锈的时间越早。
(2)镀锌钢的腐蚀增重在腐蚀前期不太稳定,主要因为锌的腐蚀产物容易分解,此时腐蚀增重较小,在腐蚀后期,主要为碳钢的腐蚀,腐蚀增重符合幂函数趋势增长,碳钢的腐蚀产物没有锌的腐蚀产物的致密性好。
(3)Cl-腐蚀性严重,NaHSO3起促进作用,随着Cl-浓度的增大,Cl-和SO2对镀锌钢的协同腐蚀作用增强,对镀锌钢的腐蚀更加严重。

