外周血染色体吉姆萨显带制备条件优化研究
明盛金,马洪熹,钟锦萍,黄 滢,黄 瑶(梧州市工人医院 .检验科;.内分泌科,广西梧州 543001)
染色体核型分析技术是染色体病诊断的“金标准”,在产前诊断及复发性自然流产、出生缺陷的病因筛查等方面应用广泛[1-3]。带纹清晰丰富,分辨率高的染色体是核型分析准确性的前提保证。而染色体制备过程复杂,影响因素众多,其中秋水仙素对细胞有丝分裂中期纺锤体的抑制效果以及细胞的低渗处理效果与染色体的制备质量密切相关[4]。因此,本研究在现行染色体制备方案基础上对秋水仙素作用浓度、作用时间及低渗处理时间进行适当的改良与优化,提高了染色体制备成功率,建立一套适合本室的染色体制备方法,现作如下报道。
1 材料与方法
1.1 研究对象 选取2021年4月~2022年4月因不孕不育就诊于梧州市工人医院生殖医学中心的116例成年患者的外周静脉血作为研究对象。其中单因子梯度实验15例,正交实验1例,优化前组50例和优化后组50例。所有患者无感染性疾病、血液系统疾病、自身免疫性疾病及肿瘤病史,近一周内无抗生素使用记录。本研究课题经医院伦理委员会批准,所有患者对染色体核型检查知情同意。
1.2 仪器与试剂 Model CDS-5 分散仪(美国Thermotron),Axio Imager Zeiss & Meta systems全自动扫描染色体图像分析系统(德国美达思软件和硬件技术有限公司),CO2培养箱[赛默飞世尔科技(中国)有限公司],免洗载玻片(上海乐辰生物技术有限公司),淋巴细胞培养液、秋水仙素(20 μg/ml)、吉姆萨染液(广州达晖生物技术有限公司),氯化钾、甲醇、冰醋酸(四川西陇科学有限公司),胰蛋白酶(GIBCO)。
1.3 方法
1.3.1 优化前本室染色体制备方案:每瓶培养液接种外周血0.4 ml,37℃培养72 h,收获前40 min加入终浓度为0.40 μg/ml的秋水仙素,细胞收获后加入8 ml 0.075mol/L氯化钾低渗处理35 min,经固定、滴片、烤片、胰酶消化、吉姆萨染色显带。
1.3.2 单因子梯度实验:选取5例外周血标本进行秋水仙素不同作用浓度实验,每例标本接种6瓶,每瓶接种0.4 ml全血,依次编号①~⑥线,37℃培养72 h。保持秋水仙素作用时间40 min,设置秋水仙素梯度作用浓度依次为0.08,0.16,0.24,0.32,0.40和0.48 μg/ml。细胞收获后加入8 ml 0.075 mol/L氯化钾低渗处理35 min。经固定、滴片、烤片、胰酶消化、吉姆萨染色显带,全自动扫描染色体图像分析系统扫描后对分裂相进行统计,计算染色体制备成功率。
同样,选取5例外周血标本进行秋水仙素不同作用时间实验,保持秋水仙素作用浓度为0.40μg/ml,设置秋水仙素梯度作用时间依次为10,20,30,40,50和60 min,细胞收获后加入8 ml 0.075mol/L氯化钾低渗处理35 min。选取5例外周血标本进行不同低渗处理时间实验,保持秋水仙素作用浓度为0.40μg/ml,秋水仙素作用时间40 min,设置氯化钾梯度低渗处理时间依次为5,20,35,50,65和80 min。经固定、滴片、烤片、胰酶消化、吉姆萨染色显带,全自动扫描染色体图像分析系统扫描后对分裂相进行统计,计算染色体制备成功率。
1.3.3 正交实验设计:在单因子梯度实验结果基础上,选取1例外周血标本进行细胞培养,共接种9瓶,编号①~⑨线,设计3因素3水平的正交实验,依据不同的秋水仙素作用浓度、作用时间和低渗处理时间进行正交实验设计。并对分裂相进行统计,计算染色体制备成功率,重复实验三次,取平均值。以染色体制备成功率最高的组合作为本室优化后染色体制备方案。
1.3.4 观察指标:利用Axio Imager Zeiss & Meta systems全自动扫描染色体图像分析系统对每一线标本制备的片子扫描2张,每张片子自动选取排名前60的分裂相进行统计。观察指标包括染色体长度、带纹丰度、清晰度。以吉姆萨显带>320带的分裂相为可供分析分裂相,以染色体制备成功率(可供分析的分裂相数量/总分裂相数量)对染色体制备效果进行评价[5]。对吉姆萨显带320带、400带和550带的质量评价参照《ISCN2016》Fig.5染色体核型示意图,其中320带判断标准:8p12,8p22两条深带出现,10q21,10q23,10q25三条深带出现,20p12可见,22q12清晰;400带判断标准:4q中段出现3条深带,5q中段出现3条深带,9p21,9p23两条深带出现,13q33清晰;550带判断标准:5q31.2清晰,8p21.2可见,11p15.2,11p15.4出现,22q13.2清晰[6]。对所有核型的分析和质量评价均由2名固定的细胞遗传学专业人员完成。
1.4 统计学分析 采用SPSS25.0软件统计分析,计数资料以率表示,两组间比较采用χ2检验,检验水准:α=0.05。以P<0.05为差异有统计学意义。
2 结果
2.1 单因子梯度实验结果 见表1。在秋水仙素不同作用浓度实验中,随着秋水仙素浓度上升,染色体制备成功率呈先上升后下降趋势,当秋水仙素作用浓度为0.24 μg/ml时染色体制备成功率最高,达67.67%,与0.48,0.08 μg/ml时相比差异有统计学意义(χ2=32.60,59.13,均P<0.001),与0.16,0.32和0.40 μg/ml时相比差异无统计学意义(均P>0.05)。表明秋水仙素的作用浓度应大于0.08 μg/ml,小于 0.48 μg/ml。

表1 单因子梯度实验结果
在秋水仙素不同作用时间实验中,染色体制备成功率随着秋水仙素作用时间的增加呈先上升后下降趋势,当秋水仙素作用时间为30 min时染色体制备成功率最高,达62.33%,与10 min相比差异有统计学意义(χ2=86.44,P< 0.001),与 20,40,50和60 min相比差异无统计学意义(均P>0.05)。表明秋水仙素作用时间以大于10 min为宜。
在不同低渗处理时间实验中,低渗处理时间不足,染色体分散不佳,且不易显带,低渗处理时间太长,染色体肿胀发毛。随着低渗处理时间增加,染色体制备成功率同样呈先上升后下降趋势,35 min时染色体制备成功率最高,为64.17%,与65,5 min相比差异具有统计学意义(χ2=54.882,111.682,均P<0.001),与20,50 min相比差异无统计学意义(P>0.05)。表明低渗处理时间应控制在20~50 min为宜。
2.2 正交实验结果 见表2。根据单因子梯度实验结果,分别以秋水仙素作用浓度0.24 μg/ml,作用时间30min,低渗处理时间35min为中心各向上、向下扩大一个水平进行正交实验的设计。秋水仙素作用浓度设置0.20,0.24和0.28 μg/ml三个水平;秋水仙素作用时间设置25,30和35 min三个水平;低渗处理时间设置30,35和40 min三个水平。当秋水仙素作用浓度为0.24 μ g/ml,作用时间30 min,低渗处理时间为40 min时(实验组合5),染色体制备成功率最高。因此选取实验组合5作为本室外周血染色体吉姆萨显带制备的最优体系。
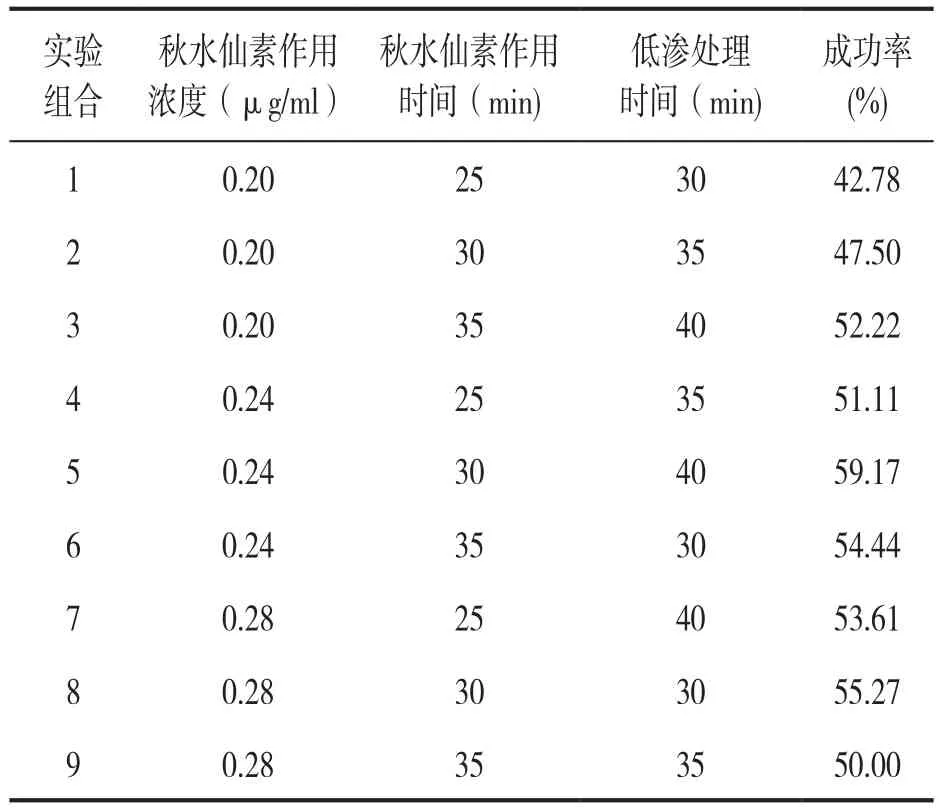
表2 正交实验结果
2.3 优化前、后两组染色体制备效果比较 优化前组吉姆萨显带<320带的分裂相占64.30%,显著高于优化后组的43.78%,差异具有统计学意义(χ2=508.443,P<0.001);优化前组可供分析的分裂相以320~400带为主,占33.12%,400~550带的分裂相仅占2.58%。优化后组所制备出的染色体更细长、带纹更丰富,分辨率也有所提高。其中320~400带占40.30%,400~550带占15.92%,均显著高于优化前组,差异具有统计学意义(χ2=66.629,635.346,均P<0.001)。所有标本染色体核型分析结果均未见异常核型。
3 讨论
人类染色体吉姆萨显带核型分析技术是染色体病诊断的重要技术手段,高质量的染色体是核型分析准确性的前提。我国染色体核型检验诊断专家共识建议,常规核型分析吉姆萨显带染色体分辨率不应低于320带,对于精神发育迟缓、畸形、出生缺陷可疑者,条带分辨率应达到550带水平[7]。为此,制备出带纹清晰丰富、分辨率高的染色体是细胞遗传学工作者不断探索的方向。染色体制备技术操作步骤繁杂,影响因素众多,标本质量、细胞培养、细胞收获及之后的固定、滴片、烤片、消化染色等因素都会对染色体制备质量产生一定影响[8]。为此,目前对于染色体的制备尚未有统一标准。本研究主要从秋水仙素作用浓度、作用时间及低渗处理时间三个影响染色体制备效果的重要因素入手,对外周血染色体制备条件进行优化研究。
秋水仙素的主要作用是抑制纺锤体形成,促使细胞有丝分裂停滞于中期,以获得中期分裂相;此外,秋水仙素还具有促使染色体浓缩的作用[9]。既往研究认为,秋水仙素作用浓度、作用时间与分裂相数量呈正比,与染色体分辨率呈反比,秋水仙素作用浓度高,或者作用时间长,所得分裂相多,但染色体长度和分辨率会有所下降;相反,秋水仙素作用浓度低,或者作用时间短,染色体分辨率会有所增加,但所得分裂相会减少,甚至无分裂相,无法满足分析要求[10]。为此,在中期染色体制备过程中,秋水仙素的作用效果与剂量、时间密切相关。在本研究中,单因子梯度实验结果亦表明,在秋水仙素较低作用浓度组或较短作用时间组,所制备出的染色体较为细长,但存在消化显带困难、交叉重叠较多的缺点;而在秋水仙素较高作用浓度组或较长作用时间组,染色体分散较好,显带也较为清晰,但所得染色体较为短小,分辨率往往达不到分析要求。本实验表明秋水仙素作用浓度过低或过高,作用时间过长或过短,均会影响染色体制备成功率,不利于核型分析。低渗效果与后续的染色体分散程度及带纹清晰度、分辨率密切相关,低渗时间过短,细胞膨胀不充分,滴片时会导致染色体交叉重叠,且不易消化显带,不利于核型分析;低渗时间过长,染色体过度肿胀,可导致细胞过早破裂,染色体丢失,且肿胀的染色体带纹模糊不清,同样不利于核型分析[11]。在本研究中,通过CDS-5染色体分散仪控制滴片时的温、湿度环境,在染色体分散仪内滴片可减少因滴片时不稳定的环境因素对低渗实验效果评价的干扰[12]。不同低渗处理时间的单因子梯度实验结果亦表明,低渗时间过长或过短均会影响染色体制备成功率。
传统的染色体制备质量评价指标有有丝分裂指数、异常核型检出率、染色体分散程度及染色体制备成功率等[12]。结合本实验室条件及实验目的,考虑到各指标获取的可行性,本研究以较直观获取的染色体制备成功率作为评价指标。目前,虽然基于药物同步化的高分辨染色体制备方法已较成熟地应用于临床,但也存在操作步骤增多、经济成本增加、同步化试剂的有毒有害等缺点[13]。本研究通过单因子梯度实验及正交实验,对本室外周血染色体制备条件进行了优化,确定了最适染色体制备方案,并进一步比较优化前、后两种方案的染色体制备效果,证明了优化后的染色体制备方案能提高染色体制备成功率,尤其是提高了400~550带的分裂相所占比例,在不增加经济成本及工作量情况下可满足临床分析要求。当然,不同实验室之间由于实验人员操作手法、实验仪器和实验试剂的差异,难以保证方法学及实验结果与本研究的完全一致性。但是各实验室可根据自身条件结合本研究思路,探索建立适合自己实验室的最适染色体制备方案,以提高染色体制备成功率。

