miRNA-34b对子宫内膜癌细胞凋亡、侵袭、迁移的影响及作用机制
李晓妍,高秀娟,刘雪洁
(1.保定市第二中心医院妇科,河北保定 072750;2.承德医学院附属医院妇科,河北承德 067020)
子宫内膜癌(endometrial cancer)是女性生殖道常见的恶性肿瘤,由多种肿瘤类型组成,具有不同的光镜特征、分子遗传学改变和预后[1-2]。子宫内膜癌恶化后会出现转移,可转移至肺、肝等重要器官,可能对患者生命造成严重威胁[3]。表观遗传学研究表明miRNA-34b在子宫内膜癌等多种癌症中发挥重要作用[4-6]。在一项临床样本的研究中,通过TaqMan OpenArray 技术测量了子宫内膜癌相关miRNA 的表达谱系,结果筛选出miRNA-34b为子宫内膜癌的独立风险因素[4];在细胞水平上,研究表明miRNA-34b 作为乳腺癌细胞雌激素依赖性生长的肿瘤抑制因子,可抑制乳腺癌肿瘤生长和细胞增殖[5],同时研究表明miRNA-34b 通过去甲基化、活性染色质修饰和 AKT信号通路的调控抑制前列腺癌的发生发展[6],由此可见miRNA-34b是子宫内膜癌等多种癌症中的重要调控分子。Jagged-1蛋白(Jag1)是细胞表面配体之一,在细胞命运决定中起着关键作用,在整个发育过程中和许多器官系统中表达活跃[7]。在对于来自47例I~IV 期子宫内膜癌手术的女性子宫内膜样本分析研究发现,Jag家族成员如Jag1 mRNA, Jag2 mRNA表达水平发生了显著的变化[8]。基于上述背景本研究拟通过细胞实验探究转染miR-34b对子宫内膜癌增殖、凋亡、迁移和侵袭的影响,并探究对Jag1/Cyclin D1信号通路在此过程发挥的影响,同时通过裸鼠实验在体内探究miR-34b对肿瘤生长的影响,为miR-34b在子宫内膜癌细胞中发挥的作用提供分子机制和理论基础。
1 材料与方法
1.1 研究对象 细胞:人子宫内膜癌细胞系AN3CA购自国家模式与特色实验细胞资源库/国家科技资源共享服务平台。裸鼠:SPF 级裸鼠,雌性,20±2g,20只,购于中生北动(北京)科技发展有限公司,使用许可证号:SYXK(京)2020-0051,饲养条件为:12/12h昼夜照明,温度22℃±2℃,湿度55%±5%条件饲养,自由饮水饮食,适应性饲养一周。
1.2 仪器与试剂 CytoFLEX 流式细胞仪(德国贝克曼公司);7500 qPCR仪(美国ABI公司);western blot 电泳仪(美国bio-rad公司);实验耗材(美国corning公司);MEM(货号:PM150467 Glbio),FBS(货号:164210-500,Glbio),P/S(货号:PB180120,GIbico);凋亡试剂盒(货号:C1062S,碧云天公司);Transwell试剂盒(货号:BL710A,Biosharp公司);Jag1抗体(ab8805),Cyclin D1抗体(ab109536),GAPDH抗体(ab16663,Abcam,英国)。
1.3 方法
1.3.1 细胞培养及转染方法:人子宫内膜癌细胞AN3CA细胞培养条件:空气 95%,CO25ml/dl,温度:37℃,培养密度:1×10 cells/T25培养瓶,换液及传代:每隔1~2天更换全新培养液,3天传代一次,传代按照1∶3比例传代。PI3K激活剂终浓度为50μg/ml,转染条件:严格按照LipofectamineTM3000说明书对细胞进行转染NC质粒和miR-34b质粒,转染8 h后换液。细胞处理:对照组细胞正常培养,NC组细胞转染NC质粒,miR-34b组细胞转染miR-34b质粒。
1.3.2 细胞凋亡实验:用不含EDTA的胰酶消化后,300 g,4℃离心5 min收集细胞。用预冷的PBS洗涤细胞2次,每次均需300 g,4℃离心5 min。收集(1~5)×105个/ml细胞。吸弃PBS,加入100 μl 1×Binding Buffer重悬细胞。严格按照凋亡试剂盒加入5 μl Annexin V-FITC和10 μl PI Staining Solution,轻轻混匀。避光、室温孵育15 min。加入 400 μl 1×Binding Buffer,混匀后放置于冰上,为防止荧光物质发生淬灭,样品在1 h内用流式细胞仪检测。
1.3.3 Transwell实验检测细胞迁移及细胞侵袭:将细胞培养至对数生长期,用胰蛋白酶消化,重新铺至迁移实验和侵袭实验的小孔中,迁移实验小孔膜上不包被基质蛋白,侵袭实验中需要在微孔膜上额外包被基质蛋白。严格按照transwell试剂盒进行实验,取1L双蒸水,把PBS粉末全部溶解,配制后可以4℃保存备用,取出准备好的细胞,吸出培养液,PBS清洗3次;用棉签擦去上室面细胞,取2ml固定液加入孔板,放入Transwell,固定15 min,PBS清洗3次,每次5 min;在孔板中加入1ml染色液,使Transwell浸泡在液体中,染色10 min;弃掉染色液,加入1ml调色液A,加一滴调色液B,快速混匀;弃掉所有液体,用PBS清洗1次,用刀片取下膜,放在载玻片上,加1~2滴封片液,盖上盖玻片,显微镜下400×观察,随机选取3个视野进行计数。
1.3.4 qPCR检测mRNA表达水平:qPCR检测各组细胞的Jag1和Cyclin D1表达水平。将细胞用TRIZOL法冰上无酶环境提取总RNA,后反转录合成cDNA后,进行PCR扩增。95℃预变性10 min,95 ℃变性15 s,55℃退火15 s,共40个循环。引物序列见表1。每个样品重复3次检测,利用2-△△Ct相对定量法计算各个指标的相对表达量,用内参β-actin对其标准化处理。
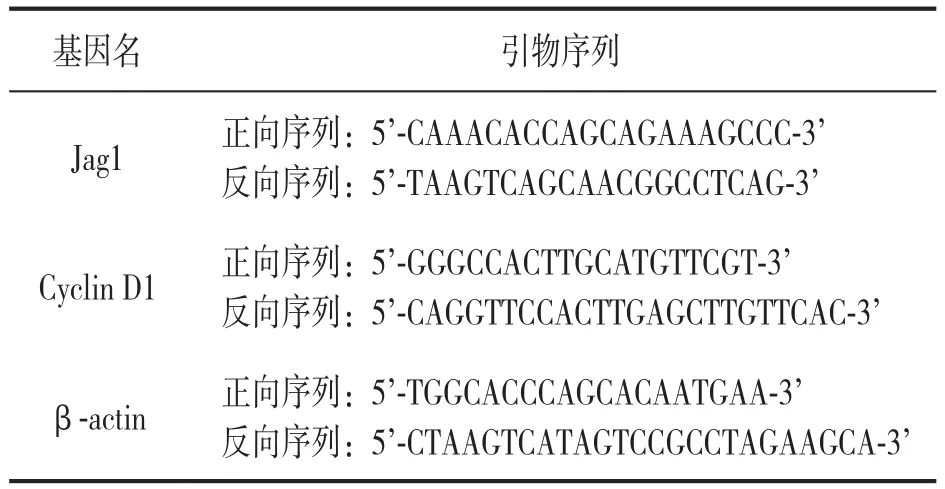
表1 qPCR检测中不同基因的引物序列
1.3.5 Western blot 检测蛋白表达水平:取适量细胞,加入1ml RIPA提取裂解液制成蛋白提取液,使用BCA法测定蛋白浓度。加入5×SDS的蛋白上样缓冲液煮沸后,分装保存于-80℃冰箱备用。将样品分别加入不同的泳道进行聚丙烯酰胺凝胶电泳,浓缩胶电压80V,分离胶电压120V,后转至PVDF膜,用5%BSA封闭。加入特异性一抗Jag1(1∶1 500),Cyclin D1(1∶1 000),GAPDH(1∶10 000,)于4℃冰箱过夜。TBST洗膜3次,加入特异性的羊抗兔二抗(1∶2 000),孵育1h。TBST洗膜3次,采用ECL化学发光液曝光显影,使用Image J图像分析软件系统进行半定量分析。
1.3.6 裸鼠荷瘤实验:取对数生长期的人子宫内膜癌细胞系以PBS缓冲液调整细胞至5×107个/ml的细胞悬液。将所得细胞悬液以1ml无菌注射器接种于20只裸鼠右侧腋下皮下,注入细胞悬液并采用无菌棉签压紧进针口,迅速拔除注射器针头,每只裸鼠注射0.2ml。对照组(n=10)注射野生型AN3CA细胞,miR34b组裸鼠(n=10)注射转染miR-34b的AN3CA细胞,7天后测量肿瘤体积,建模成功的判断标准:皮下瘤块体积≥0.5cm3,肿瘤生长达不到标准的进行裸鼠不进入实验,成瘤后每3天用游标卡尺测量皮下瘤块的长短径,计算瘤体积=长径×短径2×1/2[5,8],连续21天,绘制两组裸鼠肿瘤生长曲线及每只裸鼠肿瘤生长曲线。
1.4 统计学分析 采用SPSS软件26.0对数据进行统计学分析,以均数±标准差(±s)表示。数据经正态性检验和方差齐性检验,对连续性计量资料采用单因素方差分析(One Way ANOVA)进行比较,非连续性计量资料采用秩和检验进行多组间比较,两组间比较采用t检验。以P<0.05为差异有统计学意义,采用Graphpad 9软件进行统计学图片绘制。
2 结果
2.1 miR-34b对人子宫内膜癌AN3CA细胞凋亡的影响 见图1。流式细胞检测各组细胞凋亡,结果表明对照组、NC组和miR-34b组细胞凋亡比例分别为5.6%±0.12%,5.80%±0.22% 和19.4%±0.51%,相比于对照组,miR-34b组细胞凋亡比例显著升高,差异具有统计学意义(t=8.325,P<0.01),而NC组与对照组差异无统计学意义(t=0.243,P>0.05)。

图1 miR-34b对人子宫内膜癌细胞AN3CA细胞凋亡的影响(与对照组相比**P<0.01)
2.2 miR-34b对人子宫内膜癌细胞AN3CA迁移和侵袭能力的影响 见表2,图2。Transwell实验检测子宫内膜癌细胞迁移和侵袭能力,与对照组相比,miR-34b组细胞迁移,侵袭能力均显著降低,差异均具有统计学意义(t=7.945,7.643,均P<0.01);而NC组与对照组差异无统计学意义(t=0.185,0.193,均P>0.05)。

图2 miR-34b对人子宫内膜癌细胞AN3CA迁移和侵袭能力的影响
表2 miR-34b对人子宫内膜癌细胞AN3CA细胞迁移与侵袭的影响(±s)

表2 miR-34b对人子宫内膜癌细胞AN3CA细胞迁移与侵袭的影响(±s)
类 别 对照组 NC组 miR-34b组细胞迁移数(个) 322.15±13.71 327.67±9.14 162.19±7.49细胞侵袭数(个) 357.6±14.11 364.05±16.12 157.58±8.77
2.3 miR-34b对人子宫内膜癌细胞AN3CA细胞Jag1/Cyclin D1信号通路的影响 见表3。通过qPCR和Western blot 检测各组细胞Jag1/Cyclin D1信号通路的变化,结果与对照组相比,miR-34b组Jag1及Cyclin D1 mRNA相对表达均有降低趋势,差异具有统计学显著性意义(t=8.434,9.124,均P<0.01),NC组与对照组差异无统计学意义(t=0.241,0.375,均P>0.05),与对照组相比,miR-34b组Jag1及Cyclin D1 蛋白相对表达均有降低趋势,差异有统计学意义(t=7.895,8.227,均P<0.01),NC组与对照组差异无统计学意义(t=0.312,0.423,均P>0.05)。
表3 miR-34b对AN3CA细胞Jag1/Cyclin D1mRNA及蛋白的影响(±s)

表3 miR-34b对AN3CA细胞Jag1/Cyclin D1mRNA及蛋白的影响(±s)
类 别 对照组 NC组 miR-34b组mRNA相对表达(Jag1) 2.75±0.21 2.67±0.14 1.19±0.19蛋白相对表达(Jag1) 1.71±0.11 1.77±0.24 0.69±0.16 mRNA相对表达(Cyclin D1) 1.29±0.13 1.32±0.11 0.59±0.13蛋白相对表达(Cyclin D1) 1.81±0.18 1.79±0.14 1.29±0.16
2.4 miR-34b对裸鼠肿瘤生长的影响 裸鼠荷瘤后精神状态良好、活动频繁、饮食、饮水量正常,荷瘤7天后,各组有6只裸鼠肿瘤体积≥0.5cm3,成瘤率60%,用于肿瘤生长曲线测量和绘制。miR-34b组裸鼠肿瘤体积显著低于对照组裸鼠,见图3a; miR-34b组裸鼠肿瘤平均生长速度显著受到抑制,见图3b;从第15天开始肿瘤体积显著低于对照组,在第21天时肿瘤质量显著低于对照组小鼠,结果差异具有统计学意义(t=7.324,P<0.01)。

图3 miR-34b对裸鼠肿瘤生长的影响(注*代表与对照组相比,**P<0.01)
3 讨论
子宫内膜癌(endometrial carcinoma)是最常见的女性生殖系统肿瘤之一,发生于子宫内膜的一组上皮性恶性肿瘤,好发于围绝经期和绝经后女性,每年有接近20万的新发病例,并是导致死亡的第三位常见妇科恶性肿瘤[9]。子宫内膜癌的发展与雌激素相对于孕酮过量等因素密切相关,由于子宫内膜癌是一种雌激素依赖性肿瘤类型,其发病风险增加与肥胖、糖尿病、非对抗性雌激素使用、未产妇、初潮早期和绝经晚期有关,年龄增长也是重要的危险因素,手术是子宫内膜癌最主要的治疗方法,是治疗子宫内膜癌有效的方法之一。单纯放疗仅适用于年老体弱及有严重内科并发症不能耐受手术或禁忌手术者,以及Ⅲ期以上不宜手术者,包括腔内及体外照射化疗很少单独应用于子宫内膜癌的治疗,多用于特殊类型的子宫内膜癌,如浆液性、透明细胞癌等;或是复发病例;或是具有复发高危因素的手术后患者,如G3,ER/PR阴性者,化疗中主要应用的药物有铂类、紫杉醇以及阿霉素类药物[10]。
子宫内膜癌等大量癌症的发生伴随着表观遗传学变化、DNA甲基化、组蛋白修饰以及microRNA的调控都是子宫内膜癌发展的重要因素,表观遗传学不仅有助于子宫内膜癌的早期诊断,对于分子靶向治疗也有良好的应用前景[11],如微小核糖核酸(MicroRNA,miRNA)的调控,miRNA 是一类由内源基因编码的长度约为22个核苷酸的非编码单链RNA分子,它们在动植物中参与转录后基因表达调控[12-14]。研究表明miRNA-34b,miRNA-383-5p, miRNA-10b-5p和miRNA-34c-3p等8种microRNA在子宫内膜癌中发生表达水平的变化并可以作为独立的风险生物标志物[4],其中miRNA-34b参与了多种肿瘤的发生发展,miRNA-34b基因启动子的高甲基化可能在胃癌的发生发展中起重要作用,胃癌组患者miRNA-34b基因启动子DNA甲基化阳性率达到了77.5%[15];在大肠癌中miRNA-34b出现表观遗传沉默现象,miR-34b CpG岛的甲基化在大肠癌细胞系100%沉默,在原发性大肠癌肿瘤90%患者中经常观察到沉默现象,在正常结肠黏膜中没有观察到[16];细胞学实验还发现miR34b可通过多个靶点抑制葡萄膜黑色素瘤细胞增殖和迁移,miR-34b/c被证实下调c-Met,p-Akt和细胞周期相关蛋白的表达[17],由此可见,对miR-34b的探究可能是肿瘤研究的重要方向。本研究通过人子宫癌细胞构建过表达miR-34b细胞模型,探究了miR-34b对子宫内膜癌细胞增殖迁移的作用,结果发现miR-34b可以显著抑制肿瘤细胞的迁移与侵袭,同时增加了细胞的凋亡比例,提示miR-34b对子宫内膜癌细胞的恶性生物学功能具有抑制作用。进一步,本研究通过裸鼠构建小鼠荷瘤模型,在体内验证细胞学实验结果。结果显示在成模后miR-34b组小鼠生长始终慢于对照组小鼠,肿瘤体积于第15天出现显著的统计学差异,于第21天肿瘤质量出现显著的差异,提示在体内miR-34b也可以发挥肿瘤细胞生长的抑制作用。
肿瘤的发生发展与细胞周期调控细胞关系比较密切[18],研究表明细胞周期蛋白D1(cyclin D1)是Jag1介导的Notch信号在乳腺癌中的直接靶点,Jag1下调降低Notch与cyclin D1启动子的直接结合,降低cyclin D1的表达,并通过cyclin D1依赖性G1/S检查点抑制细胞周期进程,此外在三阴性乳腺癌表达数据集中,cyclin D1和Jag1表达相关[19-20]。也有研究表明Jagged-1逆转了过度表达FBXW7对细胞增殖和凋亡的影响,而Notch抑制剂(DAPT)可以抵消过表达STYX对细胞增殖和凋亡的影响,可见Jag1在宫颈鳞癌、子宫内膜癌发生发展及正常组织的生长分化中发挥重要执行者的作用[21]。本研究通过qPCR和western blot实验进一步表明,过表达miR-34b后细胞内Jag1mRNA及蛋白以及Jag1靶基因Cyclin D1 的mRNA及蛋白表达水平显著降低,由此推测Jag1/Cyclin D1信号通路可能收到miR-34b调控,并且是抑制子宫内膜癌细胞恶性生物学行为的重要通路之一。
综上,本研究表明miR-34b具有促进子抑制子宫内膜癌细胞凋亡及抑制迁移和侵袭的作用,其机制抑制PI3K/Jag1/Cyclin D1信号通路活性相关。本研究拟进一步获取临床样本,对PI3K/Jag1/Cyclin D1蛋白在癌组织和癌旁组织进行免疫荧光等实验研究,从原位上证实miR-34b对子宫内膜癌的调控作用,而为临床诊断提供理论基础。

