血清1-硬脂酰-sn-甘油-3-磷酰胆碱水平检测对妊娠期糖尿病的诊断价值
樊娜娜,韩 清,鲁 静,徐 文
(1.枣庄市妇幼保健院产科, 山东枣庄 277000;2.青岛大学附属医院药学部, 青岛 266003)
妊娠期糖尿病(gestational diabetes mellitus,GDM)是指妊娠前糖代谢正常,妊娠期间发生的不同程度的糖代谢异常[1],易发生巨大儿、肩难产、新生儿窒息、子痫前期及母婴将来患2型糖尿病机会增加等不良结局[2]。GDM发病率根据使用的诊断标准和研究的样本人群不同而有很大差异。目前GDM的诊断标准主要是24~28周行75 g口服葡萄糖耐量试验(oral glucose tolerance test,OGTT),但由于孕期肠道的敏感度增加,部分孕妇饮食高糖后会出现呕吐、腹泻等不良反应,因而OGTT不能被广泛接受。如何及时、准确诊断GDM并采取有效治疗措施,从而减少对母婴的危害已成为临床研究重点。目前代谢组学技术在GDM代谢产物方面的研究取得一定的成就,液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)是对设定的代谢产物进行定量或半定量测定的代谢组学技术,通过系统的方法学验证,结果是准确的。GDM是一种代谢性疾病,故有望找到诊断GDM的代谢标志物。溶血磷脂酰胆碱(lysophosphatidylcholine,LPC)是氧化型低密度脂蛋白的主要成分。有研究发现孕早期血清1-硬脂酰-sn-甘油-3-磷酰胆碱(1-stearoyl-sn-glycero-3-phosphorylcholine, LPC18:0)与GDM发生有明显相关性[3],LPC18:0是较稳定的一种代谢终产物,可反映人体脂类的最终代谢状态。本研究旨在采用LC-MS/MS方法对孕妇血清LPC18:0水平进行定量检测,并探讨其在GDM中的诊断价值。
1 材料与方法
1.1 研究对象 选择2020年5~12月在枣庄市妇幼保健院进行产前检查的孕妇60例为研究对象,根据 OGTT 测定结果将妊娠妇女分为GDM孕妇(观察组)30例,年龄21~35(25.56±5.20)岁,孕周24~28(26.86±2.07)周,孕前体重指数22~29(26.86±3.07 )kg/m2。正常孕妇(对照组)30例,年龄20~34(27.23±5.48)岁,孕周24~28(26.12±2.71)周,孕前体重指数22~29(25.76±3.72 )kg/m2。两组孕妇年龄、孕周及孕前体重指数比较差异无统计学意义(均P>0.05)。GDM诊断标准[1]:①空腹血糖≥5.1 mmol/L;②服糖后1 h血糖≥10.0 mmol/L;③服糖后2 h血糖≥8.5 mmol/L,符合其中任意一项,即诊断为GDM。排除标准:①并发心、肝、肾及甲状腺等器官病变者;②糖尿病酮症酸中毒者、风湿免疫性、营养不良等疾病者;③既往有GDM、妊娠期高血压疾病孕产史者;④并发肿瘤者;⑤孕期服用激素及特殊药物者。本研究经本院医学伦理委员会批准(审批号:2020F0051),所有受试者均知情同意并签署知情同意书。
1.2 仪器与试剂 糖化血红蛋白(HbA1c)检测采用德国西门子DCAV antage2000型 HbA1c分析仪;空腹血糖(FPG)检测采用日立7600-020全自动生化分析仪及上海蔚霆生物葡萄糖试剂;空腹胰岛素(FINS)检测采用瑞士罗氏E601电化学发光分析仪,试剂为配套试剂;根据公式计算胰岛素抵抗指数(HOMA-IR),HOMA-IR= FBG(mmol/L)×FINS(mU/L)/22.5。血清LPC18:0采用美国AB公司Agilent 1290II高效液相色谱仪,配备G7120高压二元泵,G7167B自动进样器,G7116B柱温箱,API4000+三重四极杆串联质谱系统,美国AB公司Analyst 1.6.3质谱数据处理软件。LPC18:0试剂(纯度>99%)(上海蔚霆生物科技有限公司),甲醇、乙腈和甲酸(色谱纯,德国Merck公司)。
1.3 方法
1.3.1 常规指标的检测:①收集孕妇年龄、孕前体重指数、孕周等指标。②采集清晨空腹肘静脉血5 ml检测FPG,HbA1c,总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白-胆固醇(LDL-C)、高密度脂蛋白-胆固醇(HDL-C)、空腹FINS等指标,计算HOMA-IR值。③预留空腹外周静脉血3ml。
1.3.2 预留血清样本处理:在4 ℃,12 000r/min离心10 min,取上清液移入离心管,标记好放入-80℃冰箱中。检测时将样本血清4 ℃解冻,取100 μl与300 μl甲醇混合,将混合物涡旋振荡30 s后,离心半径为8 cm,离心(4 ℃,12 000 r/min)5 min,取5 μl上清液得到待测样品。
1.3.3 代谢组学技术[4]:色谱条件:色谱柱为Ultimate AQ-C18 column(3.0 µm, 2.1 mm×100 mm,上海月旭科技有限公司);动相乙腈(A)- 0.1%的甲酸溶液(B)梯度洗脱程序如下:0.0 min ~ 0.5 min,8% A;0.5 min ~ 1.0 min,8%→100% A;1.0 min ~ 6.0min,100% A;流速为0.4 ml/min;柱温:40 ℃;进样量为5 µl。质谱条件:采用电喷雾离子源(electrospray ion source, ESI):正离子模式,质谱参数:碰撞气6×104Pa,气帘气2×105Pa,雾化气4.48×105Pa,辅助气4.48×105Pa,喷雾电压5 500 V,雾化温度550 ℃;负离子模式,质谱参数:碰撞气6×104Pa,气帘气2×105Pa,雾化气4.48×105Pa,辅助气4.48×105Pa,喷雾电压4 500 V,雾化温度550 ℃。LPC18:0质谱条件采用电喷雾离子源为正离子模式,具体MRM条件:去簇电压60V,碰撞电压40V,母离子524.7,子离子184.2。
1.4 统计学分析 采用SPSS 25.0软件对数据结果进行统计学分析,正态分布的计量资料采用均数±标准差(±s)表示,组间比较采用独立样本t检验;非正态分布的计量资料用中位数(四分位间距)[M(P25,P75)]表示,组间比较采用Mann-WhitneyU;连续变量资料之间使用Spearman相关法分析相关性,绘制ROC曲线计算AUC,用以评估特征代谢物的诊断价值。P<0.05为差异有统计学意义。
2 结果
2.1 LC-MS/MS方法典型色谱图 见图1。取5μl待测样品,按“1.3.2”项步骤处理,按“1.3.3”项条件下进样分析,待测样品中待测分析物出峰时间一致,无杂质干扰峰,峰行良好,该方法专属性良好。LPC18:0在5~500μg/ml范围内线性关系良好(r=0.999 1)。实验重复性的RSD 7%,符合生物样本分析要求(小于15%)。

图1 LPC 18:0观察组(A)与对照组(B)典型色谱图
2.2 两组孕妇实验室指标比较 见表1。观察组血清 LPC 18:0 TC,FPG,LDL-C,HbA1c,FINS及HOMA-IR水平均高于对照组,差异有统计学意义(均P<0.05)。观察组和对照组的TG,HDL-C水平比较,差异无统计学意义(均P>0.05)。
表1 两组孕妇实验室指标比较[M(P25,P75),±s]
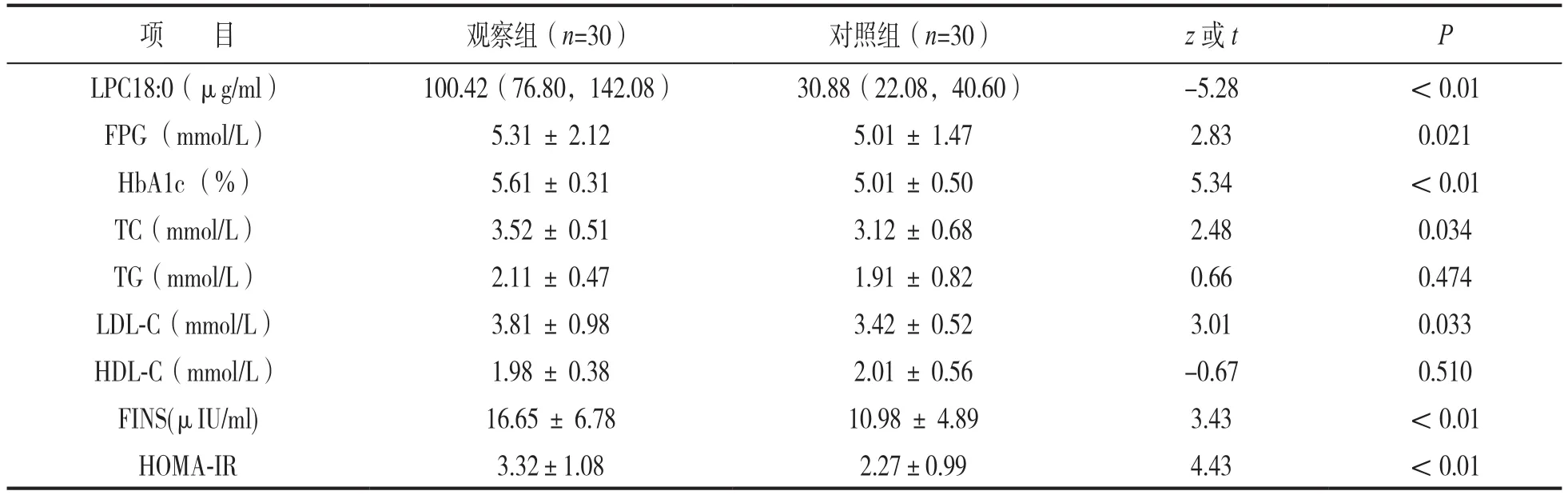
表1 两组孕妇实验室指标比较[M(P25,P75),±s]
项 目 观察组(n=30) 对照组(n=30) z或t P LPC18:0(μg/ml) 100.42(76.80,142.08) 30.88(22.08,40.60) -5.28 <0.01 FPG (mmol/L) 5.31±2.12 5.01±1.47 2.83 0.021 HbA1c (%) 5.61±0.31 5.01±0.50 5.34 <0.01 TC(mmol/L) 3.52±0.51 3.12±0.68 2.48 0.034 TG(mmol/L) 2.11±0.47 1.91±0.82 0.66 0.474 LDL-C(mmol/L) 3.81±0.98 3.42±0.52 3.01 0.033 HDL-C(mmol/L) 1.98±0.38 2.01±0.56 -0.67 0.510 FINS(μIU/ml) 16.65±6.78 10.98±4.89 3.43 < 0.01 HOMA-IR 3.32±1.08 2.27±0.99 4.43 <0.01
2.3 Spearman相关性分析 GDM孕妇血清LPC18:0水平与孕妇年龄、孕前体重指数、TG,HDL-C,HbA1c水平无相关性(r=0.08,-0.14,0.16,-0.09,0.17,均P>0.05),与FPG,TC,LDL-C水平呈正相关(r=0.28,0.41,0.46,均P<0.05),与FINS,HOMA-IR水平呈负相关(r= -0.33,-0.51,均P<0.05)。
2.4 血清LPC18:0水平检测对GDM的诊断价值区别诊断GDM孕妇及正常孕妇时,血清LPC18:0 AUC为 0.988(95%CI=0.964~1.000),当最佳临界值取62.25 μg/ml时,特异度和灵敏度分别为95%和90%。
3 讨论
妊娠糖尿病(GDM)具体发病机制仍不清,目前认为怀孕后胰岛素抵抗加重而出现糖耐量异常,GDM孕妇胰岛素抵抗会更严重[5],糖脂指标也发生改变。有研究[6]利用代谢组学技术,发现GDM患者在不同妊娠阶段中的血清代谢物谱存在一定的差异,且代谢差异主要表现在磷脂代谢途径上,这些差异性代谢物可能是鉴别GDM在不同妊娠阶段的潜在标志物。代谢组学研究有望找到与GDM有关的代谢标志物,及时进行诊断,以改善妊娠结局。
妊娠后体内的代谢物质会发生改变以适应胎儿生长发育的需要,在糖代谢方面,表现出胰岛素的敏感度降低而出现血糖升高;在脂质代谢方面,表现为LDL-C的升高,而磷脂酰胆碱(LPC)是氧化修饰的低密度脂蛋白的主要成分,故孕期也出现升高。而LPC代谢的酶级联反应非常复杂,LPC稳态的紊乱导致了代谢紊乱[7]。GDM孕妇体内胰岛素/胰高血糖素比值降低,促进脂肪分解加速,体内的LDL-C及LPC水平更高,脂肪酸氧化增强,TC合成也增多,从而表现出脂质代谢紊乱。研究发现在诊断GDM前至少10周,脂质和TG代谢都已经发生了变化[8]。本研究发现GDM孕妇体内的血清LPC18:0,TC和LDL-C水平明显高于正常孕妇,说明GDM孕妇体内脂质代谢更为紊乱,这与之前的研究一致。GDM孕妇血清LPC18:0水平与FPG,TC,LDL-C有一定的相关性,血清LPC18:0水平有可能反映出GDM孕妇的糖脂代谢状态。本研究中血清LPC18:0诊断GDM的AUC为0.988,具有较高的诊断效能,液相色谱-串联质谱(LCMS/MS)检测方法准确,LPC18:0性质稳定,孕妇容易接受,故有可能应用于临床来诊断GDM。
在糖尿病中,LPC可诱导胰岛素抵抗,另一方面,它又可以降低血糖[9]。YEA等[10]利用色谱质谱联合的研究方法发现LPC可调节葡萄糖水平,另有研究发现[11]LPC改善了1型糖尿病和2型糖尿病小鼠的血糖水平,这种作用可能为研究葡萄糖稳态提供一个新的视角。LPC降糖作用可能因为在孕期合成的类异戊二烯衍生物刺激胰高血糖素样肽释放,胰高血糖素样肽可增强葡萄糖诱导的胰岛素分泌,从而降低血糖[12]。过氧化物酶体增殖物激活受体α(PPARα)在肝细胞内的激活可产生1-棕榈酰溶血磷脂酰胆碱,1-棕榈酰溶血磷脂酰胆碱具有恢复脂肪细胞诱导的胰岛素抵抗中葡萄糖摄取能力[13]。WANG等[14]研究发现LPC18:0与过氧化物酶体增殖物激活受体γ (PPARγ)结合具有部分激动活性,PPARγ属于核受体超家族,是治疗2型糖尿病有效药物的主要靶点。另有研究发现2型糖尿病患者中LPC18:0与HOMA-IR呈负相关[15],表明特定脂质的改变可能在胰岛素抵抗的发展中发挥重要作用,并可为评估疾病风险和监测疾病发展提供依据。本研究发现LPC18:0与FINS,HOMA-IR有一定的负相关性,增高LPC18:0浓度可能会降低胰岛素抵抗,从而改善GDM患者临床症状,降低不良妊娠结局,这可能为GDM治疗提供新思路,但考虑目前相关研究较少,LPC降血糖的通路和机制仍有待进一步研究和证实。
目前,代谢组学应用于GDM的研究还不够深入和全面,本研究验证出LPC18:0在GDM孕妇及正常孕妇中的差异,对GDM有较高诊断价值,在孕期的GDM患者治疗中应注意调节脂类代谢,进一步了解代谢通路,为GDM的治疗提供了一些新的思路。

