闭式十氢十硼酸盐的制备及其固体电解质应用研究进展
邓 铭 杨 卓 丁洁颖 李湘怡 杨燕京 郭艳辉*,
(1复旦大学材料科学系,上海 200433)
(2西安近代化学研究所,西安 710065)
0 引 言
近几十年来,电池作为一种安全、高效的储能设备被广泛研究并得到迅速发展。作为电池的重要组成部分,电解质可为离子传输提供通道,从而在外电路中形成电流。然而,由于有机液态电解质的使用,传统电池往往具有能量密度低、不稳定、易燃等不足[1]。全固态电池被认为是21世纪极具前景的电化学储能设备。在全固态电池中,有机液体电解质和多孔聚合物隔板被固态离子导体所替代,有望实现更高的安全性和能量密度,从而解决液态电解质电池面临的问题[2]。实用固态电解质有多方面的性能要求,如高离子电导率(一般认为室温下离子电导率应达到1 mS·cm-1以上)、高电化学稳定性、高热稳定性以及电极-电解质界面的化学稳定性等。然而,与离子电导率普遍在10-2~10 S·cm-1间的液体电解质相比,固态电解质的离子电导率往往要低几个数量级,能满足实用需求的固态电解质仍然有限。因此,开发高性能固态电解质材料对未来固态电池的发展具有重要意义,也是当前研究的一大热点与难点。
近年来,硼氢化物因可实现较高的离子电导率、宽电化学窗口以及良好的热/化学稳定性,作为潜在的固态电解质材料而受到关注[3]。硼氢化物的研究发展过程最早可追溯至上世纪初,Stock制备、分离出了一系列硼烷化合物[4],后续研究逐步发展,包括本课题组在内的国内多个课题组对等众多硼氢化物开始进行开发及应用[5-10],并发展出了庞大的材料体系。近年研究表明,许多硼氢化物均具有固态电解质应用潜力,包括早期研究的金属硼氢化物(MBH4)及后续研究开发的闭式(closo-)、巢式(nido-)和网式(arachno-)等结构类型的硼氢化物(图1a)。在众多硼氢化物中,closo-以其独特的闭式笼型结构和良好的稳定性[11-12],具有很好的应用前景。其中,十氢十硼酸盐是备受关注、最具代表性的一类材料。B10H102-具有三角面多面体的立体芳香性结构,分子骨架由2个顶点硼原子和8个赤道硼原子组成的双加帽四方反棱柱结构构成(图1b)。自1959年被发现至今,B10H102-在合成、结构与应用方面都取得了显著的研究进展,特别是在固态电解质应用方面近期得到迅速发展。相比目前常见的氧化物基和硫化物基固体电解质,十氢十硼酸盐固态电解质在特定温度下可发生有序-无序相变,得到的高温相具有较好的离子电导性能;同时其立体芳香性也使其具有良好的热稳定性和电化学稳定性,因此,该类材料被认为是极具前景的固体电解质材料。但是,由于纯十氢十硼酸盐只在较高的相变温度以上才具备高电导率,限制了其在常规环境中的应用,且该材料的电化学窗口局限在3 V左右,不利于其作为高能量密度电池的发展。针对这些问题,研究人员进一步提出了多种改性措施以提高其电化学性能,如卤化、C原子取代、机械球磨、复合阴离子混合、多聚等手段,极大地提升了该类材料的性能,拓宽了其应用范围。
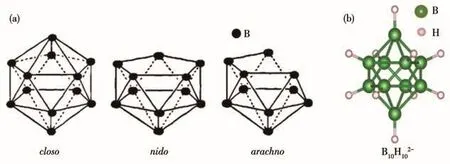
图1 (a)多面体硼氢化物的闭式、巢式、网式结构[12];(b)B10H102-的球棍模型Fig.1 (a)Structures of closo-,nido-,and arachno-type polyhedral hydroborate[12];(b)Ball-and-stick model of BH2-1010
研究指出,理想的高性能固态硼氢化物电解质需要解决以下4个问题[13]:(1)室温下的低离子传导率;(2)在电解质/阳极界面易形成有害相和枝晶;(3)窄电化学窗口;(4)电解质的机械稳定性差而导致的能量密度低等问题。随着B10H102-固态电解质研究的不断深入,上述问题已经得到了一定程度的改善或解决。本文综述了B10H102-在合成及固体电解质应用方面的研究进展,并对B10H102-固体电解质的发展方向进行了展望。
1 B10H102-的合成
B10H102-的主要发展历程如图2所示。1959年,Hawthorne等[14]利用双乙腈十硼烷与混有乙胺、二乙胺、正丙胺和二正丙胺的苯溶液反应,得到了具有N—H和C=N键的B10H12L2混合物。同年,Lipscomb等[15]首次在B10H12L2混合物中发现了B10H102-的存在,结合红外光谱和核磁共振分析提出了B10H102-的可能结构。1962年,Pitochelli等[16]提出了B10H102-的生成机理,认为在B10H12X2(X为配体)与碱的反应过程中,硼原子发生重排,分子中的2个配体和2个桥氢原子会在反应过程中脱除从而生成B10H102-。同年,Dobrott等[17]通过合成Cu2B10H10,利用X射线衍射正式确定了B10H102-的双加帽四方反棱柱结构,指出B10H102-是由B组成的多个三角形面构成的规则闭合多面体,顶点数目等于硼原子数目,每个B原子再通过一个共价键连接一个外多面体H原子。1964年,Muetterties等[18]针对 B10H102-阴离子的盐和酸的性质进行了研究,总结了B10H102-的各种制备及分离提纯方法。
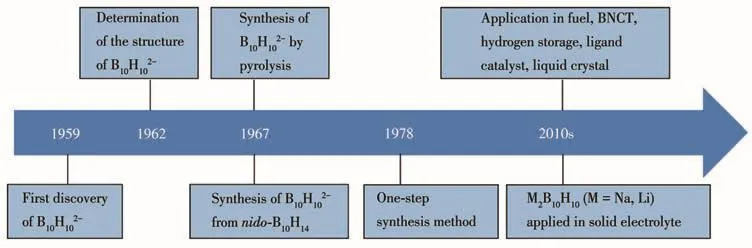
图2 B10H102-的发展历程Fig.2 Development process of BH2-1010
1967年B10H102-的2种主要合成方法形成:通过十硼烷合成B10H102-和通过硼氢化物热解制备B10H102-(表 1)。Hawthorne 等[19]通过 nido-B10H14和三乙胺(Et3N)在煮沸的二甲苯中反应,首次合成了无色晶状固体(Et3NH)2B10H10,产率高达93%。但是由于原料制备困难,成本高,导致使用该方法制备B10H102-的经济效益不高。在此基础上,Makhlouf等[20]提出分别以 Et4NBH4、Et4NB3H8和 Me4NB3H8为原料,在185℃下进行热解反应,实现了高产率制备B10H102-(94% 以上)。1977年,Guillevic等[21]探究了利用热解反应原料Et4NBH4制备B10H102-的合成方法,此后该热解制备方法成为B10H102-的主要合成手段。1978年,张国敏等[22]对热解法制备(Et4N)2B10H10的实验条件进行探讨和改进,发现四乙基氯化铵和硼氢化钾在187℃和有微量水存在的条件下反应16 h,能够实现一步高产率合成B10H102-。1986年,Colombier等[23]进一步研究了热解法制备过程中Et4NBH4的热解过程及各类产物的形成条件,最终在无溶剂、4 000 Pa条件下,将原料热解反应24 h后得到了最高产率。同时,Mongeot等[24]进一步补充明确了热解法制备(Et4N)2B10H10、(Et4N)2B12H12的分离和提纯方法。经过多年研究,已经发展出了成熟的十硼烷合成法和硼氢基盐热解制备B10H102-化合物的方法,可以实现实验室小批量制备,表1总结了B10H102-的主要合成方法。基于已有研究报道及作者课题组的材料制备经验,需要指出的是,在Et4NBH4热解制备初级B10H102-的合成方法中,热解反应受到原料纯度、加热方式、加热历程、环境气氛,甚至反应器形状及材质等多方面因素的影响,不同文献报道的反应转化率也具有较大差异。此外,Et4NBH4热解过程中,涉及有毒、自燃中间体的生成,有严格的操作要求,安全生产问题也不容忽视。再者,现有方法制备成本均较高。因此,仍需探寻更绿色、安全、稳定高效的低成本制备方法。随着B10H102-化合物原料制备问题的解决,21世纪开始,十氢十硼酸盐作为一种多功能材料,在高能燃料[25]、BNCT(boron neutron capture therapy)癌 症 治疗[26]、储氢[27]、配体催化剂[28]、液晶材料[29]等多方面的应用得到了深入研究。
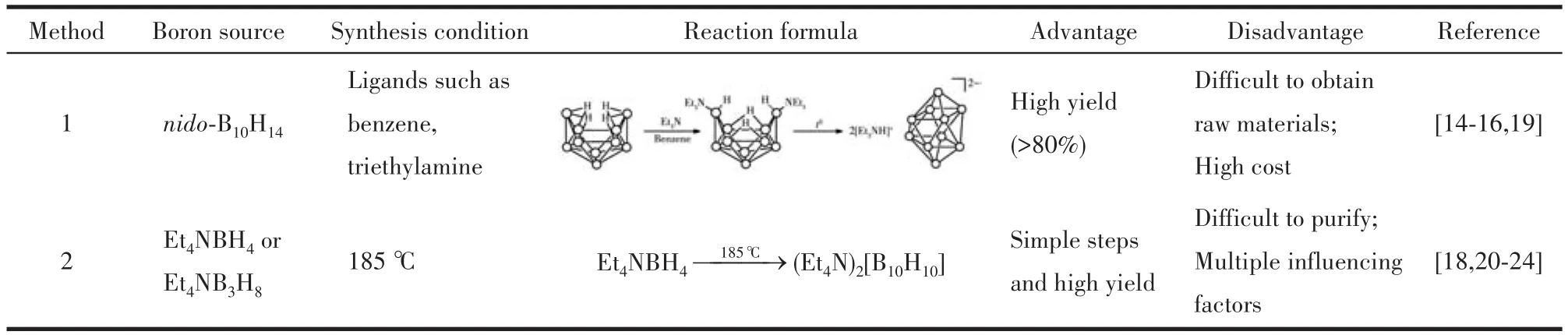
表1 B10H102-的主要合成方法Table 1 Main synthetic methods of BH2-1010
2 M2B10H10(M=Na、Li)固 体 电 解 质研究
硼氢基材料,尤其是具有高稳定性的闭笼型硼氢化物,由于具有优异的化学以及电化学性能,在新型固体电解质中的应用研究引起了人们的广泛关注。其中closo-B10H102-作为大尺寸多面体硼笼阴离子,其准球形阴离子亚晶格可以为阳离子提供宽敞、空位丰富的间隙网络和扩散通道,其纯物质在特定的相变温度下具有可与液体电解质相媲美的电导率。2014年,Udovic等[30]就开始对Na2B10H10的热力学行为与电化学性能进行研究,发现Na2B10H10在加热冷却循环过程中发生了可逆的相转变,如图3a中差示扫描量热法(DSC)曲线所示。当温度达到约380 K时,B10H102-阴离子会发生重新排布并最终形成fcc立方无序相,如图3b所示[31]。相变过程中,Na+在硼笼阴离子内被激发后开始占据八面体位点(Oh位点),具有很高的移动性。相应地,离子电导率从室温下的10-5S·cm-1升至高温下的10-2S·cm-1(图3c)。Na2B10H10在低于Na2B12H12的相变温度下,表现出极高的离子电导率,比其它传统固态钠基复合氢化物材料高1个数量级以上。这些结果证实了NaBH作为固态电解质的应用潜力,使得BH2-210101010在固态电解质领域的研究受到了关注。随后的研究发现Li2B10H10在640 K附近同样经历了类似的有序-无序相变过程(图3d),其晶体结构如图3e所示,呈现出非典型的六方对称性[32]。尽管相变显著提高了其锂离子电导率,然而由于相变温度过高,在固态电解质应用中的实用性仍有待探讨。
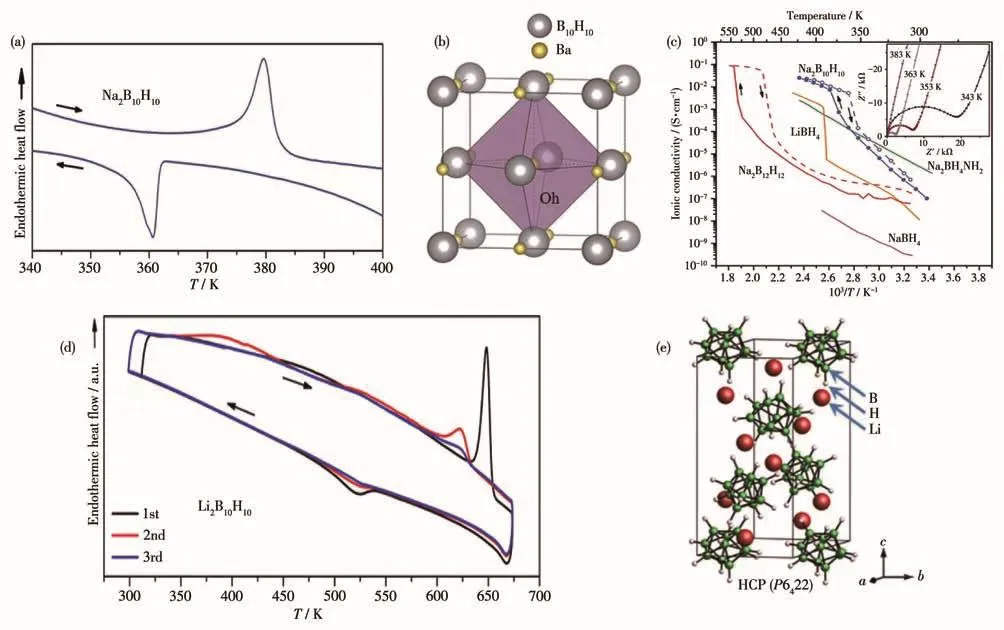
图3 (a)Na2B10H10的DSC曲线(ΔT/Δt=2 K·min-1)[30];(b)Na2B10H10的高温无序相结构[31];(c)Na2B10H10等硼氢化物的离子电导率(插图:加热过程中在不同温度下测量的Na2B10H10的阻抗图)[30];(d)Li2B10H10的DSC曲线(ΔT/Δt=5 K·min-1)[28];(e)Li2B10H10的晶体结构[32]Fig.3 (a)DSC curves(ΔT/Δt=2 K·min-1)for NaBH[30];(b)Structure of high temperature disordered phase of NaBH[31];2101021010(c)Ionic conductivities of Na2B10H10(Inset:Complex impedance plots of Na2B10H10 measured at various temperatures during heating)[30];(d)DSC curves for LiBH(ΔT/Δt=5 K·min-1)[28];(e)Crystal structure of LiBH[32]2101021010
研究表明,高温相转变后B10H102-化合物的离子电导率十分出色,但由于纯物质只在较高的相变温度以上才具有高电导率,限制了其进一步应用。2017年,Lu等[33]测试了金属硼氢化物作为固态电解质的相稳定性、电化学稳定性和机械性能,证明金属硼氢化物是锂、钠固态电池中固态电解质的潜在候选材料;同时研究指出在实际应用前还需通过降低超离子相变温度或提高低温相的阳离子扩散率以提高材料在室温下的离子电导率。Varley等[34]使用从头算分子动力学模拟(AIMD)研究了锂、钠硼氢化物的离子导电性对材料组成、结构的依赖性,指出碳原子取代、复合阴离子混合等方法可以引入内在的无序性,从而降低B10H102-的相转变温度。迄今为止,为提高B10H102-电解质的电化学性能,提出了降低材料相转变温度和提高固有阳离子扩散性这2种主要途径,并发展出以下5种改性措施:卤素取代(卤原子取代H原子)、碳硼烷(C原子取代B原子)、机械球磨、复合阴离子和二聚化。
2.1 卤素取代
卤素取代是指用卤原子(X=F、Cl、Br、I)取代B10H102-中与各个B原子顶点连接的端氢。通过卤化改变主体阴离子大小,可以增加其热稳定性和化学稳定性,同时改变电荷密度和电荷离域情况,从而改变材料的电化学性能。通过卤原子部分取代多面体硼氢化物中的H可以降低其相转变温度[35]。然而完全卤代则往往会导致相变温度的升高,将高离子电导率限制在非常高的温度下[36]。但这一特点也显示了B10X102-(X=Cl、Br、I)在高温电解质方面的应用前景。
针对B10H102-的卤化反应,1964年Knoth等[37]首次提出了B10H10-xClx2-、B10H10-xBrx2-、B10H10-xIx2-等众多卤代产物的合成途径和反应条件。1977年,Buhrens等[38]提出通过高压离子电泳可以对卤化混合物B10H10-nXn2-(X=Cl、Br、I;n=1~9)进行分离纯化。随后 ,Preetz 等[39]、Ivanov 等[40]、Drozdova 等[41]、Zhizhin等[42]、Retivov等[43]、Holub等[44]、Rzeszotarska等[45]和陈学年等[46]等研究组对各种卤代B10H102-的种类和制备方法又进行了详细补充。
早在20世纪80年代,几个研究组就研究了B10Cl102-电解质的应用。1979年,Dey等[47]将Li2B10Cl10作为液态电解质用于Li/SOCl2液态电池中,得到了较好的性能,自此卤代硼氢化物开始应用于液体电池中。1980年,Johnson等[48]又发现卤代硼氢化物可溶于混合醚类试剂中形成高浓度稳定溶液和非水电解质;测试表明该电解质对锂钛二硫化物Li-TiS2电池表现出良好的化学稳定性。次年,Johnson小组[49]又报告了高温下进行的Li-TiS2电池的测试情况,发现B10Cl102-对温度变化和锂阳极也具有特殊的稳定性。1982年,该研究组的进一步研究[50]表明Li2B10Cl10具有优异的化学稳定性和良好的电解液性质,是锂电池应用中极具潜力的候选材料。这些研究打开了卤代硼氢化物在电池领域应用的大门。2017年,Hansen等[36]将全卤代硼氢化物钠盐首次应用于固态电解质中,发现随着阴离子尺寸和质量的增加,转变温度明显升高(H<Cl<Br<I),证明了完全卤代反而会增加材料的相转变温度,但同时也展示了卤化硼氢化物在高温离子导体方面的发展前景。2021年,陈学年研究组[46]合成了M2(B10H10-nIn)(M=Li、Na;n=1、2、10),如图4所示,发现由于B10H102-阴离子对亲电试剂具有很高的活性,因此可以通过微波辐射等方法发生亲电取代来完成碘化,并且化合物的热分解温度随碘原子取代数的增加而增高。Li2B10H10-nIn的离子电导率高于Li2B10H10并且Li2B10H9-1-I在130℃时电导率达2.43×10-3S·cm-1,而 Na2B10H10-nIn的 离 子 电 导 率 要 比Na2B10H10低。基于ESP(electrostatic potential)的理论计算表明,Na2B10H10-nIn的离子电导率主要受阴阳离子配位强度的影响,Li2B10H10-nIn的离子电导率则主要受非晶结构等其它因素的影响。
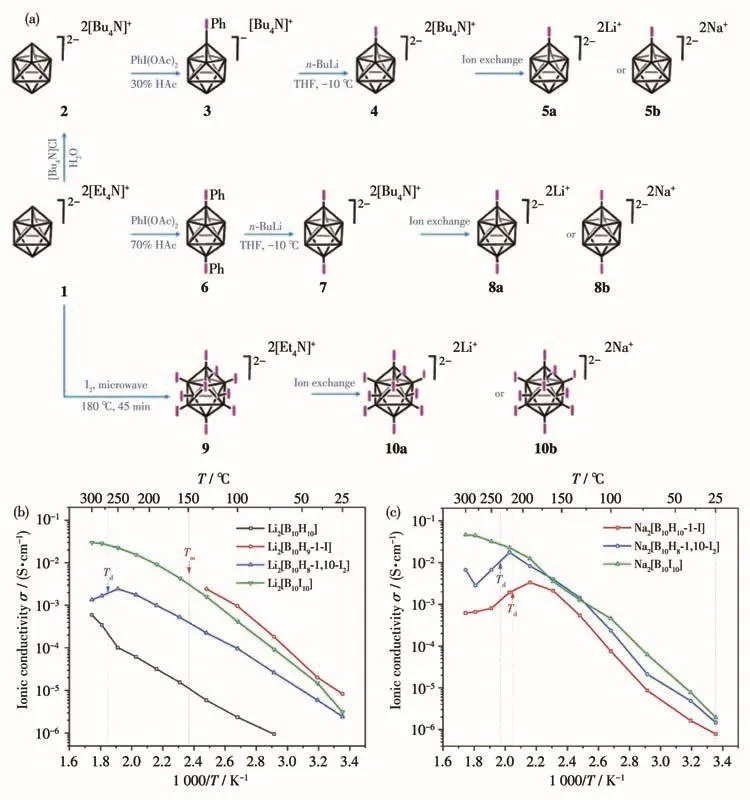
图4 (a)[B10H9-1-I]2-、[B10H8-1,10-I2]2-和[B10I10]2-的锂盐和钠盐合成方法;(b)Li2B10H10-nIn(n=0、2、10)和Li2B10H9-1-I的离子电导率与温度的关系;(c)Na2B10H10-nIn(n=1、2、10)的离子电导率与温度的关系[46]Fig.4 (a)Synthesis of lithium and sodium salts of[B10H9-1-I]2-,[B10H8-1,10-I2]2-,and[B10I10]2-anions;(b)Ion conductivity of Li2B10H10-nIn(n=0,2,10)and Li2B10H9-1-I as a function of temperature;(c)Ion conductivity of Na2B10H10-nIn(n=1,2,10)as a function of temperature[46]
2.2 碳硼烷
除硼笼端氢原子被取代外,B10H102-阴离子的骨架硼原子也可以被碳原子取代。1967年,Knoth等[51]首次报道了1-CB9H10-,并提出具体合成步骤。1971年,Knoth等又报道了制备closo-碳硼烷阴离子的新途径[52],表明通过CsCB10H13的热分解,可产生CB9H10-和CB11H12-(产率 15%~40%)。但实际上在closo-CB9H10-被提出后的几十年间,针对这一化合物的研究并不多。1992年,Nestor等[53]报道了一种新的closo-1-CB9H10-的制备方法,产率高达68%。到2000年,Brellochs等[54]提出了一种更简便的制备方法,成为了closo-CB9H10-研究的转折点。2009年,Ringstrand等[55]又对Brellochs的方法进行优化,指出3步即可合成CsCB9H10,过程如图5a所示。2021年,陈学年等[56]对Brellochs的方法做出了进一步改进,简化了合成步骤,将反应产率提高至80%。通过碳原子取代B10H102-顶点上的硼原子所得到的金属碳硼烷CB9H10-,其大小和几何形状与B10H102-非常相似(图 5b)。对于 CB9H10-来说,其优异的阳离子迁移性能可能主要来源于以下几个因素:首先,CBH9-10带单电荷,周围相互作用的阳离子较少,具有较低的阴离子重新取向势垒和更多定向移动的阴离子[57];其次,相对于B10H102-,CB9H10-所形成的盐具有更低的阳离子/阴离子比例,减半的(一价)CB9H10-阴离子电荷可能会导致阳离子通过阴离子亚晶格跃迁的势垒降低,并使阳离子空位增加,阳离子位阻减少[46,50],每个结构单元增加的阳离子空位则有利于降低阳离子扩散的活化能。同时,由于碳硼烷CB9H10-的晶格常数相对更大,较宽的体积也能为阳离子的传输提供更多的空间。硼簇上碳原子的存在也破坏了硼簇阴离子的内部对称性,可能会通过增加系统内在的无序水平从而降低相变温度,将高离子电导率稳定在较低的温度。CB9H10-围绕其C4对称轴旋转,有助于提高旋转迁移率从而增强晶体结构无序性,进一步帮助阳离子迁移[58]。这些特点都可能使CB9H10-表现出较低的相转变温度和活化能以及更高的离子电导率[59-60]。2021年,陈学年等[61]对取代CB9H10-阴离子的钠和锂盐的离子导电性进行了系统性研究,结果表明其离子电导率主要受电子密度各向异性的影响。
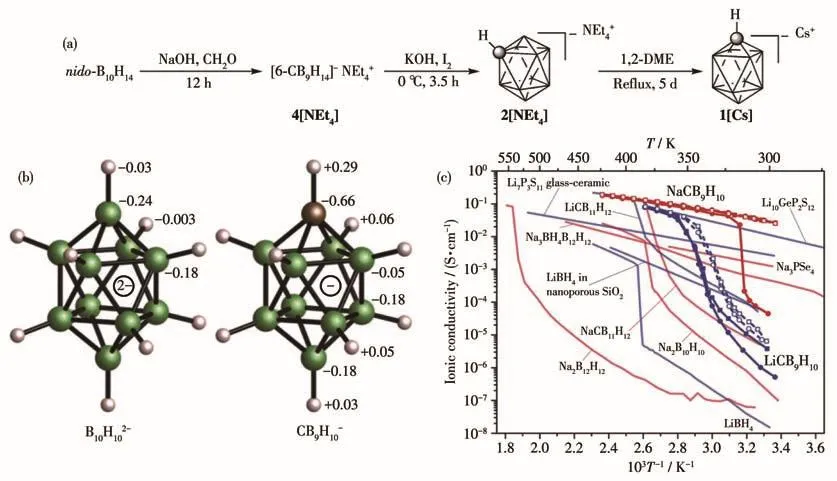
图5 (a)(closo-1-CB9H10)-Cs+的三步制备过程[55];(b)B10H102-和CB9H10-的相关几何结构,由第一性原理计算确定典型原子的Mulliken电荷[60];(c)LiCB9H10和NaCB9H10及其它已知多晶超离子导体的离子电导率与温度的关系[60]Fig.5 (a)Three-step preparation process of parent derivative(closo-1-CBH)-Cs+[55];(b)Related geometries of the BH2-9101010 and CB9H10-anions,Mulliken charges determined by first-principles calculations are indicated for the structurally distinct atoms of the isolated anions[60];(c)Ionic conductivities of LiCB9H10 and NaCB9H10 and other existing polycrystalline superionic conductors as functions of temperature[60]
2016 年,Tang等[60]对 MCB9H10(M=Li、Na)进行了研究,发现在接近室温的温度下,LiCB9H10和NaCB9H10的电导率高达 0.03 S·cm-1(354、297 K)(图5c),是室温条件下导电性能最佳的钠基超离子导体材料之一,他们还解释了CB9H10-相对B10H102-离子电导率更高的原因。同年,Wu等[62]结合第一性原理计算和中子振动光谱研究了NaCB9H10的结构信息,进一步探讨了其有序-无序相转变过程。2017年,Sethio等[63]报道了对CB9H10-振动光谱性质的密度泛函理论研究,探讨了B-C原子化学取代引起的闭合硼笼对称性的破坏。之后Varley等[34]、Soloninin等[64]和Dimitrievska等[57]又利用分子动力学模拟、核磁共振与准弹性中子散射等进一步探究了碳掺杂硼笼与碱金属结合后形成高性能固态电解质材料MCB9H10的机制,对金属碳硼烷的相变和电导性能提升的原理做出了更全面的解释。研究表明阳离子/阴离子比例变低、阴离子取向变化、碳原子取代、晶格常数增大以及对阳离子库仑吸附力较弱等都对碳硼烷的相变和电导性能有一定正面影响。
2.3 机械球磨
球磨法可以借助机械能诱发化学反应或诱导材料组织、结构和性能的变化,常用于制备新材料或对已有材料进行改性。早在2012年,球磨法就被用于制备Na3PS4等Na基电解质材料[65]。球磨法能在晶体结构中引入空位、位错、堆垛层错、晶界等晶体缺陷,可能导致阳离子迁移率提高。2016年,Lu等[32]对Na2B10H10的超离子电导结构原理和扩散机制的研究表明,阳离子的快速传输与阴离子重新定向密切相关,而空位的引入能有效提高Na+的扩散率。球磨过程中,研磨导致的晶粒尺寸减小和无序效应使得固态电解质的高温超离子导电相能稳定在室温附近[66]。同时,由于纳米化材料的比表面积增大,电解质与电极的接触面积增大,也会提高电导性能。因此,球磨法在制备固态电解质材料中的应用也受到了广泛关注。2016年,Tang等[66]提出通过机械研磨减小微晶尺寸并引入纳米缺陷(如空位、间隙、位错等)进而使硼氢化物的超离子相稳定在室温或更低的温度。他们以1∶1的物质的量之比对Na2B10H10和Na2CO3进行28 h球磨混合,产物的X射线衍射(XRD)图分析表明82%的Na2B10H10在室温下处于无序fcc相,原始材料经过球磨后在室温下的粒子电导率显著提高。诸如球磨等晶体尺寸减小工艺为进一步探索基于硼氢化物的高性能化合物提供了有利条件。
2.4 复合阴离子
不同阴离子间的复合可以增加B10H102-晶体中的无序结构,形成具有独特晶体结构的新相,增加开放、连续的阳离子扩散通道,有助于实现较低温度下(室温)的高离子电导率。其次,阴离子混合还能抑制阴离子的优选取向,导致其具有较低的阴离子旋转势垒,提高阴离子定向移动,从而进一步提高离子电导率。同时,常用的材料复合方法(如球磨等)能在晶体结构中引入缺陷(空位、晶界等),这些缺陷可以进一步抑制有序相的形成,导致阳离子迁移率提高。经过阴离子混合的硼氢化物以其优异的电化学性能成为了现今的研究热点。
2017年,Torben等[67]对Ag2B10H10进行了研究,发现混入AgI形成新化合物Ag2+xIxB10H10后,室温下离子电导率提高了2个数量级以上(图6a),达到3.2 mS·cm-1,证明阴离子混合可以调整离子导体的晶体结构,对提高电导率具有重要影响。同年,Yoshida等[68]研究了不同比例Na2B10H10-Na2B12H12球磨混合物的结构特征和电化学性能(图6b、6c),发现两者以物质的量之比3∶1混合所得产物的电导率相对原材料也有显著提升,303 K下最高电导率为10-3.5S·cm-1;其XRD图证明了阴离子混合体系中类似Na2B12H12的高温无序相在室温也能稳定,其混合物的比例决定了高导电性bcc相的稳定性,从而影响了离子电导性能。而Duchene等[69]在一定的反应条件下通过球磨混合制备了化合物Na4(B12H12)(B10H10)(也有文献写作Na2(B12H12)0.5(B10H10)0.5),证明两者可以形成稳定单一的混合阴离子相,结构如图6d所示。该研究小组发现Na4(B12H12)(B10H10)化合物在20℃下的离子电导率约为10-3S·cm-1,并且具有3 V的电化学稳定窗口,该固体电解质还能与金属钠良好相容,证明了将材料阴离子复合改性的可行性和有效性。2019年,Duchene研究小组[70]又阐述了Na4(B12H12)(B10H10)的离子传导机理,表明特殊的离子动力学是其高离子电导率的原因。同年,Toyama等[71]报告了以不同比例的LiBH4和B10H14为原料合成的闭式复合硼氢化物的锂离子电导特性,其中闭式复合氢化物包括B10H102-、B11H112-、B12H122-等复合阴离子。结果表明,随着原料中LiBH4含量的增加,产物的离子电导率也增大,该研究为在分子水平上控制复杂阴离子组成和离子电导率性能提升提供了有益的指导。
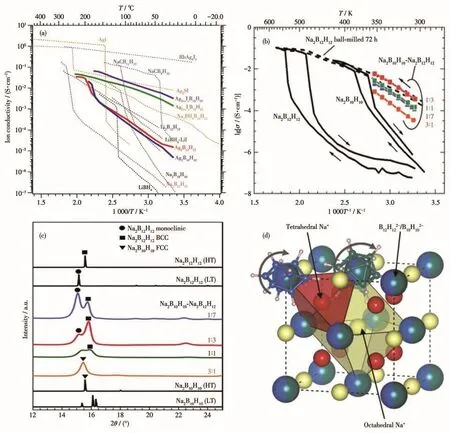
图6 (a)Ag2+xIxB10H10及其它银化合物、硼氢化物的离子电导率[67];(b)不同物质的量之比的Na2B10H10-Na2B12H12二元复合氢化物(橙色3∶1、绿色1∶1、红色1∶3和蓝色1∶7)球磨5 h的Na+电导率[69];(c)不同物质的量之比的Na2B12H12/Na2B10H10的XRD图[68];(d)基于Na2B10H10高温相的Na2(B12H12)0.5(B10H10)0.5的简化结构,Na+位点以不同颜色标识以区分四面体和八面体配位,B12H12 2-和B10H10 2-无序排布在fcc框架中[69]Fig.6 (a)Ion conductivities of Ag2+xIxB10H10 and other silver compounds and metal boranes[67];(b)Sodium-ionic conductivities for Na2B12H12/Na2B10H10 pseudo binary complex hydride with various molar ratios ball-milled for 5 h(Orange 3∶1,Green 1∶1,Red 1∶3,and Blue 1∶7)[68];(c)XRD patterns of Na2B10H10-Na2B12H12 pseudo-binary complex hydride with various molar ratios prepared by mechanical ball-milling for 5 h[68];(d)Simplified structure of Na2(B12H12)0.5(B10H10)0.5based on the high-temperature phase of Na2B10H10(Partially occupied Na+ions sites are shown in different colors to distinguish tetrahedral and octahedral coordination,B12H12 2-and B10H10 2-anions are randomly distributed in the fcc framework)[69]
2017年,Duchene研究组[72]将Na4(B12H12)(B10H10)应用于全固态3 V稳定电池Na|Na4(B12H12)(B10H10)|NaCrO2中,发现电池最高电压达到3.25 V,并可以维持稳定高效的电池循环,电池结构和循环性能如图7a、7b所示。经过2个月250次循环,该全固态电池的容量保持率达85%,且其库仑效率大于99.5%。该研究组通过简单混合法和浸渍法2种方法制备阴极化合物,并对比其微观形貌与电池循环性能,指出混合阴极在电池中观察到的容量衰减不是由于电解质分解,而是源于电极与电解质之间的电极-电解质接触损耗。浸渍阴极的Na4(B12H12)(B10H10)和NaCrO2良好的接触可使阴极粒子在充放电时更容易获得钠离子,有利于其电导性能的提升[72]。随后,基于闭式硼笼全固态电池的研究重点开始从电导率性能的提升及室温下超离子相的稳定转向电解质与电极之间的界面优化。2020年,Duchene等[73]提出了获得合金硼氢化物固体电解质渗透电极的新方法(流程图如图7c所示):将浆料浇铸多孔电极浸入含有等物质的量的Na2B10H10和Na2B12H12的均质异丙醇溶液中,溶液会渗透到电极的连续多孔网络中,从而使得高导电性的Na4(B12H12)(B10H10)在整个电极的多孔结构中结晶。该过程有望应用于电池生产线中代替电解质的填充步骤,将有利于固态电池的大规模生产。2019年,Gigante等[74]提出了一种温和、无毒、低成本的溶液五步合成法来制备高纯度的 Na4(B12H12)(B10H10)(室温下 σ≈1 mS·cm-1),方法流程如图7d所示。该方法相比球磨法能更高产量地合成高纯度电解质,所得产物的电化学性能比球磨产物更加出色,并有效解决了电极与电解质间的接触和高成本等问题。
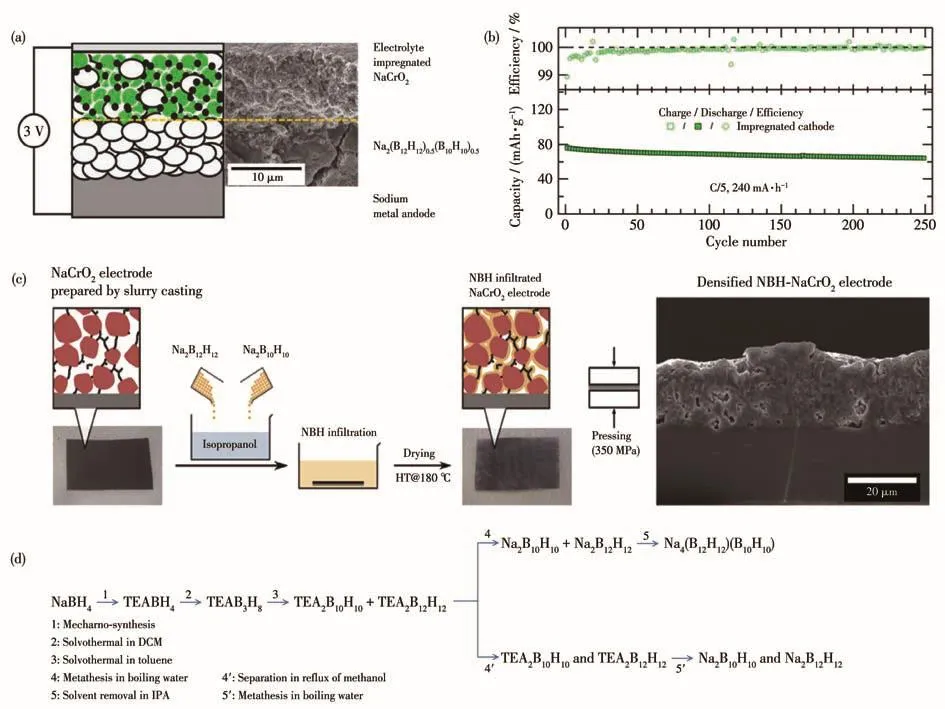
图7 (a)Na|Na2(B12H12)0.5(B10H10)0.5|NaCrO2电池装置的示意图和扫描电镜截面图[72];(b)使用浸渍阴极的Na|Na2(B12H12)0.5(B10H10)0.5|NaCrO2电池的长期循环图[72];(c)通过溶液处理制造的渗透有Na4(B12H12)(B10H10)固体电解质的NaCrO2电极示意图以及通过浆料浇铸制备的电极照片及渗透前后的横截面微观结构图[73];(d)从NaBH4到高导电电解质Na4(B12H12)(B10H10)和Na2B12H12、Na2B10H10的五步合成过程[74]Fig.7 (a)Device schematic and cross-section scanning electron microscope images of the cell Na|Na(BH)(BH)|NaCrO[72];212120.510100.52(b)Long-term cycling of a cell Na|Na2(B12H12)0.5(B10H10)0.5|NaCrO2 using the impregnated cathode[72];(c)Schematic diagram illustrating the fabrication of NaCrO2 electrodes infiltrated with the Na4(B12H12)(B10H10)solid electrolyte by solution processing and photographs of the electrodes prepared by slurry casting and their corresponding schematic cross-sectional microstructures before and after infiltration[73];(d)Summary of the five-step process starting from NaBH4 to the highly conductive electrolyte Na4(B12H12)(B10H10)and to Na2B12H12 and Na2B10H10 separately[74]
此外,阴离子混合也被广泛应用于碳硼烷基固态电解质材料的改性。2016年,Tang等[75]提出了不借助机械球磨合成混合多面体阴离子合金的新方法,将各纯组分在水中溶解后干燥脱水形成M2(CB9H10)(CB11H12)(M=Li、Na)。相对于原料LiCB9H10和LiCB11H12,在室温附近Na2(CB9H10)(CB11H12)的离子电导率明显提高,300 K时可达0.07 S·cm-1,这种无序固溶的Na+导体的导电性高于之前任何已知的Na+或Li+导体。2019年,Kim等[76]利用球磨法将一定比例的LiCB9H10和LiCB11H12混合制备了0.7Li(CB9H10)-0.3Li(CB11H12),其电导率在室温下达到6.7×10-3S·cm-1,应用于全固态锂电池中表现出良好的电化学性能。2020年,Kim等[77]又通过球磨制备了(1-x)Li(CB9H10)-xLi(CB11H12)(0.1≤x≤0.9),并研究了不同x下的材料结构、Li+电导率等的变化,探讨了Li(CB9H10)-Li(CB11H12)准二元体系的固溶体与高温相形成之间的关系,以及作为全固态Li-TiS2电池的固体电解质的电化学性能,该研究为复杂硼氢化物超离子导体的设计策略以及全固态电池的开发提供了新的思路。
2.5 二聚化
最近,本研究组[78]提出了一种针对B10H102-的新型改性方式,对B10H102-进行缩合制备二聚体Na2B20H18,并作为固态电解质应用于全固态电池中(图 8a)。结果表明(图 8b、8c),相对于 Na2B10H10,二聚体具有更高的室温离子电导率,且其电化学窗口高达5.1 V(Na+/Na),被认为是目前硼氢化物体系中电化学稳定性最高的材料之一。二聚化后联式硼笼化合物电化学性能的显著提升可能得益于更大的阴离子尺寸、趋于非晶相的结构及硼笼间不易断裂的连接键,后续本研究组还对Li2B20H18、Na4B20H18、Li4B20H18、Na3B24H23和 Li3B24H23等[79-80]联式硼笼化合物进行了研究,其都具有比单硼笼材料更加优异的电化学性能,为设计性能更佳的电解质提供了新的思路,扩大了新的材料体系,未来有望与高压电极协作实现高能量密度的全固态电池。
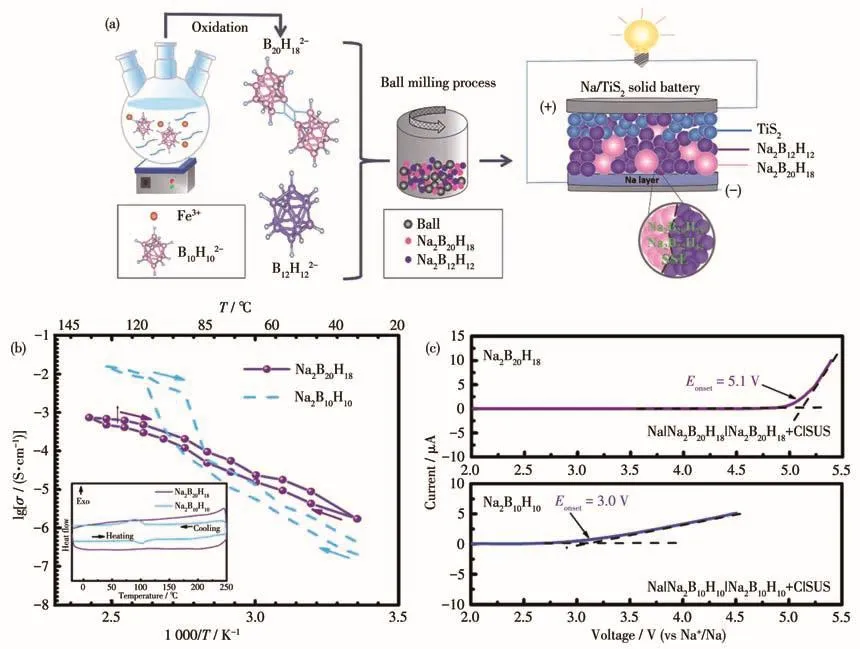
图8 (a)Na2B20H18基固体电解质的制备及全固态钠电池的组装示意图;(b)Na2B20H18和Na2B10H10的Arrhenius曲线,插图为DSC曲线(ΔT/Δt=5 K·min-1);(c)Na2B20H18和Na2B10H10的线性扫描曲线(扫速为10 mV·s-1)[78]Fig.8 (a)Schematic illustrations of the preparation of Na2B20H18-based solid electrolytes and the assembly of the all-solid-state sodium battery;(b)Arrhenius plots of Na2B20H18 and Na2B10H10,the inset shows the DSC curves of the samples(ΔT/Δt=5 K·min-1);(c)Linear sweep voltammograms of Na2B20H18 and Na2B10H10 at a scan rate of 10 mV·s-1[78]
3 总结与展望
目前,已经有大量研究开发了多种性能优异的固体电解质材料,主要包括氧化物[81-82]、硫化物[83]、卤化物[84]和聚合物固体电解质[85]。这些材料均具有独特的优点,但也有各自的局限性,比如氧化物固体电解质的制备温度过高,且其体积变化引起的裂纹形成和接触损失容易影响循环过程;硫化物固体电解质的氧化还原稳定性差,化学稳定性低,容易给电池带来安全隐患;卤化物固体电解质对湿气敏感,室温电导率较低;而聚合物固体电解质热工作范围有限,电化学稳定性窗口也比较窄[81-85]。十氢十硼酸化合物作为一类潜在的固体电解质候选材料,其制备方法较为简便,机械性能良好,近球形、大尺寸的阴离子结构使其在化学稳定性和热稳定性方面具有独特优势;其纯物质在高温下可向无序相转变,其高温下电化学性能在一定程度上能与液态电解质媲美。此外,发展的多种改性方法可有效提升其固态电解质特性。目前十氢十硼酸化合物的制备与固态电解质的应用研究均已取得了多方面进展,典型的几类十氢十硼酸化合物及其衍生物的制备方法和离子电导率总结于表2。
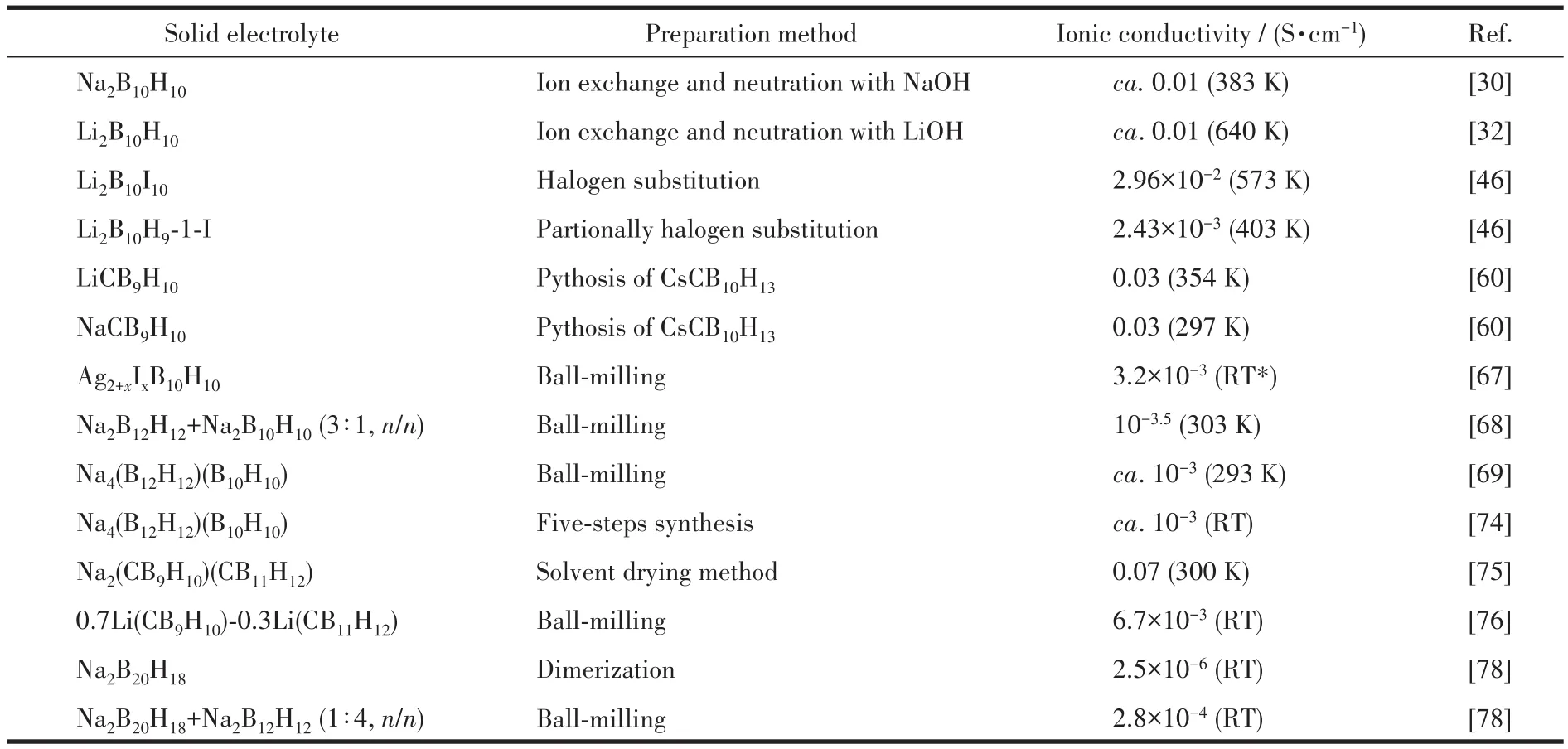
表2 M2B10H10及其衍生物类固态电解质制备方法及性能总结Table 2 Summary of preparation methods and properties of M2B10H10 and its derivative as solid electrolyte
然而,目前该材料在全固态电池中的应用仍面临着一些问题,作者认为B10H102-固态电解质未来的发展有以下几个趋势:
(1)B10H102-电解质材料合成方法的进一步改善:目前已有的B10H102-合成方法,大都存在制备过程复杂、成本较高等问题,若能通过绿色、廉价的简单合成手段批量合成B10H102-,则可降低硼氢基固态电池的制造成本,拓宽其应用前景;
(2)对电解质性能的进一步提升:实用固态电解质要兼顾离子电导率和电化学稳定性这两方面关键性能。目前固态电解质的性能提升还有较大的探索空间,针对纳米限域、与聚合物复合等改性手段的研究相对较少,还可将这些方法与已有手段综合应用,开发兼具高离子电导率和宽电化学窗口的电解质;
(3)对机理更深层次的认识:目前对B10H102-基固态电解质的制备与应用仍处于发展阶段,多方面机理如界面效应、离子传输扩散过程等并非完全清晰,通过对机理的进一步研究和探讨将有助于指导实验的方向和实施;
(4)对电解质和电极界面的进一步研究:对于固态电池来说,在电解质和电极之间获得具有良好相容、适当机械强度的界面仍是一项关键而富有挑战的任务[86-87]。如今有限的研究对电极与固体电解质之间的相容性进行了报道。Tian等[88]提供了一种结合了密度泛函理论计算和简单实验技术(例如X射线衍射、差示扫描量热法、热重分析和电化学测试)的方法,从理论上有效筛选众多电极/电解质对的相容性,指出了深入表征全固态电池的电解质电极兼容性的重要性。Asakura等[89]报告了一种基于线性扫描伏安法的方法,可以通过实验确定硼氢化物固态电解质的电化学氧化稳定性。B10H102-基固态电解质在实际应用时往往会遇到一些界面问题,对于电解质与正、负极材料间的相容性问题,需要通过对结构和组成的优化以促进稳定界面相的形成,比如采取加入缓冲层[90]、使金属阳极合金化[91]等措施;
(5)对实际应用过程中安全性问题的进一步研究和改善:B10H102-基固态电解质在性能上已经取得了很大的研究进展,但在实际应用中还面临着许多的问题,尤其是大规模生产和制造过程中的安全性问题。例如,如果电池暴露于极端高温下,硼氢基材料分解释放氢气,可能会引发火灾危险。因此评估这些化合物在空气中的热稳定性至关重要。然而,在电极材料存在下对硼氢化物进行热分解的研究遵循着不同的途径,尚待进一步实验研究确认。
总之,B10H102-作为一类典型的硼氢化物,其独特的结构和性质使其在电解质方面的应用具有独特优势。本文主要综述了B10H102-的合成方法以及其在固体电解质的应用进展,探讨了B10H102-基固态电解质发展面临的部分问题,并展望了B10H102-基固态电解质的未来发展方向。在众多研究人员的关注和共同努力下,对以B10H102-为代表的硼氢化物的研究将推动其在未来储能领域的进一步应用与创新。

