传统三组分体系液—液平衡相图的测绘实验体系的改进
李晓霞 张予辉 王一蕾 马淑杰
中国石油大学(华东)化学化工学院化学实验中心 山东青岛 266580
三组分液—液平衡相图的测绘实验是很典型的物理化学实验,国内各高校在进行该实验时选取的实验材料大多数是苯—乙醇—水[1-2]、苯—乙酸—水[3]或者甲苯—水—乙醇[4]、乙酸正丁酯—乙醇—水[5]等实验体系,这几个体系虽然很成熟,易操作,做出的相图也比较完美,但是,在实验过程中要大量用到苯或者甲苯,苯和甲苯的毒性都很大,挥发性也很强,有致癌性,实验过程中会对师生和周围的环境造成很大的危害;乙酸正丁酯容易损坏滴管等实验器材。为了从根本上解决这个问题,选取了环己烷—乙醇—水这个三组分液—液体系,相对于苯和甲苯,环己烷毒性小很多,只是对黏膜有刺激,不具有致癌性,对实验人员的危害会少很多。本实验体系已在本校本科生化学实验中应用,取得了较好的效果。
1 实验原理
等边三角形坐标图是一种化学实验数据处理使用的方法,而对于三组分体系用该种作图方法是非常适合的[6]。如图1所示等边三角形,设点A、B和C代表三种纯组分,若将A、B点连接成线,对于(A+B)二组分体系,该线上各点即可表示。按照同样的原理,将A、C连接成线,可表示(A+C)的二组分体系;将B、C连接成线,表示(B+C)的二组分体系。而A、B、C组成的三组分体系,在该等边三角形内的各点可用来表示。将等边三角形每条边按逆时针的原则,标度为0到1,等边三角形的每条边可以表示相应的组分含量坐标(如图1所示)。在等边三角形内,通过一点O分别做与三条边平行的线段,可得:
a+b+c=AB=BC=CA=1.0
(1)
a′+b′+c′=AB=BC=CA=1.0
(2)
因此,O点所代表三组分体系的组成可由a′、b′、c′线段的长度来表示,即ωA=a′,ωB=b′,ωC=c′。因此要确定O点所代表体系中B组分的百分质量分数,可利用过O点作平行线的方法得到D点(如图1),CD长度即为ωB,ωA、ωC也可利用该方法得到。对于三组分体系,如果两个组分的含量是已知的,则在图中找到两个组分的相应含量坐标值在对应的两条边上的点,分别通过两个点做顶点对应的平行线,交点就是具有该质量分数体系点。

图1 等边三角形坐标
典型三组分体系环己烷—乙醇—水,乙醇与环己烷、水都能完全互溶,但水和环己烷是不能互溶的。但是可以利用上述三角形坐标图方法表示该部分互溶的三组分体系。
当一定量的环己烷和水组成的一个体系,其组成为K,此体系分为两个液层,一层为纯环己烷,一层为纯水。如果将乙醇加入,体系的总组成(如图2),由BK线移动到点N。由于乙醇是溶于水层与环己烷层的,而且还会使得水和环己烷的互溶得以加强,这样两个三组分的液层就得到了。平衡共存的液相组成的系线,由连接a、b两点而得到,为共轭溶液。溶解度曲线(如图2中曲线),是将所有液—液平衡体系中共轭液相组成点连接成线得到的。两相共存区在曲线以下,其他为一相区。经过以上的操作,即可得到一对部分互溶的三组分体系液—液平衡相图。

图2 一对部分互溶液—液相图
由于乙醇能够与环己烷完全互溶,得到了清澈的二者的混合溶液。已知环己烷—乙醇溶液组成为Q(图2),将水滴入后,体系的组成会由QC移动到C。
清澈变为浑浊的现象发生在体系变为两相时,此时达到了溶解度曲线,该时刻溶解度曲线的点表示三组分体系组成。如果将水加入浓度各异的环己烷—乙醇溶液中,就得到了清澈变为浑浊时各体系组成,可由三角图中坐标的对应点得到溶解度曲线。
假设某三组分两相平衡体系H(图3所示),其共轭水层的组成G未知但配制浓度明确。在组成已知的前提下,将环己烷—乙醇溶液E滴入从H体系中分出且质量已知的共轭水层,得到的新体系总浓度会移向点E,进而浑浊,进入两相区,但到F点体系会变为清澈。共轭水层和环己烷—乙醇溶液的质量关系,如式(3)所示。
(3)
其中Wc为原共轭水层G的质量,WE为体系变清澈加入的环己烷—乙醇溶液质量(浓度为E)。

图3 系线的绘制
WG和WE,可以用天平称出,图3中的割线EFG从E点而来,EF与FG比值与式(3)对应,点G即能找到,就得到了共轭水层组成。连接G、H两点,该连线延长线与溶解度曲线相交至I点(见图3),就得到了共轭苯层的组成。温度的变化会影响溶解度,本实验应标出测量所得实验条件为室温25℃。
2 实验过程
基于上述原理,在实验中采用的仪器、化学药品如下:1ml吸量管1支,10ml酸式滴定管1支,5ml吸量管1支,50ml带盖锥形瓶3个,50ml梨形分液漏斗1个,电子天平1台,无水乙醇(AR),环己烷(AR),去离子水。实验步骤如下:
2.1 溶解度测定
(1)移液管移取2ml环己烷、1.5ml乙醇加入到干燥的锥形瓶中,混匀。用滴定管逐滴加入水,至溶液洽由清变浊时,记下所加水的体积。
(2)将1ml乙醇滴入溶液,逐步滴入水,直到溶液变清澈,记录此时水的使用体积。
(3)按照预先设定的体积数继续加入一定量的乙醇,用水滴至溶液刚由清变浊,依次记下所用水的体积。
2.2 系线的测定
(1)配置体积分数为50%环己烷—乙醇混合物:6ml环己烷、65ml乙醇置于干燥的锥形瓶中混匀。
(2)将3ml环己烷、3ml水及3ml乙醇依次加入干燥的分液漏斗中,先进行摇动,然后静置以便于分层,用已知重量的干燥锥形瓶接收放出的水层(约1ml),并利用天平测得质量。
(3)向步骤(2)的锥形瓶中滴加预先配置好的体积分数为50%乙醇—环己烷混合物,按照上述类似的方法,通过摇动后得到清澈溶液,然后测量质量大小。
(4)将以上得到的实验数据处理后在坐标纸上绘制相图。
3 数据记录与处理
实验过程相关数据记录如表1所示,溶解度曲线测绘实验结果记录,其中实验条件为室温20℃,大气压102.18kPa。查表知:ρ水=0.998g/cm-3,ρ乙醇=0.789g/cm-3,ρ环己烷=0.791g/cm-3,由m=ρV得m水、m乙醇、m环己烷,再求其相应的质量百分含量。表2为系线测绘结果记录表,其中WE∶WG=23.60。

表1 溶解度曲线测绘记录表
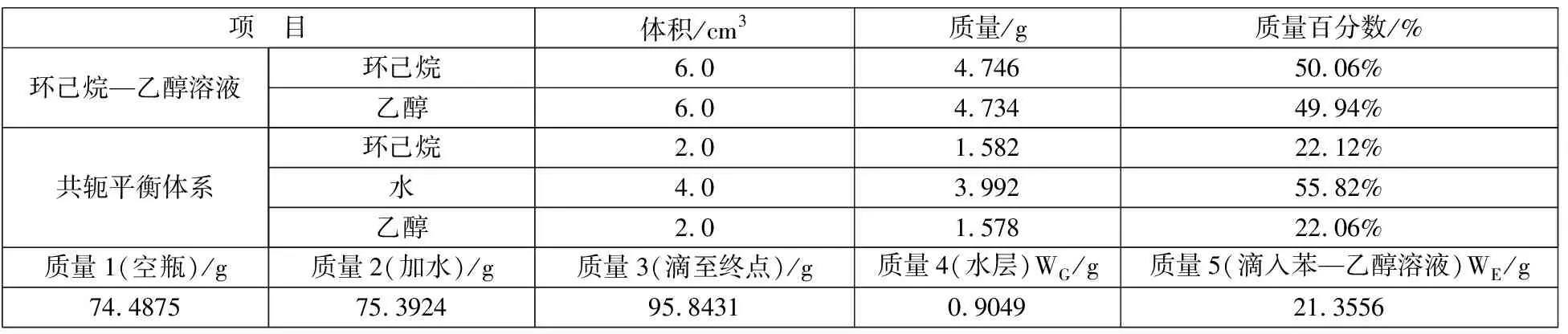
表2 系线测绘记录表
利用以上实验测量结果,可以进行相图的绘制。具体过程如下:
(1)当滴定各溶液完成时,由体积和实验温度下的密度可以换算得到质量,进而得到各溶液的质量分数。本实验采用坐标纸手工绘图,将结果在三角坐标纸上绘出,连接各点得到溶解度曲线如图4所示。
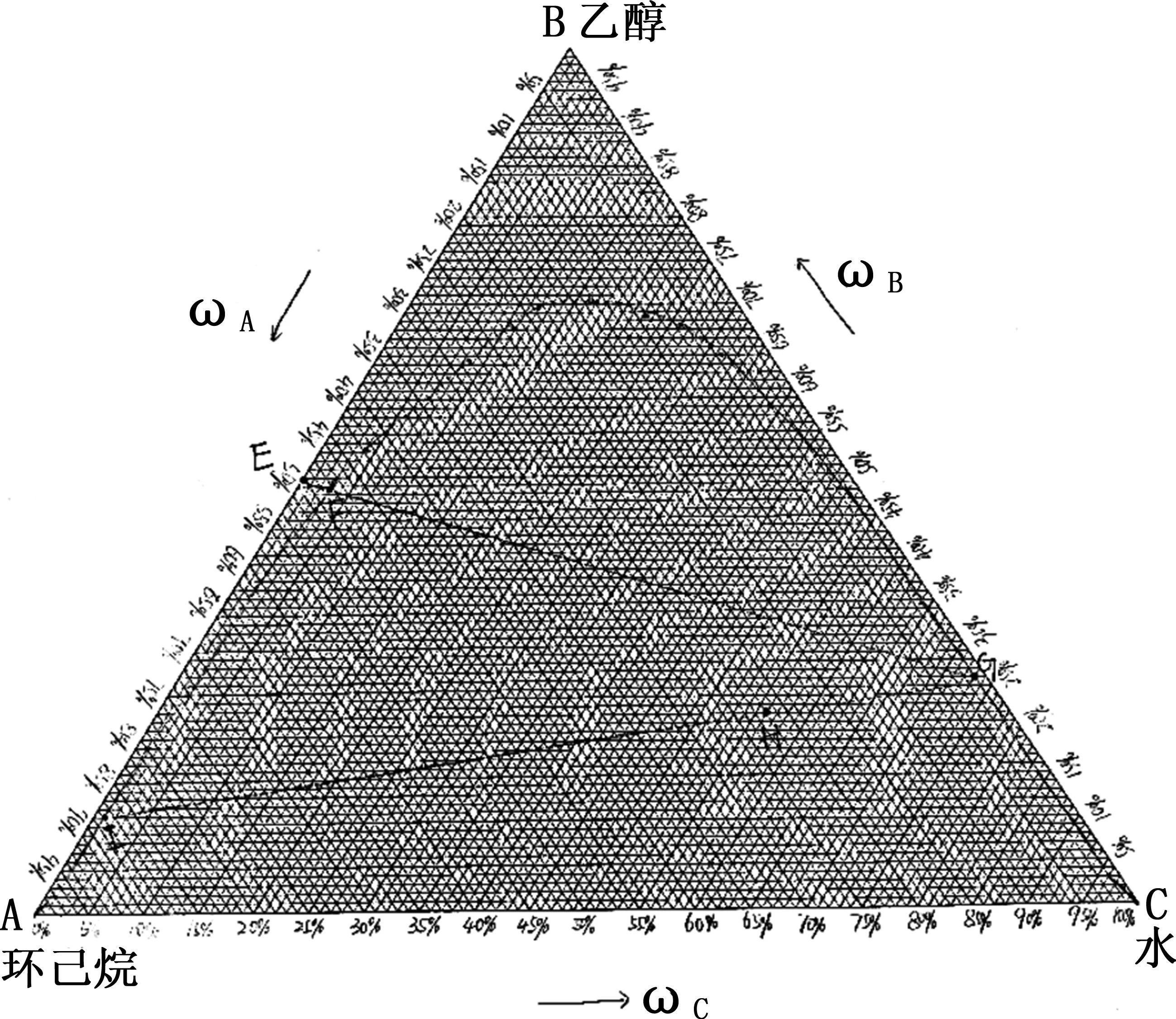
图4 环己烷—水—乙醇三组分系统液—液平衡相图
(2)在三角形坐标上找到点E,该点对应环己烷—乙醇溶液组成(体积分数50%),然后按照前述方法做割线EG。割曲线于F、G点,使FG/EF=WE∶WG。求得G点后,与共轭平衡体系总组成点H连接直线,并延长至与溶解度曲线交于I点,IG线即为所求连接线如图4所示。
结语
本实验采用了环保的环己烷—乙醇—水体系,其中环己烷的特点是低毒性,少量刺激性气味小,对实验操作人员非常友好。该实验不仅有利于实验污染的减少,更有利于保障实验过程中操作者和环境等方面的健康,同时在教学过程中适时向学生灌输绿色化学实验理念。通过实际实验效果,利用上述三组分体系进行的相图测绘,操作的可行性高,得到了较为理想的实验效果,可以作为典型案例进行推广。

