结肠镜下黏膜切除术治疗结肠息肉的疗效探讨
成金弟
(江苏省连云港市灌南县人民医院消化内科 灌南 222500)
结肠息肉是肠道良性病变,是指肠内黏膜表面凸起的病变结构,多呈多发性分布,主要通过结肠镜确诊与治疗[1]。结肠息肉根据病变类型不同可分为炎症性息肉、增生性息肉、腺瘤性息肉与幼年性息肉,虽癌变风险低,但随着病情不断加重可出现血便、黑便、腹部疼痛等症状,甚至发展为大肠癌[2~3]。目前,临床对于结肠息肉的治疗多以手术为主,常用的包括高频电切术、氩离子凝固术、结肠镜下黏膜切除术等,虽均可有效治疗结肠息肉,但对于何种术式的可行性、安全性更好尚存在一定争议[4~6]。本研究采用回顾性队列研究,对比分析结肠镜下黏膜切除术、高频电切术对结肠息肉患者血清疼痛因子水平、术后创面愈合、生活质量与并发症的影响。现报道如下:
1 资料与方法
1.1 一般资料 回顾性分析2017年1月至2022年1月于灌南县人民医院接受手术治疗的60例结肠息肉患者的临床资料,按手术方式不同将患者分为电切术组与切除术组,各30例。电切术组男16例,女14例;年龄20~73岁,平均(44.32±4.12)岁;息肉直径5~10 mm,平均(7.02±1.24)mm;病程2~25个月,平均(16.35±3.34)个月;单发息肉21例,多发息肉9例。切除术组男17例,女13例;年龄21~71岁,平均(45.82±5.11)岁;息肉直径5~10 mm,平均(7.13±1.18)mm;病程3~28个月,平均(17.75±4.25)个月;单发息肉24例,多发息肉6例。两组上述一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究已获灌南县人民医院医学伦理委员会批准(批准文号:江苏省灌南县人民医院伦理字201701003号)。
1.2 纳入与排除标准 (1)纳入标准:符合手术指征;经结肠镜检查明确病情;息肉直径5~10 mm;临床资料完整。(2)排除标准:结肠镜下高度疑似为结肠恶性肿瘤合并息肉;伴有免疫系统疾病、血液系统疾病、中枢系统疾病或感染性疾病;直肠或肛门伴有严重的化脓性炎症;合并严重的肠梗阻、肠腔狭窄、便秘、巨结肠、中毒性肠炎等;术前14 d接受抗凝药物或抗血小板治疗史;既往有结直肠癌手术史;肝肾功能异常、凝血功能异常;妊娠期或哺乳期女性。
1.3 治疗方法
1.3.1 电切术组 采用高频电切术治疗。麻醉后置入结肠镜,将结肠镜延伸至最远端息肉部位后再缓慢退镜,退镜过程中观察息肉位置、息肉大小、息肉类型与周围组织关系等情况。切除术前,将高频电流发生器(型号为亿高BCO-800 DI/D型)功率设置为35 W,将圈套器套住隆起的息肉基底部,借助高频电刀完整切除息肉,息肉脱落后基底部表面发白。用圈套器摘除息肉组织并取出。
1.3.2 切除术组 采用结肠镜下黏膜切除术治疗。麻醉与结肠镜置入操作与电切术组一致。分别选择息肉边缘2 mm左右处的肛侧端、口侧端2点作为内镜注射针进针点,分别注入剂量为5~10 ml生理盐水,待息肉周边黏膜发白、息肉与黏膜下层出现明显分离并充分抬举后,将圈套器套住隆起的息肉基底部,借助高频电刀完整切除息肉。两组术后均接受常规抗感染与康复随访3个月。
1.4 观察指标 (1)临床疗效。术后新生黏膜上皮肉芽组织覆盖全部病灶,息肉全部消失,且未见明显瘢痕为治愈;术后新生黏膜上皮肉芽组织覆盖部分病灶,息肉全部消失,但存在轻微瘢痕为显效;术后新生黏膜上皮肉芽组织覆盖小部分病灶,息肉部分消失,存在瘢痕为有效;术后新生黏膜上皮肉芽组织未覆盖病灶,息肉未见缩小为无效。总有效率=(治愈例数+显效例数+有效例数)/总例数×100%。(2)围术期指标,包括手术时间、术中出血量、息肉切除时间、创面愈合时间、术后住院时间。(3)疼痛程度。借助视觉模拟评分量表(VAS)对患者术后24 h、48 h、72 h的疼痛程度进行评估,最高分为10分,最低分为0分,分值低疼痛轻。(4)血清疼痛因子水平。采集两组术前(麻醉前15 min)、术后72 h 3 ml静脉血,离心处理(半径为6 cm,转速为2 500 r/min),10 min后取上清液,通过放射免疫分析法测定血清神经肽Y(NPY)、P物质(SP)、神经生长因子(NGF)、前列腺素E2(PGE2)水平。(5)生活质量。借助消化病患者生存质量指数(GLQI)[7]对患者术前、术后3个月的生活质量进行评估,5个维度36条目,每条目最低分为0分,最高分为4分,量表满分为144分,分值低表示生活质量低。(6)术后并发症发生情况。包括早期出血、晚期出血、穿孔等。
1.5 统计学方法 采用SPSS24.0统计学软件分析数据。围术期指标、疼痛程度、血清疼痛因子等计量资料以(±s)表示,行t检验;疗效、并发症等计数资料用%表示,行χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组临床疗效对比 切除术组治疗总有效率96.67%,高于电切术组的80.00%(P<0.05)。见表1。

表1 两组临床疗效对比[例(%)]
2.2 两组疼痛程度对比 切除术组术后24 h、48 h、72 h VAS评分低于电切术组(P<0.05)。见表2。
表2 两组VAS评分对比(分,±s)
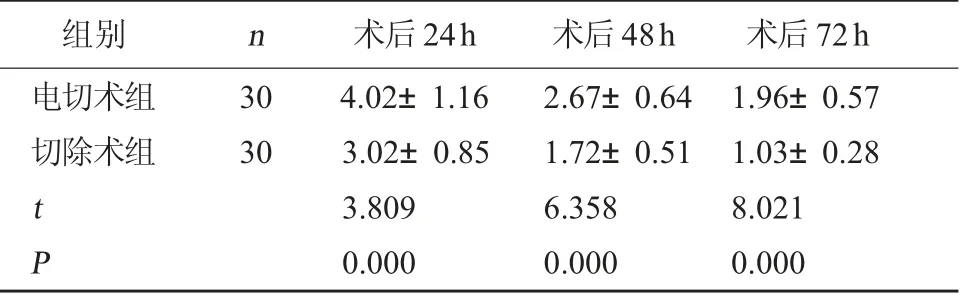
表2 两组VAS评分对比(分,±s)
组别 n 术后24h 术后48h 术后72h电切术组切除术组30 30 t P 4.02±1.16 3.02±0.85 3.809 0.000 2.67±0.64 1.72±0.51 6.358 0.000 1.96±0.57 1.03±0.28 8.021 0.000
2.3 两组围术期指标对比 切除术组术中出血量大于电切术组,息肉切除时间、创面愈合时间、术后住院时间短于电切术组,差异有统计学意义(P<0.05)。见表3。
表3 两组围术期指标对比(±s)
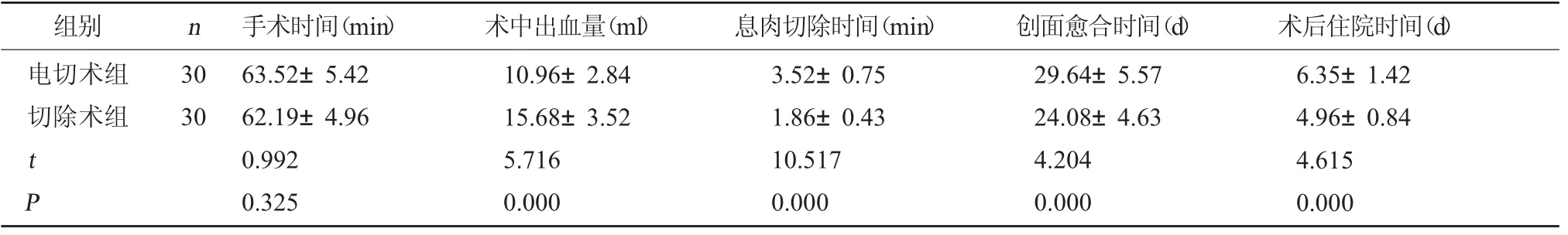
表3 两组围术期指标对比(±s)
组别 n 手术时间(min) 术中出血量(ml) 息肉切除时间(min) 创面愈合时间(d) 术后住院时间(d)电切术组切除术组30 30 t P 63.52±5.42 62.19±4.96 0.992 0.325 10.96±2.84 15.68±3.52 5.716 0.000 3.52±0.75 1.86±0.43 10.517 0.000 29.64±5.57 24.08±4.63 4.204 0.000 6.35±1.42 4.96±0.84 4.615 0.000
2.4 两组血清疼痛因子水平对比 术前两组血清疼痛因子水平对比,差异无统计学意义(P>0.05);术后72 h切除术组血清NPY、SP、NGF、PGE2水平低于电切术组(P<0.05)。见表4。
表4 两组血清疼痛因子水平对比(±s)

表4 两组血清疼痛因子水平对比(±s)
注:与本组术前相比,*P<0.05。
PGE2(pg/ml)术前 术后72 h电切术组切除术组组别 n NPY(pg/ml)术前 术后72 h SP(μg/ml)术前 术后72 h NGF(pg/ml)术前 术后72 h 251.32±30.24*229.64±25.41*3.006 0.004 30 30 t P 98.62±12.25 97.39±11.18 0.406 0.686 135.64±15.84*112.85±20.41*4.832 0.000 1.28±0.32 1.37±0.38 0.992 0.325 3.74±0.54*2.86±0.74*5.262 0.000 31.12±4.21 30.38±5.24 0.603 0.549 57.24±5.84*46.83±6.61*6.464 0.000 132.52±24.15 131.05±25.84 0.228 0.820
2.5 两组生活质量评分对比 术前,两组GLQI量表各维度评分对比,差异无统计学意义(P>0.05);术后3个月,切除术组GLQI量表各维度评分高于电切术组(P<0.05)。见表5。
表5 两组GLQI量表评分对比(分,±s)
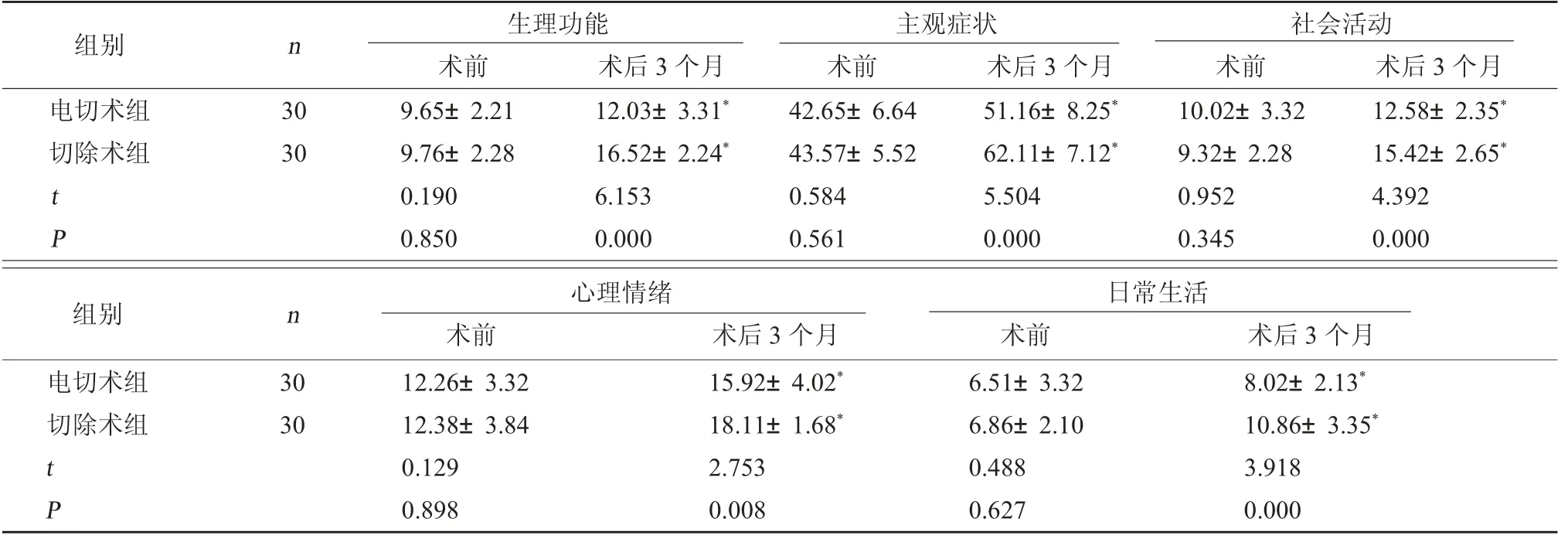
表5 两组GLQI量表评分对比(分,±s)
注:与本组术前相比,*P<0.05。
社会活动术前 术后3个月电切术组切除术组组别 n 生理功能术前 术后3个月主观症状术前 术后3个月12.58±2.35*15.42±2.65*4.392 0.000组别 n 心理情绪术前 术后3个月30 30 t P 9.65±2.21 9.76±2.28 0.190 0.850 12.03±3.31*16.52±2.24*6.153 0.000 42.65±6.64 43.57±5.52 0.584 0.561 51.16±8.25*62.11±7.12*5.504 0.000 10.02±3.32 9.32±2.28 0.952 0.345日常生活术前 术后3个月电切术组切除术组8.02±2.13*10.86±3.35*3.918 0.000 30 30 t P 12.26±3.32 12.38±3.84 0.129 0.898 15.92±4.02*18.11±1.68*2.753 0.008 6.51±3.32 6.86±2.10 0.488 0.627
2.6 两组术后并发症发生情况对比 切除术组术后并发症发生率为3.33%,与电切术组的13.33%对比,差异无统计学意义(P>0.05)。见表6。
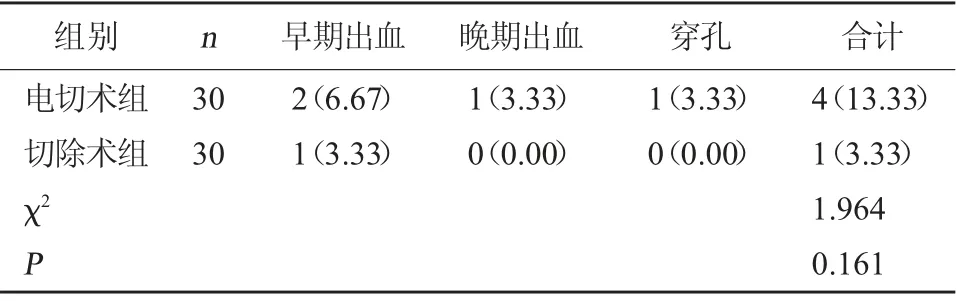
表6 两组术后并发症发生情况对比[例(%)]
3 讨论
腺瘤性息肉是结肠癌的高危风险因素,故早期切除结肠息肉已成为阻断腺瘤-腺癌途径的关键[8]。目前,临床对于结肠息肉的切除方式主要包括内镜下切除、外科手术,其中开放式手术虽切除率高,但创伤大、术后恢复时间长,而内镜下息肉切除术因具有微创、操作简单、恢复快等优势逐渐成为当前主流术式[9~10]。
本研究结果显示,切除术组治疗总有效率、术中出血量与术后3个月GLQI量表各维度评分比电切术组高,息肉切除时间、创面愈合时间、术后住院时间比电切术组短。由此可见,结肠镜下黏膜切除术、高频电切术虽都可有效治疗结肠息肉患者,但结肠镜下黏膜切除术具有息肉切除时间短、术后愈合快等优势,且有利于缩短住院时间,提高生活质量。高频电切术的原理在于电-热能,通过高频电流产生的热效应而促使组织坏死、凝固。但治疗过程中可能会出现部分息肉因圈套不完全而出现病灶残留,且对于直径小的息肉可能会出现过度切除问题[11]。而结肠镜下黏膜切除术的治疗原理是在高频电刀辅助下,完整彻底清除消化道局部黏膜。由于消化道壁分层结构具有一定特殊性,病变局限于黏膜层时可完整剥离切除此处黏膜,从而达到与开放性手术相似的完全切除效果。
有研究发现,痛觉过敏是诱发疼痛出现的一种机制,而神经源性炎症反应是痛觉过敏的分子学基础[12~13]。神经生长因子与血清疼痛因子在机体受到刺激、创伤、手术时会得到大量释放,导致细胞膜通透性增加,加剧炎性级联反应与中枢敏化、外周敏化,进而参与痛觉信号传导过程中。NPY广泛分布于外周神经与中枢神经,机体受炎症刺激后可诱发NPY受体基因表达异常,当受体Y2被激活或Y1被抑制时,NPY可发挥促进疼痛作用[14~15]。SP属于兴奋性神经递质之一,可参与痛觉信号传导过程中;PGE2、NGF为典型疼痛刺激因子,水平降低时可增高机体疼痛阈值与减轻主观疼痛。本研究结果显示,切除术组术后72 h血清NPY、SP、NGF、PGE2水平,术后24 h、48 h、72 h VAS评分均低于电切术组,表明相比高频电切术,结肠镜下黏膜切除术更利于抑制结肠息肉患者血清疼痛介质表达,减轻术后疼痛程度。此外,切除术组术后仅出现1例早期出血,安全性高,但与电切术组并发症发生率相比未见显著性差异,推测原因可能与本研究纳入样本量少有关。因此为进一步证实本研究结论,后期还需扩大样本量,开展多中心、前瞻性的随机对照研究。
综上所述,结肠镜下黏膜切除术、高频电切术均可有效治疗结肠息肉患者,且术后并发症少,但前者更利于抑制血清疼痛介质表达,降低术后疼痛程度,加快术后愈合,提高患者生活质量。

