外源物质对高温胁迫下平贝母生理生化的影响
刘思佳,李 波,宋 雪,沈 莹,何录文,孟祥才
(黑龙江中医药大学 药学院,黑龙江 哈尔滨 150040)
平贝母Fritillaria ussuriensisMaxim.为百合科多年生草本植物,其干燥鳞茎为我国东北三省道地药材,具有清热润肺、化痰止咳的功效,用于肺热燥咳、干咳少痰、阴虚劳嗽、咳痰带血等症的治疗。平贝母属早春植物,每年在土壤解冻后立即开始迅速生长,当5月下旬气温到达20℃以上时开始枯萎,地上部分生长期不足60 d,地上部分生长发育期很短。平贝母的生长习性比较独特,喜冷怕热,高温胁迫会对平贝母的生长发育造成不可逆转的损伤[1],大大降低了平贝母的产量。植物产量来源于光合作用,减少逆境危害对平贝母高产具有重要影响。外源物质如SA[2]、BR[3]、6-BA[4]及Ca2+(CaCl2)[5]能够诱导植物体发生一系列生理生化反应,能够缓解高温胁迫对植物造成的损伤,增强植物对逆境的适应能力。因此探究外源物质对高温胁迫下平贝母的净光合速率和生理生化的影响,对提高栽培产量具有重要意义。
1 材料、仪器与试剂
1.1 材料
实验于2019年在黑龙江省哈尔滨市通河县清河镇五七干校平贝母种植基地进行。试验对象为6年生平贝母Fritillaria ussuriensisMaxim.选取植株长势良好、大小一致者作为实验材料。
1.2 仪器
UV-1240型紫外分光光度仪(日本岛津公司);CI-340型便携式光合测定仪(美国 CID Bio-Science公司);TOLEDO AG135型电子分析天平(瑞士METTLER公司);KDC-160HR型高速低温离心机(科大创新股份有限公司);Julabo TW20型数显恒温水浴锅(德国Julabo有限公司)。
1.3 试剂
6-苄氨基嘌呤、水杨酸(天津市致远化学试剂有限公司);芸苔素内酯(河南中浪农业科技有限公司);CaCl2、NaH2PO4·2H2O、丙酮、Na2HPO4·12H2O(北京化工厂);甲硫氨酸(MET)(上海士锋生物科技有限公司);氮蓝四唑(NBT)(上海静融生物科技有限公司);核黄素(北京奥博星生物技术有限责任公司);EDTA-Na2(上海正极生物科技有限公司);愈创木酚、硫代巴比妥酸(国药集团化学试剂有限公司);30%H2O2(天津市东丽区天大化学试剂厂);三氯乙酸(上海凌峰化学试剂有限公司);农用有机硅助剂(青岛绿陇作物营养有限公司)。
2 方法
2.1 田间试验设计
根据文献或生长调节剂使用说明书确定平贝母叶面最佳的喷施浓度。于2019年5月18日18:00叶面施用水杨酸(SA)、CaCl2、芸苔素内酯(BR)、6-苄氨基嘌呤(6-BA),使叶片上下均沾满液体。实验分为SA(0.2 mmol/L)处理组、CaCl2(10 mmol/L)处理组、BR(0.01%芸苔素内酯乳油1 750倍液)处理组、6-BA(20 μmol/L)处理组和对照组(蒸馏水)。每组处理1 m×1 m,三次重复。5月20日—21日各组覆盖塑料拱棚,棚内温度最高温度30℃左右。各组分别于5月18日、5月20日、5月22日、5月24日17:00左右采集6年生平贝母植株中部叶片10片,共随机采集15株,将各组分别切碎混匀,用封口袋密封,于-40℃冰箱备存,测定各组生理生化指标。
2.2 生理生化指标测定
2.2.2 H2O2含量测定 采用南京建成过氧化氢测定试剂盒(A064)(比色法)测定。
2.2.3 SOD活性测定 测定采用氮蓝四唑NBT法,参照李合生[6]的方法。
2.2.4 POD活性测定 测定采用愈创木酚法,参照李合生[6]的方法。
2.2.5 CAT活性测定 测定紫外吸收法,参照李合生[6]的方法。
2.2.6 MDA含量测定 采用南京建成植物MAD测定试剂盒(A003-3-1)(微板法)测定。
2.2.7 叶绿素含量测定 采用南京建成叶绿素测试盒(A147-1-1)(比色法)测定。
2.3 光合作用测定
于2019年5月20日使用便携式光合测定仪CI-340分别于7:00、9:00、11:00、13:00、15:00、17:00时间点测定各组6年生平贝母20 cm高度处叶片的净光合速率,每一组测定4株平贝母。
3 结果
3.1 外源物质对高温下平贝母·、H2O2含量的影响
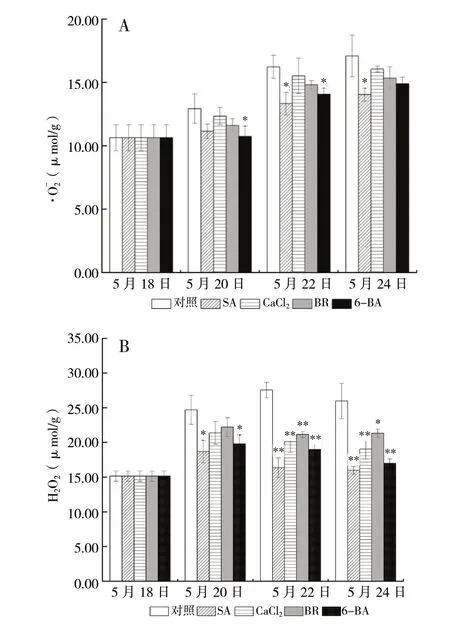
图1 不同处理组·O2-和H2O2含量变化 (n = 3)Fig. 1 Changes of · and H2O2 contents in different treatment groups(n = 3)
3.2 外源物质对高温下平贝母抗氧化酶系统的影响
三种抗氧化酶的活性较对照组均有升高的趋势。除5月20日6-BA处理组外,各处理组各时间点SOD活性均高于对照组,其中,CaCl2、BR处理组分别在5月22日、24日及5月20日、24日有明显提升,其余各组与对照组相比差异无统计学意义(P>0.05)。其中CaCl2处理组提升最高,在5月22日、24日分别高于对照组18.5%(P<0.05)、35.7%(P<0.01)。
除5月20日CaCl2处理组及5月22日、5月24日BR处理组CAT活性较对照组略有下降外,其余处理组略高于对照组,差异无统计学意义(P>0.05)。
各处理组POD活性均高于对照组。SA处理组效果最为明显,胁迫开始5 d内的平均值分别高于对照组17.5%(P<0.05)、31.3%(P<0.01)和67.1% (P<0.01);CaCl2处理组提升效果仅次于SA处理组,其在5月20日与对照组相比虽有提高但并不明显,在5月22日、24日分别高于对照组25.1% (P<0.01)、60.9%(P<0.01);BR、6-BA处理组仅在5月24日较对照组有明显提高,分别高于对照组22.3%(P<0.05)、37.6%(P<0.01),见图2。
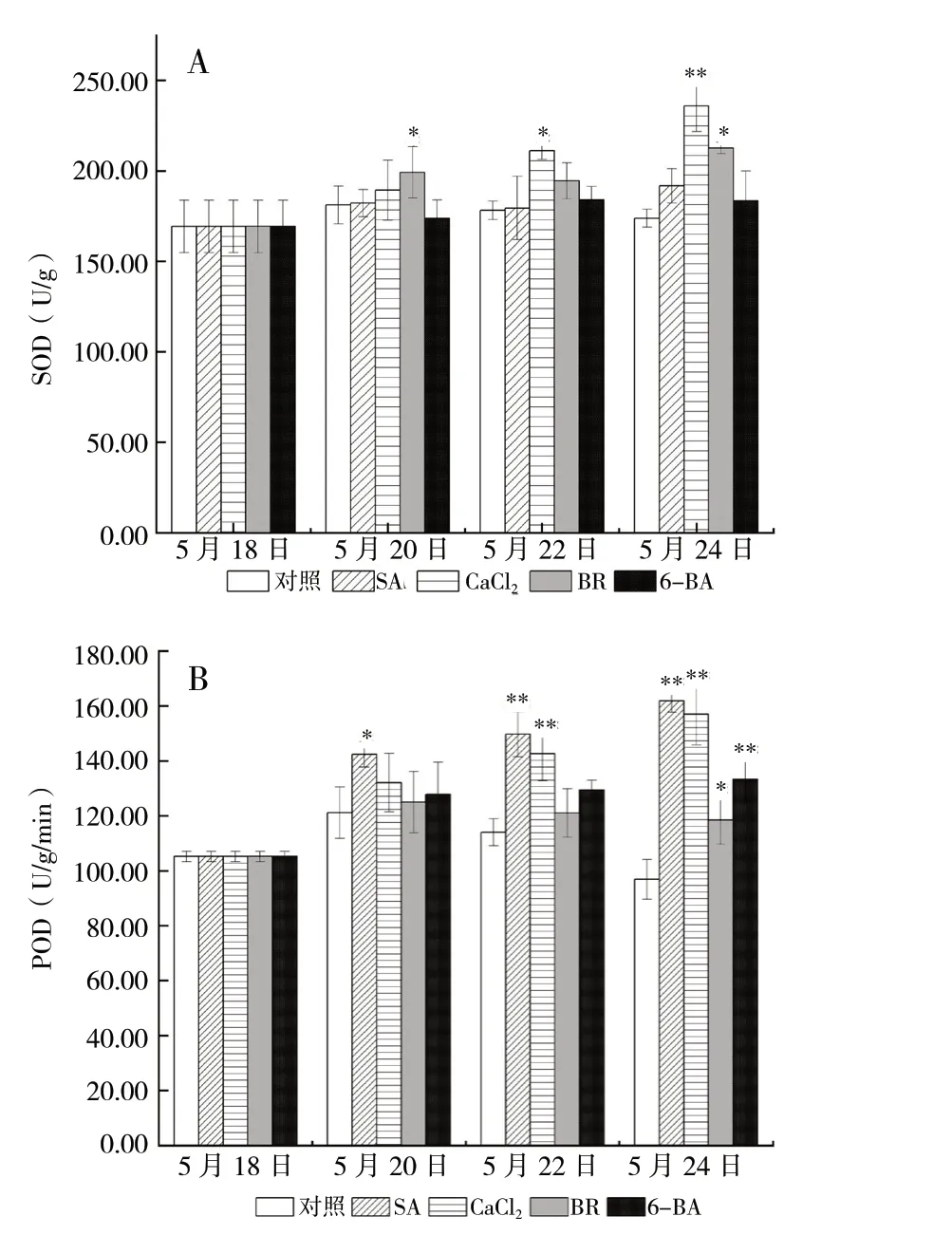
图2 不同处理组抗氧化酶(SOD、POD)活性 (n = 3)Fig. 2 Activities of anti-oxidant enzymes (SOD,POD)in different treatment groups (n = 3)
3.3 外源物质对高温下平贝母叶绿素、MDA含量的影响
除SA处理组和5月24日BR处理组叶绿素a、b含量略高于对照组外,各处理组均略低于对照组,差异无统计学意义(P>0.05)。
与对照组相比各处理组均降低了平贝母叶片的MDA含量。除5月20日、24日CaCl2处 理组及5月22日6-BA处理组外,其余处理组各时间较对照组均有明显降低。SA、CaCl2、BR、6-BA处理组各天叶片的MDA含量的平均值比对照组降低了22.8%(P<0.01)、14.4%(P<0.05)、27.9%(P< 0.01)和18.3%(P<0.01),见图3。
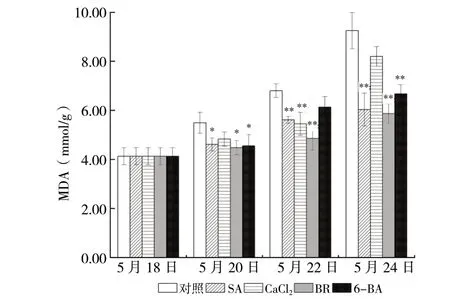
图3 不同处理组丙二醛含量变化 (n = 3)Fig. 3 Changes of chlorophyll and malondialdehyde contents in different treatment groups (n = 3)
3.4 外源物质对高温下平贝母光合速率的影响
平贝母各处理组各时间点的光合速率较对照组均有增加,除9:00、11:00、15:00时SA处理组净光合速率明显大于对照组,分别比对照组增加了23.6%(P<0.05)、33.7%(P<0.05)、20.4%(P<0.05),其余各组虽有增加但并不明显。SA、CaCl2、BR、6-BA处理组各时间点的平均净光合速率分别比对照组增加了24.9%(P<0.05)、11.7%(P>0.05)、19.0%(P>0.05)、10.2%(P>0.05),见图4。通过喷施外源性植物生长调节剂SA、BR、6-BA及Ca2+提高了平贝母的高温强光天气下的净光合速率,以0.2 mmol/L SA效果最佳。
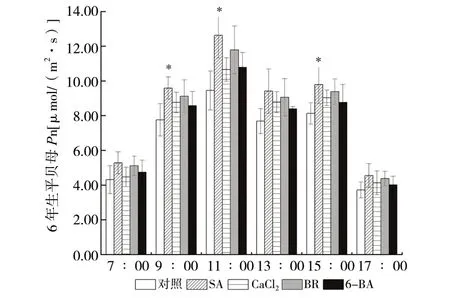
图4 各处理组净光合速率日变化 (n = 4)Fig. 4 Diurnal variation of net photosynthetic rate in each treatment group (n = 4)
4 讨论
植物在逆境条件下产生大量的活性氧[7],而活性氧是造成植物细胞伤害或致死的主要原因[8]。·、H2O2、·OH等活性氧破坏DNA和蛋白质等决定生命活动的大分子结构以及生物膜。植物体为了提高对环境的适应能力,进化出了活性氧的清除系统,高温胁迫会引其起植物细胞的应激反应,激活抗氧化系统,及时清除活性氧,从而能够较好适应高温环境。SOD是植物活性氧清除系统的第一道防线,·的活性远远高于H2O2,SOD通过歧化反应将超氧自由基·转化为H2O2和O2,大大减轻活性氧对细胞的伤害。CAT和POD是植物体内清除H2O2的专一酶,可直接将H2O2彻底分解成无毒害的H2O和O2,消除活性氧自由基对植物造成的细胞伤害[9]。活性氧可使膜脂中不饱和脂肪酸过氧化为MDA[10],MDA就是细胞膜系统受害程度的重要指标之一[11]。大量研究表明,逆境胁迫下植物体保护酶活性越高,其对活性氧的清除能力就越强,植物的抗逆性也越强。
4.1 施用外源SA对高温下平贝母的影响
SA是提高植物抗逆性的信号分子[12]。关于SA诱导植物抗高温的机理主要是增加膜保护物质(膜保护酶和抗氧化物质)、减少活性氧[13],诱导抗逆基因表达或通过脱落酸(ABA)来调节抗逆基因表达[14]。实验结果显示施用植物生长调节剂SA可大幅增加平贝母叶片抗氧化酶SOD、CAT、POD活性,分别提高了3.8%、13.3%和38.6%,·与H2O2含量分别降低了16.14%和34.68%,叶片MDA的含量降低了22.8%,增强了平贝母对高温的耐受性,从而使其净光合速率提高24.9%。
4.2 施用外源BR对高温下平贝母的影响
BR是广谱高效的植物生长调节剂,能够提高1,5-二磷酸核酮糖羧化酶的活性,提高植物对多种逆境的抗性。施用BR可明显提高热敏型水稻品种的叶片叶绿素及蛋白质含量、SOD和POD活性,降低叶片MDA含量、电解质外渗率[15],脯氨酸和可溶性蛋白含量,降低了丙二醛含量,增加了净光合速率[16]。实验结果显示施用植物生长调节剂BR使平贝母叶片SOD、CAT、POD活性分别提 高13.8%、0.97%和9.8%,·与H2O2分别降低11.29%和17.32%,MDA含量降低27.9%,保护叶片细胞不被高温破坏,从而使其净光合速率提高11.7%。
4.3 施用外源Ca2+对高温下平贝母的影响
Ca2+是细胞内的第二信使,虽然不是植物激素,但可以通过调控SA诱导植物的耐热性。外源SA可通过提高SOD和CAT活性,降低MDA含量来提高葡萄幼苗的耐热性,促进SA对葡萄幼苗耐热性的诱导[17]。用CaCl2和SA + CaCl2药剂喷施柑橘,各处理组均较高温条件下对照组光合速率增加,SA与CaCl2具有相互促进效应[18]。本研究显示施用植物生长调节剂Ca2+与施加SA效果相似,均可增加平贝母叶片抗氧化酶SOD、CAT、POD活性,分别提高19.3%、1.4%和30%,·与H2O2分别降低了5.0%和22.0%,降低叶片MDA的含量降低14.4%,提高平贝母的耐热性,净光合速率提高10.2%,但其净光合速率的增长效果低于SA。
4.4 施用外源6-BA对高温下平贝母的影响
6-BA是人工合成的细胞分裂素,能够提高玉米的1,5-二磷酸核酮糖羧化酶和丙酮酸磷酸双激酶活性及叶绿素含量[19];明显提高了高温胁迫下甜椒幼苗对光强的利用率,从而増加了生物量,促进叶绿素的合成,降低·的产率及MDA的积累[20];使高温胁迫下的微型月季叶片中的SOD、POD和APX活性及蛋白质和游离脯氨酸含量明显提高,相对电导率及MDA含量明显降低[4]。此外6-BA还有缓解叶片衰老的作用[21]。实验结果显示施用植物生长调节剂6-BA分别提高平贝母叶片SOD、CAT、POD活性1.5%、5.6%、17.6%,·与H2O2的含量分别降低了14.7%、28.5%,减少了活性氧自由基对平贝母叶片细胞的伤害,使净光合速率增加19.0%。
平贝母为早春植物,土壤解冻后立即萌发,夏季来临前枯萎,地上部分生长仅50余天,极不耐高温。对于北方来说,春季气温波动较大,每年在此期间都会出现30℃的高温,加速叶片衰老,对平贝母产量造成影响。然而,高温出现早晚不同对平贝母生长的影响也不同。早期高温一旦对叶片生理造成损害,将影响整个生长发育期,而晚期影响较小,高温对产量的影响具有很大的不确定性。基于此,采用净光合速率间接评价对产量的影响更具有参考意义。
5 结论
施用外源SA、BR、6-BA及Ca2+,能够提高高温强光下平贝母抗氧化酶SOD、CAT、POD的活性;减少活性氧·、H2O2的含量;降低活性氧对植物细胞的伤害程度(MDA含量降低);增强平贝母叶片对高温的耐受性,使平贝母净光合速率较对照组有明显增加。以叶面喷施0.2 mmol/L SA效果最佳。外源SA无毒廉价,在平贝母生长期中后期高温来临前叶面施用,可增加平贝母的高温抗性,维持叶片的功能性,可作为提高平贝母产量的一项重要措施。

