传统发酵型五加皮酒的处方考证及制备工艺研究
温 柔,王晓晴,孙允红,杨 颖, 侯 林
(1.山东中医药大学 药学院,山东 济南 250355;2.山东中医药大学 青岛中医药科学院,山东 青岛266000)
五加皮酒是以五加皮为主药,在民间广泛流传配制的传统药酒,具有祛风湿、痿痹、壮筋骨,填精髓等功效[1]。唐·《外台秘要》[2]记载的五加皮酒方详细记述了五加皮酒的制备工艺,其方为“五加根茎细刨五斗,六月六日曲未三斗,黍米一石,糯米亦得。以五斗共五加同下于大釜中,以木度深浅,与水准刻之,即更添水一石五斗,并前计两石……”先以水煎五加皮取汁浸曲,再煎其药渣取汁与黍米共煮,放凉加曲发酵而成。
目前市面上生产的五加皮酒,多以粮食白酒为酒基,配以多味药材经浸泡、配制、调色等工艺而制成[3]。白酒即蒸馏酒,普遍酒精度数偏高,蒸馏酒古称“烧酒”,《本草纲目》载“烧酒,味辛、甘,性大热,有大毒”。传统发酵型五加皮酒采用的是传统黄酒酿造工艺制备,酒精度普遍较低。当前对于使用传统黄酒酿造工艺制备五加皮酒的研究相对空白,本研究基于《外台秘要》中记载的五加皮酒方,对传统五加皮酒进行处方考证。在古方的基础上对传统发酵型五加皮酒制备工艺进行研究,得到五加皮最佳水提及糖化工艺,为传统发酵型五加皮酒的制备研究提供实验依据。
1 处方考证
1.1 处方沿革
《神农本草经》[4]记载最早的酿造五加皮酒大概出自战国时期。《外科大成》[5]记载:杰出的本草学家陶弘景就录:“用单味五加皮,煮根茎酿酒,主益人。”《本草纲目》[6]记载五加皮酒的制备方法“用五加皮刮去骨,煎汁和麴米酿成饮之。或切碎袋盛,浸酒煮饮,或加牛膝、当归、地榆诸药”。唐·《外台秘要》[7]记载的五加皮酒方则详细记述了单味五加皮酒的制备工艺,其方“五加根茎细刨五斗,六月六日曲未三斗,黍米一石,糯米亦得……”先以水煎五加皮取汁浸曲,再煎其药渣取汁与黍米共煮,放凉加曲发酵而成。《备急千金方》[8]记载五加皮酒方:“五加皮、枸杞根白皮各一斗。以水一石五斗煮取汁七斗,分取四斗浸曲一斗,余三斗用拌饭下米,多少如常酿法。”《太平圣惠方》[9]记载的五加皮酒为浸渍法制备:“五加皮细锉一升,以清酒一斗。渍十日,温服一中盏。”文献考证可知,传统的五加皮酒大多是采用酿造法制备而来。先水煎煮五加皮得到五加皮水提液及药渣,然后将五加皮水提液及药渣与米、曲共同发酵。
1.2 药材基原
五加皮最早记载于《神农本草经》,被列为上品,又名五加,尚有材漆、五花、木骨、追风使、刺通、白剌等异名[10]。《名医别录》有载:“五加皮,五叶者良,生汉中及冤句,五月、七月采莲,十月采根,阴干。”五加皮具有滋补、祛风湿、补肝肾、强筋骨等功效。《神农本草经》[11]言其“主心腹疝气,腹痛,益气,疗蹩、小儿不能行、疸创阴蚀。”书中首次提出五加具有益气、疗蹩的作用。《名医别录》[12]云:“男子阳痪,囊下湿,小便余沥,女人阴痒及腰脊痛,两脚痛风弱,五缓,虚嬴,补中益精,坚筋骨,强志意,久服轻身耐老。”《新修本草》中关于五加皮功效的记载,且云“久服轻身耐老……五叶者良。”《本草思辨录》载:“五加皮,宜下焦风湿之缓证。若风湿搏于肌表,则非其所司。古方多浸酒醜酒,及酒调末服之,以行药势。”2020年版《中国药典》[13]收录五加皮为五加科植物细柱五加皮Acanthopanax gracilistylusW.W. Smith的干燥根皮。
1.3 药材炮制
《外台秘要》记载的五加皮酒方,详细记述了五加皮的炮制方法:“五加根茎细刨五斗,六月六日曲未……”《太平圣惠方》记载“五加皮细锉一升……”仲景云:“锉如麻豆大,与咀同义。咀,古之制也,古无铁刃,以口咬细,令如麻豆,为粗药煎之,使药水清饮于腹中,则易升易散也,此所谓咀也。今人以刀器锉如麻豆大,此咀之易成也。”[1“4]如麻豆大”在煮散的粒度描述中十分常见,“麻豆”在历代古籍文献中却未见有明确记载。但“麻”在历代古籍文献中均有明确且统一的释义,即我国传统种植的大麻,古代五谷之一的大麻籽实以及古代百姓衣着及丧服所用的麻布均来源于大麻[15]。“麻”为桑科植物大麻,“麻豆”为大麻的成熟果实,即火麻仁。2020 年版《中国药典》中记载火麻仁呈卵圆形,长 4 ~ 5.5 mm,直径 2.5 ~ 4 mm。因此,“麻豆大”推测为2 ~ 5 mm。而 4目筛孔径为 4.75 mm,一号筛(10目)的孔径则为2.00 mm[16-19]。因此,“如麻豆大”可取过4目筛但不过一号筛(10目)的粗颗粒。由此推测,《外台秘要》记载的五加皮酒方中五加皮应取粉碎后过4目筛但不过10目筛的粗粉。
1.4 计量考证
原方中记载五加皮用量为五斗,黍米为一石,水为两石。已知五加皮粉碎的粒度,由此可以计算出五加皮粉末的密度。实验得到五加皮粉末松密度和振实密度分别为0.412、0.410,黍米的松密度和振实密度分别为0.831、0.836。查阅文献可知古代与现代换算关系:1斗 = 2 000 mL,一石 = 10斗[20]。由此可推出,五加皮∶黍米∶水= 1∶4∶10。
2 传统发酵型五加皮酒的制备工艺研究
2.1 材料
2.1.1 仪器 2695型高效液相色谱仪包括2998型检测器、Empower色谱工作站(美国Waters公司);DK-S14 型电热恒温水浴锅、DHG-9140B 型电热鼓风干燥箱[中仪国科(北京)科技有限公司];FA2104型万分之一电子天平(上海舜宇恒平科学仪器有限公司);CPA225D 型十万分之一电子天平[赛多利斯科学仪器(北京)有限公司];KQ-500E 型超声波清洗器 (昆山市超声仪器有限公司);LA759 型超纯水机(英国 ELGA 公司)。
2.1.2 药材及试剂 黍米购自沈阳信昌粮食贸易有限公司;五加皮(生产批号:210601)购自青岛天成中药饮片有限公司,经山东中医药大学侯林副教授鉴定,均符合2020年版《中国药典》(一部)相关项下要求;绿原酸对照品(批号:Y24J7K16726,纯度≥98%,上海源叶生物科技有限公司);葡萄糖对照品(批号:20191029,分析纯,国药集团化学试剂有限公司);乙腈为色谱纯(天津市科密欧化学试剂有限公司);磷酸为分析纯;超纯水为实验室自制。
2.2 工艺流程
五加皮粉碎过筛后煎煮得到五加皮水提液及药渣。黍米经浸泡、洗米、烫米后与五加皮水提液及药渣共煮进行煮糜。将煮好的糜倒入消毒后的铁盘中,使其快速降温。降到指定温度后加入麦曲进行糖化。糖化结束后加入酵母,转移至缸中进行发酵。发酵7 d后过滤取滤液,将过滤后的酒液置于85℃水浴30 min,即可。
2.3 五加皮水提工艺研究
2.3.1 样品溶液制备 取五加皮粗粉50 g于圆底烧瓶中,加入水,浸泡,回流,得到五加皮水提液,将提取液离心、过滤、定容至500 mL。
2.3.2 正交试验 根据单因素试验结果,设计L9(34)正交试验,按方法测定浸出物含量和绿原酸含量,对浸出物含量和绿原酸含量进行综合评分,以综合评分为指标,正交因素水平见表1。
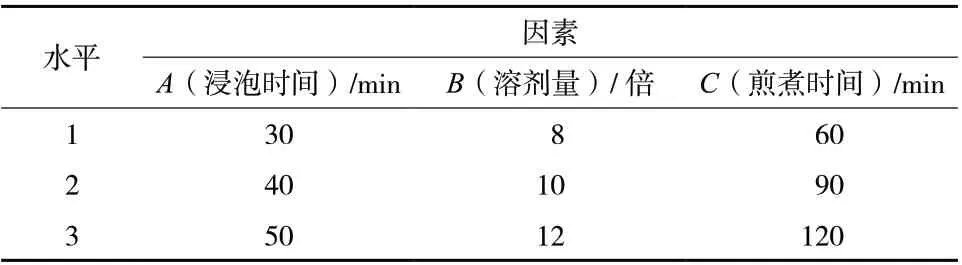
表1 五加皮水提工艺正交因素水平表Tab. 1 Level table of orthogonal factors water extraction technology of Acanthopanacis Cortex
2.4 五加皮糖化工艺研究
2.4.1 糖化液的制备 取黍米500 g,浸泡24 h后进行烫米,再浸泡24 h,与五加皮提取液及药渣共煮进行糊化,摊凉,加入麦曲糖化,得到糖化液。
2.4.2 正交试验 根据单因素试验结果,设计L9(34)正交试验,以还原糖为指标,正交因素水平见表2。

表2 五加皮糖化工艺正交因素水平表Tab. 2 Level table of orthogonal factor of saccharification process of Acanthopanacis Cortex
2.5 方法
2.5.1 浸出物含量测定 精密量取25 mL水提液于干燥至恒重的蒸发皿,水浴蒸干。105℃干燥3 h,置干燥器中冷却30 min,迅速精密称定重量,平行测定两次,以干燥品计算供试品中水溶性浸出物的含量。
2.5.2 绿原酸含量测定 (1) 色谱条件 色谱柱为WondaSil C18(250 mm×4.6 mm,5μm);流动相为乙腈(B)-0.05%磷酸水(A),梯度洗脱(0 ~ 10 min,5% →10%B,10 ~ 30 min,10% →15%B,30 ~ 40 min,15%→85%B);检测波长:270 nm;柱温:30℃;进样量:10 μL。
(2) 对照品溶液的制备 精密称取5.08 mg绿原酸对照品,加甲醇溶解,定容至5 mL容量瓶中,即得。
(3) 供试品溶液的制备 精密吸取“2.3.1”项下样品溶液25 mL于蒸发皿中,水浴蒸干。加甲醇溶解,定容至25 mL,过滤,取滤液。
(4) 标准曲线的制备 分别精密吸取规定配制的绿原酸对照品溶液2.5 mL,按半倍稀释法,定容至5 mL容量瓶中,依次得到浓度为0.031 15、0.062 23、0.124 46、0.248 92、0.497 84、0.995 68 mg/mL系 列对照品。按“2.5.2(1)”项下色谱条件进样,测定峰面积。以浓度为横坐标(X,mg/mL),峰面积为纵坐标(Y),得到标准曲线。
2.5.3 还原糖含量测定 (1) 对照品溶液的制备
精密称取50 mg经105℃干燥至恒重的无水葡萄糖对照品,置50 mL容量瓶中,加水溶解并稀释至刻度,摇匀,即得。
(2) 供试品溶液的制备 取“2.4.1”项下糖化液4 000 r/min离心20 min,上清液定容至100 mL容量瓶,取上清液1 mL定容至100 mL容量瓶中,得到供试品溶液。精密吸取1 mL供试品溶液,测定吸光度,计算还原糖含量。
(3) 线性关系考察 采用 3,5-二硝基水杨酸比色法。分别精确吸取葡萄糖标准液0.1、0.2、0.3、0.4、0.6、0.7 mL 置于10 mL 具塞试管中,蒸馏水补至2.0 mL,加入 3,5-二硝基水杨酸试剂1.5 mL,将各试管中的溶液混合均匀,沸水浴 5 min 取出,立即冷却至室温,定容至刻度,摇匀,在540 nm波长处测定吸光度,得到葡萄糖标准曲线方程。
2.5.4 浸出物和绿原酸权重系数确定 采用CRITIC法[21-24]。CRITIC法是一种客观权重赋权法,它以两个基本概念为基础,一是对比强度,以标准差的形式来表现; 二是评价指标之间的冲突性,以指标之间的相关性为基础,故该方法是基于评价指标的对比强度和指标之间的冲突性来综合衡量指标的客观权重,在考虑指标变异性大小的同时兼顾指标之间的相关性,完全利用数据自身的客观属性进行科学评价。
3 结果与分析
3.1 五加皮水提工艺研究
3.1.1 绿原酸HPLC分析结果 按照“2.5.2(2)(3)”项下方法制备对照品溶液和五加皮供试品溶液,按“2.5.2(1)”项下色谱条件进行分析。色谱图见图1、图2,各峰之间分离度足够,峰形良好,可以用于样品的HPLC分析。
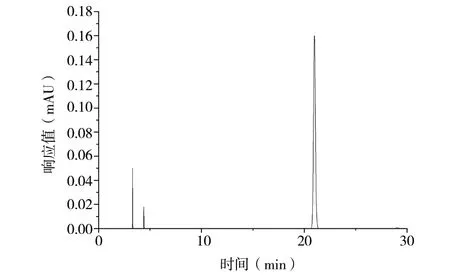
图1 绿原酸标准品HPLC图谱Fig. 1 HPLC of chlorogenic acid standard
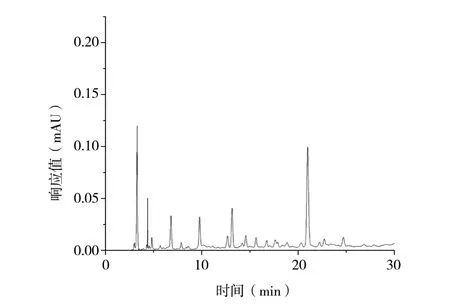
图2 五加皮供试品HPLC图谱Fig. 2 HPLC of Acanthopanacis Cortex sample
3.1.2 绿原酸标准曲线 按“2.5.2(4)”项下绘制标准曲线,结果显示,绿原酸对照品溶液浓度(X,mg/mL)和峰面积(Y)呈线性关系,回归方程为Y= 8×106X+ 152 965,R2= 0.999 6,表明绿原酸对照品在0.031 15 ~ 0.995 68 mg/mL浓度范围内线性关系良好。
3.1.3 方法学考察 (1)精密度试验 取绿原酸对照品,连续进样6次,得峰面积,计算RSD = 0.21%,表明仪器精密度良好。
(2) 重复性试验 取6份制备的同一批供试品溶液,按色谱条件进样,得峰面积,计算绿原酸含量,RSD = 1.4%,表明该方法重复性良好。
(3) 稳定性试验 分别取对照品溶液、供试品溶液,于0、2、4、6、8、10、12 h按“2.5.2(1)”项下色谱条件进样,测得2种溶液中绿原酸峰面积RSD分别为0.58%、1.7%,表明溶液在12 h内稳定性良好。
(4) 加样回收率试验 精密吸取125 mL浓度为0.154 5 mg/mL样品溶液于250 mL容量瓶中,定容至刻度作为供试品溶液。精密吸取6份 25 mL供试品,精密称取对照品2.00 mg,制备供试品溶液,按“2.5.2(1)”项下色谱条件进样,测得平均回收率为101.82%,RSD为0.31%。
3.1.4 正交试验结果 由表3可知,溶剂量的均方值最大,即溶剂量对五加皮水提液中浸出物含量和绿原酸含量影响最大,其次为浸泡时间,最后为煎煮时间,即B>A>C。由表4分析可知,因素B具有显著影响(P<0.05),而A、C不具有显著影响(P>0.05)。最终确定五加皮最佳水提工艺为A2B3C2,即浸泡时间为40 min、溶剂量为12倍、煎煮时间为90 min。
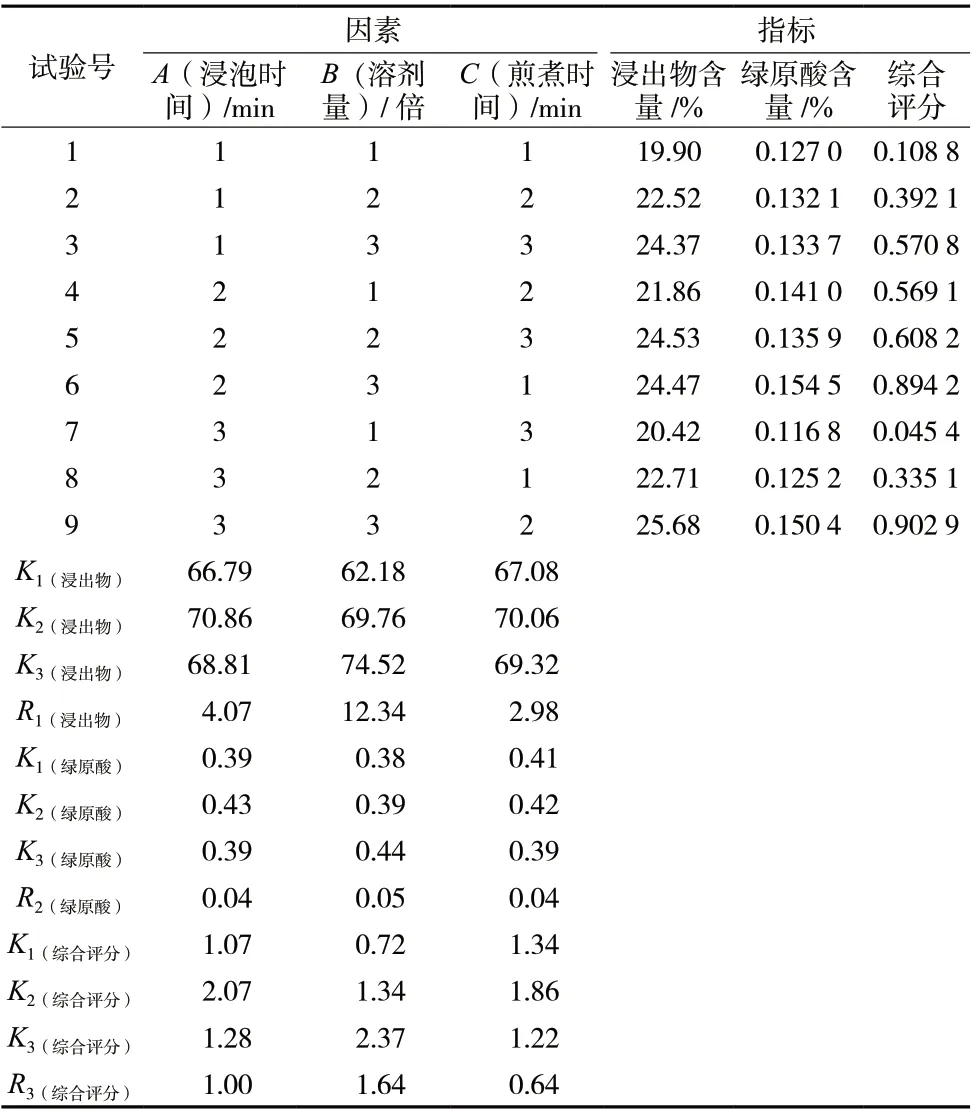
表3 五加皮水提工艺正交试验结果表Tab. 3 Orthogonal test results table of water extraction of Acanthopanacis Cortex
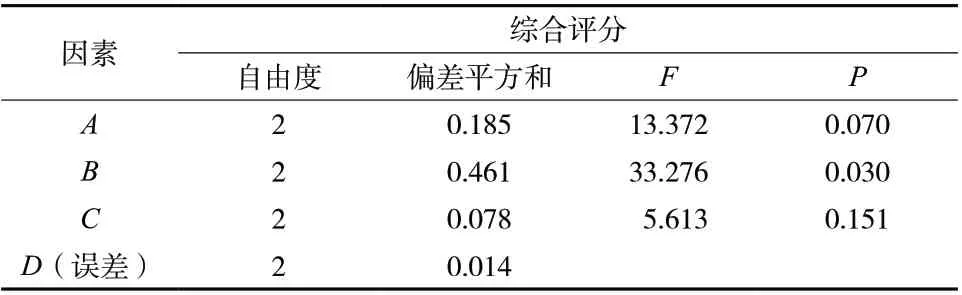
表4 五加皮水提工艺正交试验结果方差分析表Tab. 4 Orthogonal test results analysis of variance table of Acanthopanacis Cortex
3.1.5 正交试验结果验证 按“3.1.3”项下优化工艺进行 3 批验证试验,结果见表5,浸出物含量、绿原酸含量及综合评分RSD均小于3%,表明该工艺稳定可行。
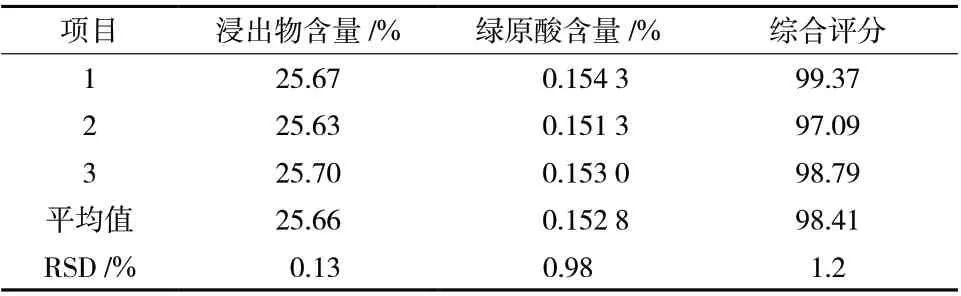
表5 五加皮水提工艺验证(n = 3)Tab. 5 Process validation of Acanthopanacis Cortex (n = 3)
3.2 糖化工艺研究
3.2.1 葡萄糖标准曲线 按“2.5.3(3)”项下绘制标准曲线,结果显示,葡萄糖对照品溶液浓度(X,mg/mL)和吸光度(Y)呈线性关系,回归方程为Y= 0.014 4X- 0.047 6,R2= 0.999 9,表明葡萄糖对照品溶液在10 ~ 70 μg/mL浓度范围内线性关系良好。
3.2.2 方法学考察 (1) 精密度试验 取浓度为70 μg/mL的无水葡萄糖对照品溶液,连续测定6次,得吸光度,RSD = 0.12%,表明仪器精密度良好。
(2) 重复性试验 取6份同一批供试品溶液,测定其吸光度,计算还原糖含量,RSD = 3.4%,表明该方法重复性良好。
(3) 稳定性试验 取供试品溶液,分别在0、10、20、30、40、50、60 min测定吸光度,RSD =0.39%,表明溶液在60 min内稳定。
(4) 加样回收率试验 精密吸取0.5 mL浓度 为69.49 μg/mL供 试 品 溶 液6份 于10 mL试 管中,分别加入0.5 mL浓度为70.8 μg/mL的对照品溶液,按方法显色,测定吸光度,测得平均回收率为97.77%,RSD为0.87%。
3.2.3 正交试验结果 由表6可知,加曲量的均方值最大,即加曲量对糖化液中还原糖含量影响最大,其次为糖化温度,最后为糖化时间,即A>C>B。由表7分析可知,因素A具有显著影响(P<0.05),而B、C不具有显著影响(P>0.05)。最终确定最佳糖化工艺为A3B3C2,即加曲量为14%、糖化时间为50 min、糖化温度为65 ℃。
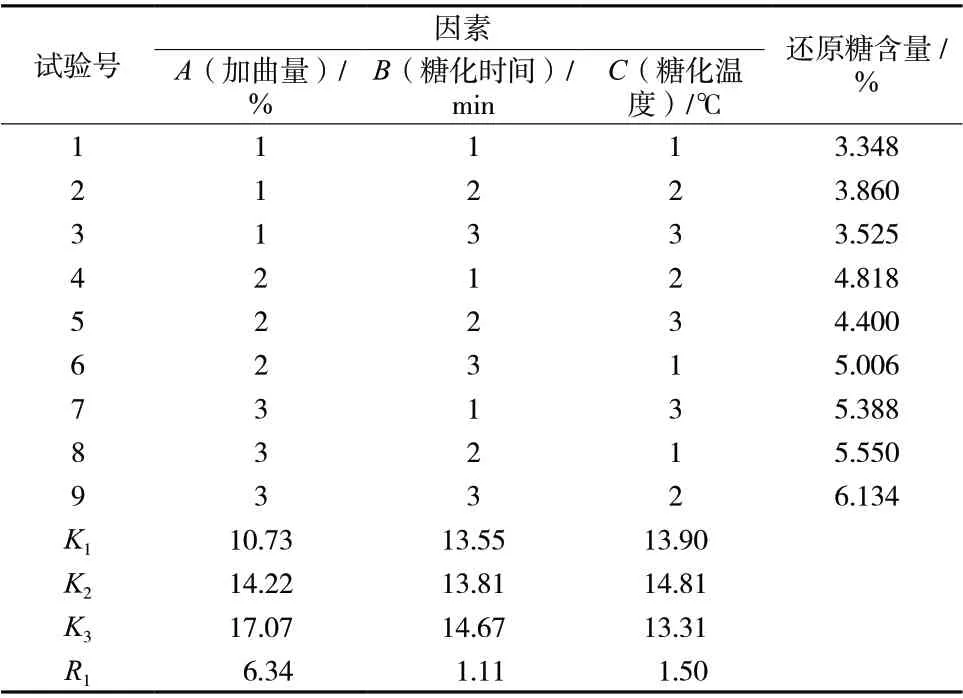
表6 糖化工艺正交试验结果表Tab. 6 Table of orthogonal test results of saccharification process
3.2.4 正交试验验证 按“3.2.3”项下最佳工艺进行 3 批验证试验,结果见表8,还原糖含量RSD<3%,表明该工艺稳定可行。
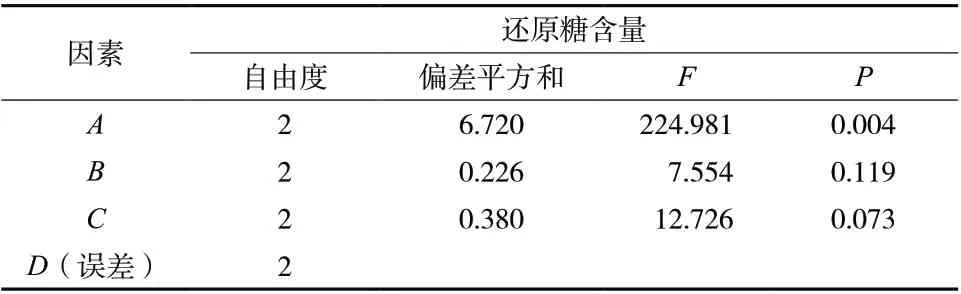
表 7 糖化工艺正交试验结果方差分析表Tab. 7 Orthogonal test results ANOVA table of saccharification process

表8 糖化工艺验证(n = 3)Tab. 8 Process validation of saccharification process(n = 3)
4 讨论
中药酒剂,也称药酒,属于中药的传统剂型,使用历史悠久。《中国药典》规定药酒为蒸馏酒提取制成的澄清液体制剂。蒸馏酒古称“烧酒”,《本草纲目》载“烧酒,味辛、甘,性大热,有大毒”[25]。而高度蒸馏酒导致的安全性问题正是制约其临床应用的关键因素。臧贵勇等[26]研究了水族抗痹症药酒的急性毒性,结果显示抗痹症药酒小鼠一次经口给药 LD50=29. 664 mL/kg,白酒对照组小鼠一次经口给药 LD50=27. 222 mL/kg,说明白酒是导致药酒毒性的关键因素。现代药酒的生产多是以粮食白酒为酒基,配以多种药材经过浸泡、勾兑而成。以传统酿造法制备的药酒不仅酒精度低,对人体危害小,而且在酿造过程中引入原料米的活性物质,具有安全、健康、口感丰富的特点,符合现代人追求的养生保健生活方式。
酿造法制备药酒是我国传统药酒制备方法,《本草纲目》中记载的68个药酒均是以酿造法制备。回顾药酒的起源和发展,得到两点认识:一是在古代至少清代以前“酒”指的是酿造法制备而来的低度酒,药酒的溶剂也是酿造法制备而来的低度酒;二是酿制法工艺是古代药酒生产的主要工艺。进入现代,工业化规模化生产的药酒已经取代了小作坊生产,灭菌工艺成熟,制约酿制法工艺的技术因素已经不复存在,可以考虑将酿制法工艺重新引入药酒的生产。
5 结论
本研究以古籍《外台秘要》中记载的五加皮酒方为基础,从处方沿革、药材基原、药材炮制及计量考证对传统五加皮酒进行处方考证,对传统发酵型五加皮酒制备工艺中的五加皮水提工艺和糖化工艺进行了优化,并验证了这两个工艺的可行性,为传统发酵型五加皮酒的制备研究提供了初步的实验依据。

