胃癌组织中YAP、VGLL4蛋白表达与临床病理特征的相关性分析
管瑛瑛 陈桓 鲁华东
(复旦大学附属中山医院厦门医院 福建厦门 361015)
胃癌是临床发病率较高的一种起源于胃黏膜上皮细胞的恶性肿瘤,其发生率与死亡率分别位居我国所有恶性肿瘤的第二位与第三位。近年来,随着医疗诊断与治疗水平的不断提高,胃癌患者的预后及生存时间均有所提高,但其发生率仍呈持续上升趋势[1]。有研究发现,胃癌的发生、发展与环境、遗传、幽门螺杆菌感染等因素密切相关,且多因素、多步骤的共同参与可导致胃癌患者的预后相对较差[2]。目前,临床多认为胃癌的转移是导致患者预后不良及病死的主要原因之一,其主要的机制是癌基因的突变激活,导致多条信号通路改变,从而致使细胞之间的黏附能力下降、接触性抑制减弱,增加细胞侵袭能力。随着临床分子生物学研究水平的日益提高,越来越多的学者证实,蛋白基因的表达异常与胃癌患者的临床病理特征及预后存在一定关系[3~4]。其中转录共激活因子相关蛋白(YAP)作为Hippo信号通路的核心效应因子,也是多功能细胞内连接蛋白与转录共激活因子,在正常机体中可发挥信号转导与基因转录调控的作用[5]。转录辅助因子退变样蛋白4(VGLL4)也是Hippo信号通路的成员之一,国外有学者研究发现,VGLL4可抑制YAP蛋白表达活性,从而控制肿瘤细胞的增殖[6]。本研究分析胃癌组织中YAP、VGLL4蛋白表达与临床病理特征的相关性。现报道如下:
1 资料与方法
1.1 一般资料 回顾性分析医院2018年3月至2021年12月收治的胃癌患者103例的临床资料。其中男66例,女37例;年龄47~78岁,平均(61.48±5.17)岁;肿瘤直径2~8 cm,平均(4.43±0.87)cm;胃癌TNM分期,Ⅰ期14例,Ⅱ期21例,Ⅲ期48例,Ⅳ期20例;组织学分级,G1~G2级36例,G3级67例;淋巴结转移32例。本研究经复旦大学附属中山医院厦门医院医学伦理委员会批准。
1.2 纳入与排除标准(1)纳入标准:符合《胃癌规范化诊疗指南(试行)》[7]中胃癌相关诊断标准,并经胃组织活检确诊;癌旁组织为距离癌组织病变病灶>5 cm的标本;临床资料完整。(2)排除标准:合并凝血功能障碍者;检查前已接受相关治疗者;合并免疫系统疾病者;合并其他恶性肿瘤者;精神及认知功能障碍无法配合检查者。
1.3 检查方法 在取得患者癌组织及癌旁组织的标本后,重新制备切片并进行苏木精-伊红(HE)染色,厚度为4μm,由2位经验丰富的病理科医师对病理诊断报告及切片组织学分型进行审核,以最大程度减少研究结果的偏差。VGLL4抗体购自上海梵态生物科技有限公司,兔抗人YAP多克隆抗体购自艾美捷科技有限公司。行免疫组织化学(SP)法检测,所有流程严格按照说明书完成。YAP稀释浓度为1:100(一抗),VGLL4稀释浓度为1:200(一抗),将已知的阳性组织切片作为阳性对照组,使用磷酸缓冲盐溶液(PBS)代替一抗做阴性对照组,每例取一张切片做HE染色观察形态。
1.4 判定标准 YAP、VGLL4蛋白的着色部位主要为细胞核,部分可见着色部位为胞浆。使用阳性细胞比例与着色强度两项计分法对阳性结果进行评估。染色强度评分,其中0分表示无色,1分表示淡黄色,2分表示棕黄色,3分表示棕褐色。阳性细胞百分比按照5级进行划分,0分表示无阳性细胞,1分表示阳性细胞<25%,2分表示26%≤阳性细胞≤50%,3分表示51%≤阳性细胞≤75%,4分表示阳性细胞>75%。将两种蛋白着色强度积分相加为最终判定结果,即0分为“-”,2~3分为“±”,4~5分为“+”,6~7分为“++”,将结果为“+”及“++”判定为阳性。将结果<4分纳入低表达组,将结果≥4分纳入高表达组。
1.5 观察指标 收集所有患者性别、年龄、组织学分级、TNM分期、淋巴结转移、侵袭性及肿瘤大小等临床病理特征,采用Spearman相关性分析胃癌患者中YAP与VGLL4蛋白表达的相关性,分析胃癌组织中YAP、VGLL4蛋白表达水平与临床病理特征的相关性。
1.6 统计学方法 采用SPSS22.0统计学软件进行数据处理。计数资料用%表示,比较采用χ2检验;采用Spearman直线相关性检验胃癌患者中YAP与VGLL4蛋白表达的相关性。以P<0.05表示差异具有统计学意义。
2 结果
2.1 YAP、VGLL4蛋白在胃癌组织与癌旁组织的表达情况 癌组织中YAP蛋白阳性表达率高于癌旁组织,而VGLL4蛋白阳性表达率低于癌旁组织(P<0.05)。见表1。

表1 胃癌患者不同组织YAP、VGLL4蛋白表达情况[例(%)]
2.2 胃癌YAP、VGLL4蛋白表达与临床病理特征的相关性 不同性别、年龄、肿瘤大小的胃癌患者YAP、VGLL4蛋白表达相比,差异无统计学意义(P>0.05),不同组织学分级、TNM分期及淋巴结转移胃癌患者YAP、VGLL4蛋白表达相比,差异有统计学意义(P<0.05)。见表2、表3。

表2 胃癌YAP蛋白表达与临床病理特征的相关性[例(%)]
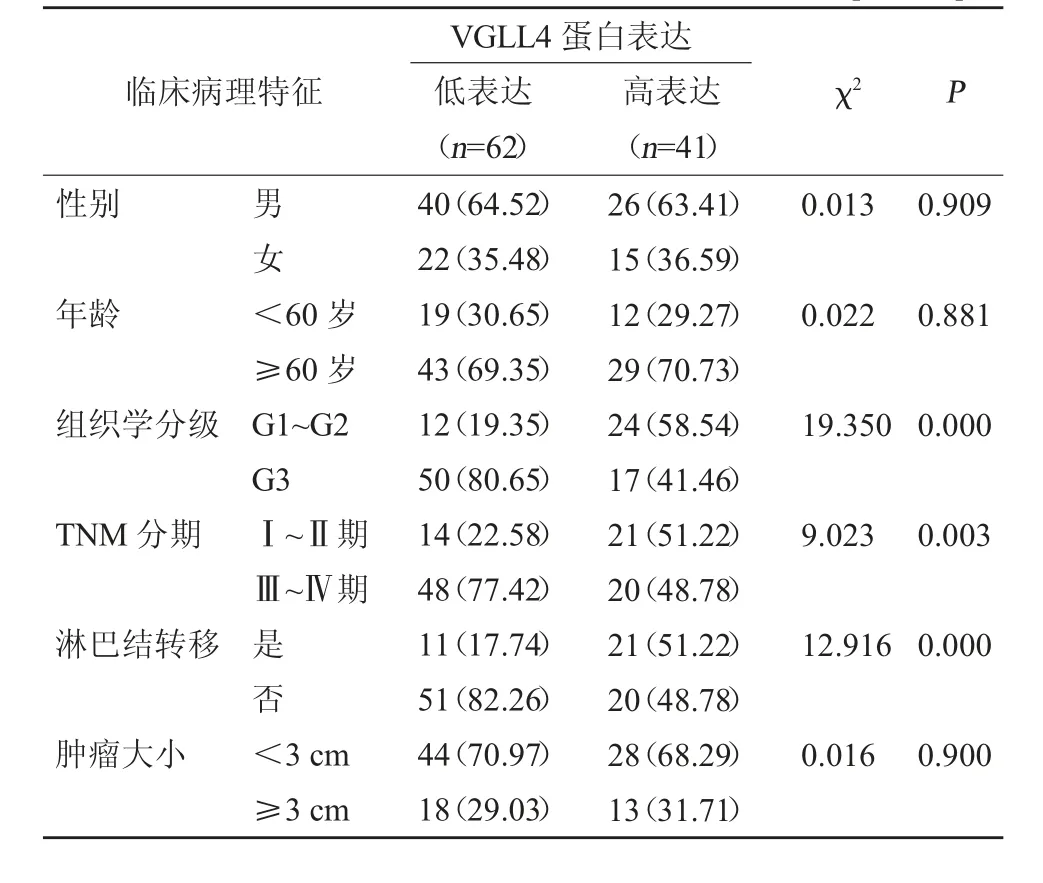
表3 胃癌VGLL4蛋白表达与临床病理特征的相关性[例(%)]
2.3 胃癌组织YAP、VGLL4蛋白表达的相关性分析 经Spearman直线相关性检验,胃癌YAP、VGLL4蛋白表达呈负相关性(r<0,P<0.05)。见表4。
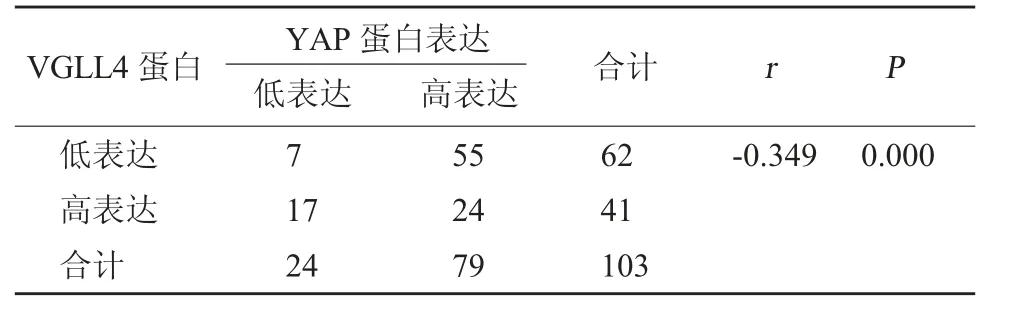
表4 胃癌组织YAP、VGLL4蛋白表达的相关性分析(例)
3 讨论
相关数据显示,早期胃癌的术后5年生存率高达90.9%。但晚期患者仍缺乏有效的治疗手段,即使采用综合治疗进行干预,其5年的生存率仍低于30%。大部分的胃癌患者早期多无明显症状,或仅出现上腹不适、嗳气等非特异性症状,常与胃部其他疾病混淆,故早期胃癌的诊断率相对较低[7]。近年来,临床研究发现,胃癌的发生机制涉及癌基因及抑癌基因的表达,可通过观察与胃癌发生发展相关的基因蛋白表达,从而明确其发生的机制,有利于诊疗方案的制定,从而改善患者的预后[8]。
胃癌的发生与发展主要机制与癌基因的突变激活密切相关,其机制可能是癌基因的信号通路改变抑制了细胞之间的黏附能力。YAP被认为在肝癌、结肠癌等多种癌症疾病中呈高表达,且蛋白活性增强,并参与了肿瘤的侵袭、淋巴结转移等过程[9]。VGLL4是临床发现的原癌蛋白YAP拮抗因子,其可通过与YAP绑定转录增强相关结构域蛋白(TEADs),对过度激活的YAP-TEAD信号胃癌细胞增殖与侵袭起到抑制作用,从而控制肿瘤的发展[10~12]。本研究结果显示,癌组织中YAP蛋白阳性表达率高于癌旁组织,VGLL4蛋白阳性表达率低于癌旁组织,YAP、VGLL4蛋白表达与胃癌患者性别、年龄及肿瘤大小无关,与组织学分级、TNM分期及淋巴结转移有关,结果提示胃癌组织中YAP蛋白呈高表达、VGLL4蛋白呈低表达,且二者表达均与组织学分级、TNM分期及淋巴结转移等临床病理特征存在一定相关性。分析原因可能为:(1)YAP可通过控制细胞的增殖与凋亡之间的平衡,从而调控肿瘤的发展。在一般情况下YAP多以低表达甚至不表达出现在正常组织中,而当机体组织器官发生异常变化后,则会激活之前不表达的YAP蛋白,经转录共激活因子与TEAD受体相结合后诱导靶基因的表达,发挥调控细胞增殖与凋亡的功能,从而进一步促进肿瘤的发生。Pearson JD等[13]研究发现YAP参与肿瘤的发生发展,在机体的组织器官中扮演致癌基因角色,其表达活性提高、活性增强可促进细胞转化为恶性。另外,根据YAP蛋白的是否存在可将临床所有癌症分为两类,为临床治疗最具侵袭性与无法治愈的类型提供了重要参考。(2)VGLL4是近年来临床发现的原癌蛋白YAP的竞争对手,其可与TEAD4结合从而控制YAP的活性开关,而下调YAP蛋白的活性可抑制肿瘤细胞的增殖。
相关研究[14]发现,通过解析VGLL4与TEAD4形成的复合物三维结构可发展为YAP蛋白的针对性抑制剂,抑制剂可阻滞胃癌细胞的增殖及生长,均提示VGLL4在胃癌组织中表达较低。经Spearman直线相关性检验发现,YAP、VGLL4蛋白在胃癌患者中呈负相关表达,结果提示YAP、VGLL4蛋白在胃癌组织中存在负相关关系,临床可对两者蛋白表达进行监测,从而了解胃癌患者的临床病理特征,以制定诊治方案。韩新影等[15]采用免疫组织化学SP法对46例胃癌患者的癌组织及癌旁组织进行检测发现,VGLL4、YAP蛋白表达均与胃癌患者的肿瘤恶性程度存在一定关系,且可影响患者的中位生存时间,这与本次部分研究结果近似。
综上所述,胃癌组织中YAP、VGLL4蛋白表达与临床病理特征存在一定相关性,其中YAP蛋白表达与肿瘤的发展及恶性程度呈正相关,而VGLL4蛋白表达与肿瘤的恶性程度呈负相关。但本研究仍存在一定不足:如研究属于回顾性分类,故统计分析结果可能存在一定偏倚;未对YAP、VGLL4分子表达水平与胃癌患者预后相关性进行分析,两者之间的相互作用机制仍无法明确。故未来期待大样本量、多中心的前瞻性随机对照研究,以证实本研究的结论。

