螺旋CT联合MRI在评估肝癌TACE术后病灶残留及随访中的临床应用价值
杨莎莎,钟华成
随着介入治疗在临床上的应用兴起,微创介入治疗作为非外科治疗肝癌的首选方法,治疗效果良好,有效地改善了患者的生存质量,延长了生存时间[1]。经介入治疗后的肝癌患者在其临床特征表现上较治疗前有明显好转,而对于患者的预后及肿瘤复发风险的高低在肝癌疾病生物学特性上同样不容忽视。因此,介入治疗术后方案及时有效地调整的关键一步是准确地对病灶活性作出判断。在医学影像辅助检查中,显示血管较佳的检查技术为数字减影血管造影(digital subtraction angiography,DSA),在血管检查上公认是“金标准”[2,3]。对于常规随访检测并不提倡,因为其行检查流程较复杂繁琐,涉及到造影剂的推注、专门的检查设备和需要专业操纵检查仪器的技师[4]。因此,笔者以DSA的检测结果作为金标准,收集115例经导管肝动脉化学治疗栓塞术 (transcatheter arterial chemoembolization,TACE)术后患者活性病灶数量采用的检查方法是螺旋CT和MRI,并进行比较分析螺旋CT和MRI的影像学特征,MRI在残留活性病灶监测的价值上明显高于螺旋CT,在肿瘤包膜上螺旋CT稍有优势,二者联合可优势互补,诊断效能明显提高。
1 资料与方法
1.1 临床资料
选择2019年2月至2020年10月在第九〇九医院就诊的经病理诊断并接受TACE治疗的95例肝癌患者,其中女性16例,男性79例;年龄35~83岁,平均年龄56.35岁(标准差6.56岁);病灶数量为115个,其中单发87例,多发28例。所有患者均行DSA、螺旋CT、MRI的影像学检查。
排除标准:并发其他恶性肿瘤或有严重器质性病变者;曾有肝癌切除手术史或作过有创检查史;有其他肿瘤病史内科用药物治疗者。
1.2 方法
1.2.1 数字减影血管造影方法
使用美国GE Innova 3100IQ DSA进行检查。患者平卧于DSA检查床上,嘱护理人员术前先对患者的血压、心电图、血氧和心率等进行常规监护,使用面罩吸氧,检查患者呼吸道并保持通畅。接着手术医生对患者的双侧腹股沟穿刺区域进行常规外科消毒,有序铺手术床巾,穿刺点通常选取在腹股沟韧带下1.0 cm股动脉明显搏动处,进行局部浸润麻醉,穿刺区域注射2%盐酸利多卡因5 mL,在患者的右侧(或左侧)股动脉采用改良式Seldinger技术经皮穿刺进行DSA检查。准确穿刺股动脉后立即将血管动脉鞘置入,送入RH导管(一种肝动脉导管),导管远端到达腹腔干和肠系膜上行动脉再进行造影,查明了解病变所在具体部位、大小、单发或多发、来源哪支动脉供血及肿瘤血管的分布情况。将3 F微导管插入肿瘤供血动脉进行超选择性造影,目的是对来源动脉供血支和肿瘤血管的分布情况更清楚地显示。将导管头端插入病灶体后经导管灌注化学治疗药物(MMC、DDP、THP、5-FU、BLM等)或栓塞剂(碘化油乳剂、明胶海绵、弹簧栓子、药物微球等),使肿瘤内填满化学治疗药物或栓塞剂[5~7]。再进行造影检查,目的是查看血管的闭塞情况,评估并记录残余病灶染色情况。碘油不良沉积或强化沉积情况明显是残留活性病灶的评估标准[8]。
1.2.2 螺旋CT检查
螺旋CT检查采用日本东芝320排640层螺旋CT(AQUILION/ONE)。常规取仰卧位,患者平卧于检查床上,腹部正中矢状面垂直于扫描床平面并与床面长轴的中线重合,双臂上举抱头,检查前对患者进行呼吸、屏气训练,一般为深吸气后于呼气末屏气扫描。采用头先进的扫描体位,扫描范围为膈顶至肝脏下缘,常规采用层厚5 mm、层间距5 mm,管电压100~120 kV,管电流250~300 mA,螺距1.375∶1。增强扫描使用碘克沙醇注射液非离子型对比剂,浓度为320 mgI/mL,用量为75~150 mL;双筒高压注射器推注,采用冲管技术,注射流率为3~4 mL/s。延迟时间为肝动脉期25~30 s、肝门静脉期为60~70 s、肝延迟期为120~180 s[9,10]。
1.2.3 MRI检查
MRI检查采用德国西门子Magnetom Verio 3.0 T MRI扫描机,配用体部相控阵线圈。患者仰卧,身体长轴与床面长轴一致,头先进,双臂上举过头或置于身体两侧,双膝后方垫坡垫。将呼吸补偿感压器置于呼吸幅度最大部位(一般为上腹正中),加腹带时要松紧适度。扫描范围自膈顶至肝脏下缘,主要的检查方位是横轴位、冠状位,矢状位作为辅助检查方位。采用的主要扫描方案有呼吸触发T2加权成像(T2weighted image,T2WI)脂肪抑制序列,屏气双回波T1加权成像(T1weighted image,T1WI),呼吸触发扩散加权成像(diffusion weighted imaging,DWI)b=600~800 mm2/s,呼吸触发冠状位T2WI脂肪抑制序列和DWI。增强扫描使用钆喷酸葡胺注射液,用量为0.2 mL/kg,流速为3.0~4.0 mL/s,扫描方案为屏气横轴位肝脏容积加速采集(liver acquisition with volume acceleration,LAVA)Mask,屏气横轴位LAVA三期动态增强,屏气冠状位LAVA和屏气横轴位LAVA延迟扫描。
1.2.4 评价方法
抽调5名长期从事医学影像诊断专业高年资的医师对两种检查方法与DSA检查结果进行双盲阅片。评审结果参考DSA检查结果作为金标准,对比分析螺旋CT和MRI所检出的病灶总数量和残留活性病灶数量,并通过受试者工作特性(receiver operating characteristic,ROC)曲线分别计算不同检查方法的ROC曲线下的面积(area under the ROC curve,AUC),进行比较分析。
1.3 统计学方法
采用统计学软件SPSS 20.0对所得数据进行处理。组间的基本资料比较以均数±标准差表示,采用t检验。所检测出的病灶数量和残留活性病灶数量进行χ2检验,计数数据采用n(%)表示。P<0.05为差异具有统计学意义。
2 结果
2.1 典型影像特征
对95例患者的115个病灶采用螺旋CT和MRI两种方法进行评估检查。螺旋CT显示为碘油在病灶区域不良沉积或者强化明显(图1A、B、C);MRI检查图像在DWI上主要显示为高信号(图1D),而在表观扩散系数(apparent diffusion coefficient,ADC)上主要显示为降低或者强化明显(图1E)。

图1 56岁男性患者TACE术后螺旋CT与MRI复查肿瘤复发典型特征影像Fig.1 Typical imaging features of tumor recurrence after TACE in 56-year-old male patient by spiral CT and MRI
2.2 螺旋CT和MRI与DSA检查结果对比
95例患者检出共115个病灶,经TACE治疗有38个活性残留病灶。3~4周后行螺旋CT、MRI和DSA的检查。DSA检查发现肝癌病灶有115个,包括38个残留活性肿瘤病灶。螺旋CT检查发现肝癌病灶108个(93.91 %),其中残留活性病灶数量28个(73.68%);与DSA检查结果比较,差异有统计学意义(P<0.05)。MRI检查发现病灶113个(98.26%),残留的活性病灶数量为36个(94.74 %);与DSA检查结果比较相近,两者间差异无统计学意义(P>0.05)。此外,螺旋CT联合MRI应用,检测病灶数量115个(100.00%),其残留活性病灶数量38个(100.00%)。螺旋CT联合MRI检查与DSA检测结果一致,差异无统计学意义(χ2=0.001,P<0.999)。见表1。

表1 螺旋CT与MRI对病灶数量的评估情况对比Tab.1 Comparison of spiral CT and MRI in evaluation of lesion numbers
2.3 受试者工作特性曲线评价
对比分析螺旋CT和MRI所检出的病灶总数量和残留活性病灶数量,并通过ROC曲线分别计算不同检查方法的ROC AUC并比较分析。结果螺旋CT、MRI AUC分别为0.732±0.053、0.985±0.046。两组比较,差异有统计学意义(P<0.05)。见表2。
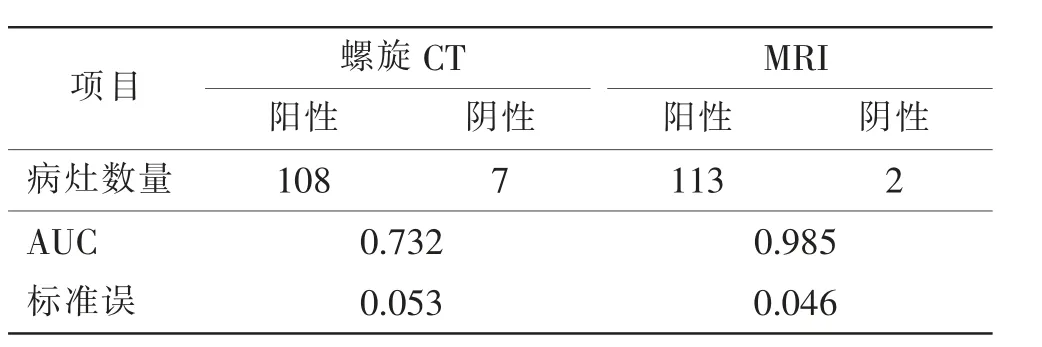
表2 螺旋CT和MRI检查ROC曲线评价Tab.2 Evaluation of ROC curve in spiral CT and MRI examination
3 讨论
肝癌在行TACE治疗术后仍有部分患者的预后不容乐观,会出现复发及转移的可能,这主要是肿瘤内仍残留活性病灶[11,12]。临床上证明TACE用于治疗肝癌有效,但是肿瘤所处的具体部位、肿瘤大小和肿瘤单发(或多发)等因素影响着TACE的有效程度。因此,肝癌患者行TACE治疗后第一时间得知有无活性肿瘤病灶残留是相当重要的[13]。而DSA肝动脉造影是一种较为有效、可用于评估肝癌患者病灶的检查方法,它的优势在于可以准确表现患者体内残留肿瘤血液供应,但它不适于作为常规随访检查手段,主要原因是其操作较为复杂[14]。因此,临床往往会考虑超声造影来评价肝癌患者在TACE治疗术后的病灶变化情况,主要考虑到超声设备容易操作性,且没有X射线照射对人体的损伤,检查重复性强和检查经济。然而超声造影检查对于TACE治疗后有无残留肿瘤活性检测上在临床上不容乐观,易受检查器官本身自主与不自主随呼吸运动、心脏搏动等相关因素的影响,最终导致所检出活性病灶的数量有限,容易漏诊,贻误治疗[15]。
随着影像技术的快速发展,螺旋CT和MRI也逐渐被临床接受并用于检查肝癌活性病灶的监测。螺旋CT的优势在于组织的密度分辨率高,可以较为清楚地观察碘油在病灶中沉积情况,对TACE术后肿瘤活性病灶监测采用的检查方法为常规平扫后立即作动态增强扫描,扫描出的图像可以看到病灶区有呈高密度影的碘油沉积,但是沉积的碘油会产生伪影,这种伪影难免会遮挡部分增强的肿瘤血管影,还有会对部分肿瘤残留造影漏诊,这会影响CT的影像表现,肿瘤活性病灶的监测误差就会变大[16]。MRI优势在于对肿瘤软组织检查成像有较高的辨别能力,可以消除碘油对成像的影响,在恶性肿瘤的早期显示,对血管的侵犯及肿瘤的分期方面优于螺旋CT,还有其可以多序列成像、多种图像类型,为明确病变性质提供更丰富的影像信息,因此MRI有诸多的优势成像用于对TACE治疗术后肝癌肿瘤活性病灶的监测给予评估是比较有效的[17]。
笔者研究95例患者行螺旋CT检查所监测到的病灶数量为108个(93.91%),其中残留活性病灶数量28个(73.68%);同DSA检查结果比较,差异有统计学意义(P<0.05)。而在MRI多种图像类型观察认为,行TACE治疗术后肿瘤凝固坏死区在T1WI上呈高信号、T2WI上呈等低信号,对于肿瘤脂质聚集区不管在T1WI还是在T2WI上都是显示高信号,而组织坏死液化后或者病变所在区域在T1WI上呈低信号,T2WI上呈高信号区[18]。因此,若在MRI功能性成像技术的DWI上呈高信号,而在局部组织的ADC值上是降低的,这种影像表现证实有活性病变残存;若进行MRI动态增强扫描发现肿块中央区可见组织有不同程度地强化,这种增强扫描表现方式说明此区域存在活性肿瘤病灶。对比分析螺旋CT和MRI所检出的病灶总数量和残留活性病灶数量,并通过ROC曲线分别计算两种不同检查方法的ROC AUC进行比较,计算出的增强扫描螺旋CT和MRI的ROC AUC分别为0.732±0.053、0.985±0.046,从结果数据中可得知MRI扫描的ROC AUC明显较螺旋CT的大,差异有统计学意义(P<0.05),MRI的准确度更高。
综上所述,对肝癌患者行TACE治疗术后疗效监测以DSA造影检查残留活性病灶阳性结果为金标准,对比分析采用螺旋CT和MRI在肝癌TACE术后临床疗效残留活性病灶监测结果,经过比较分析可知MRI检查对肝癌TACE术后肿瘤残留活性病灶监测能效明显优于螺旋CT。而二者联合应用检查明显高于单一的影像学检查方法,其监测结果与DSA检测结果一致,检查结果更能提供临床对肝癌TACE术后疗效作出准确的评估,使临床更好地为肝癌患者作更详细的下一步治疗计划和方案,提高患者更长的生存周期,具有重要的临床应用价值。

