杰米拉类芽孢杆菌W51 对桃果实采后病害防治及保鲜效果研究
朱晶凤,高玉侠,李习冉,刘 藻,韦 欢,王云鹏,王晓莉*
(1.淮阴工学院生命科学与食品工程学院,江苏省益生菌制剂重点实验室,江苏淮安 223003;2.淮安市淮安区农业技术推广中心,江苏淮安 223200)
我国是桃子的原产国,种植面积广、种类繁多,广泛分布于我国江苏、浙江、山东等多个省份[1]。近年来,桃子作为经济型水果,种植面积不断扩大,产量也在快速增加。2019 年数据显示,我国桃子的种植面积已达89 万hm2,总产量达到了1 599.3 万t,位居世界第一[2]。桃子色、香、味俱全,尤其因营养丰富、肉嫩汁多、香气独特而倍受广大消费者的喜爱[3]。桃子采收时间正值夏季高温,采后代谢旺盛,果实的自然衰老、软化以及生理失调会影响果实组织结构[4]。在采摘期以及后期运输贮藏过程中又极易受到真菌的侵害,病原菌能够从果实表面机械损伤处侵入果实,生长繁殖过程中所分泌的果胶酶能够分解果实细胞初生壁和中胶层中沉积的大量果胶,从而破坏细胞,使果实松弛、软化、水分外渗、硬度下降[5],导致其耐贮性差,甚至腐烂变质,缩短货架期[6]。
目前常见的采后病害防治方法有化学防治、物理防治和生物防治。然而化学防治中长时间使用杀菌剂使病原菌耐药性增强,果实体内农药残留增加。物理防治中的低温贮藏、气调贮藏以及热处理等,均可以达到防治效果,但是在低温条件下贮藏过久,果实容易遭受冷害或冻害;气调减压贮藏等方法投资较大,成本过高,不适合小批量贮藏;热处理的温度以及时间等难以控制[7-8]。近年来,生物防治因其成本低、操作简单、安全有效等优势,被认为是最具潜力的采后防治方法[9]。不同的生防菌对果蔬采后病害的防治机制是不一样的,目前为了使拮抗菌发挥其在采后生物防治中的潜力,研究者们致力于探究生防菌的作用机制。众多研究显示,生防菌主要通过直接抑制病原菌生长、与病原菌竞争营养或者分泌抗菌物质、诱导有机体产生抗病性等对果蔬采后病害起到防控的作用。蔡傅红等[10]研究发现,生防菌W51 对番茄青枯病有很好的防治效果。本文研究了生防菌W51 对桃果实采后病害的防治效果,为生防菌在果蔬采后保鲜及贮运中的开发应用提供理论支持。
1 材料与方法
1.1 材料与试剂
桃品种为‘突围’,采摘于江苏金绿源寻味乐园有限公司。采摘后立即运回实验室,选择成熟度和大小一致、无机械损伤、无病害的桃为供试果实。
PDA 培养基,环凯微生物公司。称取本品干粉39 g,加入蒸馏水1 L,搅拌加热煮沸至完全溶解,121 ℃高压灭菌15 min。
乙酸-乙酸钠缓冲液,含29 mg 1 mmol/L 的EDTA、35 μL 5 mmol/L 的β-巯基乙醇。
1.2 W51 及菌悬液的制备
试验所用菌为W51 株(发明专利授权号ZL201910933964.4),由实验室提供。吸取100 μL 的W51于LB 平板上涂板活化,培养方法参照蔡傅红等[10]。随后将发酵液进行常温离心(10 000×g、15 min),弃去上清液,沉淀部分用无菌水悬浮并稀释至1×108CFU/mL,备用。
1.3 病原菌及孢子悬浮液的制备
R.stolonife分离于自然发病的桃果实,在PDA 培养基上28 ℃活化2 d,用10 mL 的无菌水洗下孢子,利用血球计数板计数,用无菌水将孢子悬浮液浓度稀释至1×105CFU/mL,现配现用。
1.4 W51 对R. stolonife 的抑制作用
将2.5 mL 的W51 悬液与50 mL PDA 培养基混匀,倒入培养皿中,制备平板。挑取少量R.stolonifer接种于平板中央,28 ℃培养24 h,对照组为不加W51 的培养基培养的R.stolonifer。参考袁梦思等[11]的方法计算抑菌率,如式(1)所示。

式中,IR 为抑菌率,%;A为对照菌落半径,cm;B为处理菌落半径,cm。
1.5 试验设计
用75%乙醇对供试桃子进行表面消毒,自然晾干后,在桃子赤道部等距处穿刺2 个孔,孔深4 mm,直径2 mm。定量注射1×108CFU/mL W51 悬液15 μL(对照组为无菌水)。24 h 后,每孔再注入1×105CFU/mL 根霉孢子悬液10 μL。自然风干后,将已接菌种的果实装入聚乙烯袋中,置于(20±1)℃、相对湿度为80%条件下,贮藏3 d。每天统计果实的发病率和病斑直径。每组处理30 个桃子,重复3 次,每天取样后用液氮速冻,放于-80 ℃冰箱储存,用于指标的测定。
1.6 测量指标与方法
1.6.1 桃子品质指标测定
桃子硬度采用GY-3 指针式水果硬度仪测定,结果以牛顿(N)单位表示。总可溶性固形物(totalsolublesolid,TSS)含量测定采用便携式糖度计(PAL-1),数据以百分比表示。可滴定酸(titratable acid,TA)含量测定采用酸碱滴定法,结果以苹果酸百分数表示[12]。维生素C(VitamineC,VC)含量测定采用2,6-二氯靛酚滴定法[13],结果以mg/kg表示。
1.6.2 丙二醛(malondialdehyde,MDA)含量的测定
参照Jiao 等[14]的方法测定。
1.6.3 氧化应激相关酶活测定
活性过氧化物酶(peroxidase,POD)活性测定参照Wang 等[15]的方法。多酚氧化酶(polyphenol oxidase,PPO)以每分钟反应体系在波长420 nm 处吸光值变化增加1 时所需要的酶量为一个酶活单位[16]。过氧化氢酶(catalase,CAT)活性采用Liu 等[17]的方法。超氧化物歧化酶(superoxidedismutase,SOD)活性的测定参照李易初等[18]的方法。
1.6.4 几丁质酶(CHI)和β-1,3-葡聚糖酶(GLU)活性测定
参照Ahmed 等[19]的方法,略作修改。
CHI:称取1 g 样品,加5 mL 预冷的乙酸-乙酸钠缓冲液,冰浴研磨匀浆,4 ℃离心后取上清液。利用二甲氨基苯甲醛测定CHI 催化水解过程中产生的N-乙酰葡萄糖胺的生成量来反应CHI 的活性。
GLU:将0.1 mL 粗酶液和0.1 mL 的昆布多糖混合,在37 ℃下保温40 min,以煮沸5 min 的酶液作为对照。然后加入1.8 mL 蒸馏水和1.5 mL DNS 试剂,在沸水浴加热3 min,用蒸馏水稀释至25 mL 混匀,测波长540 nm处的吸光值。
1.6.5 总酚含量和DPPH 自由基清除能力的测定
参照Sheng 等[20]的方法测定总酚含量和DPPH 自由基清除能力。
1.7 桃果实转录组学分析
1.7.1 样品处理
共取三组样品,分别取自对照组的第0 天和第2 天以及W51 处理组的第2 天,三组样品分别命名为W_CK0 d、W_CK2 d 和W51_2 d。剥去果皮后,将果核和腐烂的果肉去除,将剩余的果肉切片剁碎,立即用液氮速冻,放于-80 ℃冰箱。每组样品2 个重复,保存于干冰中,送往天津诺禾致源科技股份有限公司进行转录组检测。
1.7.2 荧光定量PCR 验证分析
共取三组样品,分别取自对照组的第0 天和第2 天以及W51 处理组的第2 天,三组样品分别命名为W_CK0 d、W_CK2 d 和W51_2 d,每组样品3 个重复,实验重复2 次。采用逆转录PCR 试剂盒进行逆转录PCR(RT-PCR)后进行荧光定量PCR。按照Novozan 逆转录试剂盒(R223)说明书,用含2 μg Total RNA 的20 μL 反应混合物合成cDNA。以桃Actin基因为内参,以cDNA 为模板进行荧光定量PCR(Novozan qPCR 试剂(Q341))。循环条件,Stage1:95 ℃、90 s;Stage2:95 ℃、5 s,60 ℃、15 s,72 ℃、20 s;进行40 个循环。采用2-△△Ct法计算3 个生物重复中各基因的相对表达量[21]。引物序列见表1。

表1 引物序列Table 1 Sequences of primers
1.8 数据处理
采用Excel 2016 对数据进行统计分析,采用SPSS 26.0 软件对数据进行单因素方差分析(ANOVA),用邓肯法比较分析相关数据在显著水平0.05 时的差异,用Origin 2018 软件进行作图。
2 结果与分析
2.1 W51 处理对根霉的抑制作用
采用固体平板法,测量统计W51 对R.stolonifer菌丝生长的抑制作用。结果发现W51 对R.stolonife菌丝生长的抑制效果很明显,抑制率达到了75.00%。由图1 可以看出,在含有菌悬液的培养基上R.stolonife生长缓慢,只生长出非常稀薄的菌丝,而对照培养基上R.stolonife正常生长。

图1 W51 对根霉的抑制作用Fig.1 Inhibitory effect of W51 on R. stolonifer
2.2 W51 处理对桃子病害的防治效果
从图2 中可以直观地看出,W51 处理桃子的效果,抑制根霉病菌的扩散,有效抑制了软腐病的发生。图3显示,在贮藏第2 天,经过W51 处理的果实发病率为69.68%,低于对照组的96.66%。从贮藏第2 天开始,对照组的桃子出现不同程度的腐烂,果实的病斑直径已经达到(3.52±0.28)cm,而处理组的病斑直径仅为(0.85±0.08)cm。

图2 W51 处理对桃子病害的防控效果图Fig.2 Prevention and control effect of W51 treatment on peach disease
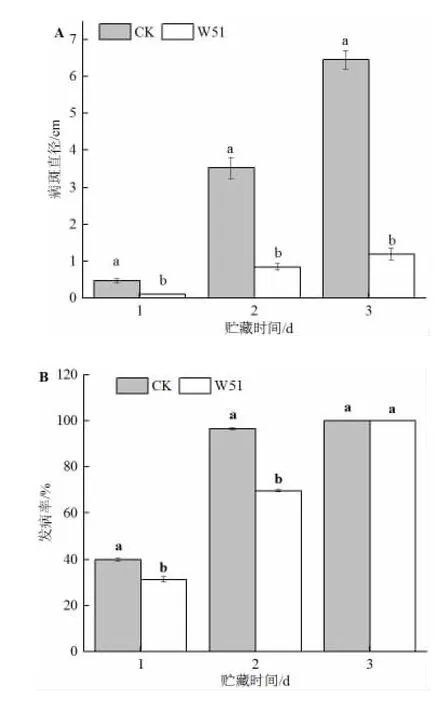
图3 W51 处理对桃子病斑直径(A)和发病率(B)的影响Fig.3 Effect of W51 treatment on disease spot diameter (A)and incidence (B) of peaches
2.3 W51 处理对桃子品质的影响
表2(见下页)中显示,接种R.stolonife之后,两组桃子的硬度都在下降,在贮藏第2 天,处理组的硬度是对照组的1.57 倍。在整个贮藏期间,TSS 含量逐渐升高。在贮藏第1 天,处理组的TSS 含量迅速上升,达到10.57%。接种R.stolonife后,VC 含量随贮藏时间的延长而降低,在贮藏第1 天,对照组的含量下降幅度较大,比第0 天时降低了34.46%,而处理组比第0 天时仅降低了10.32%。TA含量呈现先上升后下降的趋势,在第1 天达到峰值,处理组的含量达到了0.46%,是对照组的1.14 倍。

表2 W51 处理对桃子品质的影响Table 2 Effect of W51 treatment on fruit quality of peaches
2.4 W51 处理对桃子MDA 含量的影响
如图4(见下页)所示,两组桃子中的MDA 含量随贮藏天数的增加而增加。对照组MDA 含量在贮藏第2 天增加较快,达到了5.03 μmol/kg,处理组的含量增加较缓慢,达到了3.53 μmol/kg,分别是接种后第0 天的3.03 倍和2.13 倍。在整个贮藏期间,处理组MDA 含量始终低于对照组。

图4 W51 处理对桃子MDA 含量的影响Fig.4 Effects of W51 treatment on MDA content of peach fruit
2.5 W51 处理对桃子POD、PPO、CAT 和SOD 活性的影响
如图5 所示,随着贮藏时间的延长,POD、PPO 和SOD 酶活性均逐渐升高。在贮藏过程中,对照组的POD酶活性上升缓慢,而处理组的POD 酶活性在贮藏后期直线上升,是对照组的1.47 倍。在贮藏第2 天,处理组的PPO 酶活性达到了82.40 U/mg 蛋白质,比对照组高了32.31%。在接种后第1 天,处理组的SOD 酶活性直线上升,比对照组高了20.28%。CAT 酶活性在贮藏第1 天达到峰值,处理组的酶活性比第0 天的酶活性高了72.38%。


图5 W51 处理对桃子POD(A)、PPO(B)、CAT(C)和SOD(D)活性的影响Fig.5 Effects of W51 treatment on POD(A),PPO(B),CAT(C) and SOD(D) activities of peach fruit
2.6 W51 处理对桃子CHI 和GLU 活性的影响
由图6 可知,在贮藏过程中,桃子的CHI 和GLU 活性呈现上升趋势,在贮藏第2 天,W51 处理组的CHI 活性比对照组高50.60%,在贮藏第3 天,处理组是对照组的1.21倍。在贮藏第2 天,处理组的GLU活性比对照组高45.20%,贮藏第3 天,处理组的酶活性比对照组高了23.37%。
2.7 W51 处理对桃子总酚含量和DPPH 自由基清除能力的影响
如图7 所示,总酚含量在第2 天达到峰值,处理组的总酚含量达到3.18 mg/g,而对照组的总酚含量达到2.75 mg/g,分别是第0 天的2.23 倍和1.93 倍。在第2 天,对照组DPPH 的清除自由基能力下降的速度比处理组快,对照组下降了10.68%,而处理组仅下降了4.10%。

图7 W51 处理对桃子总酚含量(A)和DPPH自由基清除能力(B)的影响Fig.7 Effects of W51 treatment on total phenolic content(A)and DPPH free radical scavenging ability(B) of peach fruit
2.8 转录组测序结果与分析
2.8.1 过氧化酶体代谢通路分析
由图8、9(见下页)分析发现,编码ROS 代谢相关的PXMP2 蛋白的差异基因PRUPE_7G022300和PRUPE_4G018300,在第2 天时,W51 处理组的表达量发生上调,说明与对照相比,W51 处理可以诱导ROS 代谢相关基因表达量的升高。此外,POD 相关的基因(PRUPE_8G164400、PRUPE_1G186500)、SOD 相 关 的 基因(PRUPE_1G347200、PRUPE_7G005300)以及CHI 相关的基因(PRUPE_5G011400)也发生了上调,可能与桃子抗病性的增强相关。
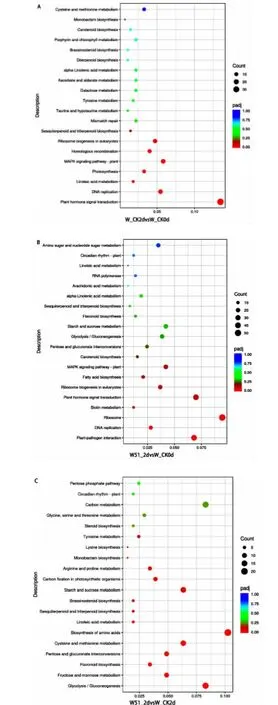
图8 三个比较组KEGG 富集分析气泡图Fig.8 Bubbles of KEGG enrichment analysis in the three comparison groups

图9 过氧化酶体代谢通路Fig.9 Peroxidase metabolic pathway
2.8.2 基因表达的定量PCR 分析
本研究筛选了3 个基因进行qRT-PCR 分析(图10)。这些基因为POD 相关的基因(PRUPE_1G186500和PRUPE_8G164400)和ROS 代谢相关的PXMP2 蛋白的差异基因PRUPE_4G018300。结果显示,在贮藏第2 天与第0 天相比三组相关基因都发生了上调,但是W51 处理组的基因上调明显高于对照组。

图10 差异表达基因的定量PCR 分析Fig.10 Quantitative PCR analysis of differentially expressed genes
3 结论
ROS 在植物-病原菌相互作用中可能的作用已被证实,如直接的抗菌活性、细胞壁糖蛋白的氧化交联、参与信号转导和基因表达[22]。在正常生理情况下,植物组织内ROS 的产生与清除维持在一个动态平衡状态,但是机械损伤、病害等逆境胁迫会诱导产生大量的ROS,参与植物的防御反应。而过多的ROS 积累对植物细胞具有毒害作用,植物也会通过提高自身ROS 清除系统的活性来抑制其积累,避免ROS 伤害[23]。本研究中,W51 处理诱导的CAT、和SOD 活性的增加形成了一种抗氧化体系,可以清除细胞环境中过量的H2O2,保护细胞免受氧化损伤。
现有研究表明,诱导果实抗病性可以通过激活抗病相关酶活性和相关基因的表达来达成。例如,β-氨基丁酸(β-Aminobutyric acid,BABA)处理提高CHI 和PAL 酶活性的同时,还诱导了CHI 和PAL 相关基因的表达,从而增强草莓的抗病性[24]。本研究发现在整个贮藏过程中,W51 处理组的抗病相关酶CHI 和GLU 活性始终高于对照组,说明W51 可能通过诱导桃果实抗病能力,从而减轻软腐病的发生。
综上所述,W51 可以有效控制桃果实采后腐烂的发生,并且能够保持桃子良好的品质。W51 可以诱导活性氧相关酶、抗病相关酶的活性,提高总酚含量的上升和DPPH 自由基清除能力。另外,W51 还上调抗病相关基因PRUPE_1G186500和PRUPE_8G164400和ROX 相关基因PRUPE_4G018300的表达。同时,体外研究也发现,W51 可以显著抑制R.stolonifer菌丝的扩展。这些结果表明,W51 对桃果实采后病害的防治和保鲜主要是通过直接诱导果实的抗病性,同时通过提升自身的抗氧化能力实现的。综上,本研究将杰米拉类芽孢杆菌W51 用于桃子采后病害防控,为生防菌处理在果蔬采后保鲜及贮运中的开发应用提供理论支持。

