青枯菌噬菌体RPZH6株系对烟草青枯病的生防效果及全基因组测序分析
林志坚,陈长江,周挺,顾钢*,胡方平,李春英,蔡学清*
(1.福建农林大学植物保护学院,福州 350002;2.福建农林大学计算机与信息学院,福州 350002;3.福建省烟草公司烟草科学研究所,福州 350003)
青枯雷尔氏菌(Ralstonia solanacearum)引起的作物青枯病是典型的维管束病害,该病菌可侵染番茄、辣椒和烟草等50多个科450余种作物,在我国长江流域及其以南地区普遍发生且有向北扩散的趋势,个别年份爆发流行,严重时甚至绝产[1-2]。自然状态下,青枯菌致病性、生理生化分化严重,寄主适应性强,属于土壤习居菌,给防治增加了难度[3],目前主要采用抗病品种、栽培管理、轮作换茬、化学防治等措施进行防治。
噬菌体(bacteriophage)是一类专化性极强的细菌病毒,广泛存在于自然界中[4],按生活周期可分为烈性噬菌体和温和性噬菌体。烈性噬菌体感染宿主菌后会裂解宿主菌释放子代,是细菌的天然杀手,能有效地控制宿主菌的种群数量[5]。噬菌体具有防控作物细菌性病害的巨大潜力,已应用于马铃薯黑胫病、玉米细菌性枯腐病、棉花黑枝病、梨火疫病等病害的防治[6]。Addy 等[7]从土壤中分离到一株肌尾噬菌体RsoM1USA,能显著抑制宿主菌的生长,但对番茄青枯病无防效;Wang 等[8]从生姜地中分离到一株能裂解青枯菌(演化型Ⅳ型)的烈性短尾噬菌体GP4,并进行了基因组测序分析;Van Truong 等[9]对长尾青枯菌噬菌体RS138 的基因组分析结果显示,其基因组全长41 941 bp,GC 含量65.1%,含56 个开放阅读框,不含tRNA;Ahmad 等[10]从青枯菌中分离到一株原噬菌体Rs551,噬菌体呈线状,长1 200 nm,宽7 nm,基因组全长7 929 bp,GC 含量61%,编码14 个开放阅读框,该噬菌体对其青枯菌的生长无影响,但能降低青枯菌的致病性从而推迟植株发病。近年来,尽管有很多青枯菌噬菌体被挖掘,但由于青枯菌的高度遗传多样性及噬菌体高度特异性,使得噬菌体对来源不同、类型不同的青枯菌表现出不同的侵染力[11-12]。因此,不同区域的青枯菌噬菌体在应用上有一定的局限性。为获得适合防治福建烟草青枯病的噬菌体,本课题组以福建烟草青枯病菌(Ralstonia solanacearum)为对象,从烟草根际土壤中分离获得一株烈性青枯菌噬菌体RPZH6,该噬菌体裂解谱广且对环境适应性强。为明确该噬菌体的生防潜力及分类地位,本研究测定了其生防效果并分析其全基因组序列,以期为该噬菌体的开发应用及其生防机制探讨提供理论依据。
1 材料与方法
1.1 供试材料
烟草青枯菌TBRS12 分离自福建省南平市政和县烟草病株,噬菌体RPZH6 分离自福建省南平市政和县烟草根际土壤,二者均由本实验室分离鉴定保存。烟草翠碧1 号种子由福建省烟草科学研究所提供。
TTC 固体培养基和NB 培养基[13]用于青枯菌及噬菌体培养。SM 缓冲液[14]用于噬菌体保存。DNase Ⅰ、RNase A、EcoRⅠ、蛋白酶K购自宝生物工程(大连)有限公司;57.6%氢氧化铜水分散粒剂,上海纽发姆化学品有限公司。氯化钠、聚乙二醇8000(PEG8000)、三氯甲烷、乙二胺四乙酸(EDTA)、Tris-酚、乙醇等均为国药分析纯。
1.2 方法
1.2.1 青枯菌的培养 将保存于-75 ℃的青枯菌在TTC 平板培养基上划线,28 ℃恒温培养24~48 h,挑取单菌落于NB 培养基中,28 ℃、180 r·min-1培养16~18 h,获得对数生长期(OD600值≈0.8)的菌液,用于噬菌体的培养和盆栽实验接种。
1.2.2 噬菌体的培养 取4 ℃保存的噬菌体RPZH6 菌液,按1%(体积分数)的量接种于培养好的青枯菌菌悬液中混匀,静置15 min,28 ℃、130 r·min-1振荡培 养12~16 h,培养液12 000 r·min-1离心5 min,取上清液,用0.45µm 滤膜抽真空过滤除菌,过滤液为噬菌体原液,效价为109pfu·mL-1,备用。
1.2.3 噬菌体对烟草青枯病的防效测定 将烟草种子点播到育苗盘中,每穴1 粒,待生长至3 片真叶时,移入AB∶150型花盆。置于温度25 ℃、光照16 h∕黑暗8 h的温室内培育至5片真叶,6株为1组,分别设计以下3 种处理:①每株浇灌30 mL 噬菌体RPZH6 原液;②每株浇灌30 mL 57.6%氢氧化铜水分散粒剂1 000倍液;③每株浇灌30 mL 无菌水;24 h 后,用灭菌的小刀在烟苗主根两侧各切1 刀,浇灌30 mL 烟草青枯菌菌TBRS12 悬液(OD6000.8)。以不浇灌TBRS12,只浇灌无菌水处理为空白对照(CK)。每个处理3 次重复,每重复6株。培养条件:白天30 ℃,夜间28 ℃,光照12 h、黑暗12 h 的温室里培养,每隔7 d 调查1 次病情[15],计算病情指数和防效。

1.2.4 噬菌体核酸的提取及类型鉴定 参照《分子克隆实验指南》[16]方法获得粗制噬菌体颗粒,4 ℃保存备用。参考苏靖芳等[17]的方法提取噬菌体核酸,-25 ℃保存备用。核酸类型鉴定参考Jin 等[18]方法,在噬菌体核酸中分别加入DNase Ⅰ(RNase Free)、RNase A(DNase Free)和限制性内切酶EcoRⅠ,37 ℃温浴4 h 后,经1%(体积分数)琼脂糖凝胶电泳后于凝胶成像仪观察并拍照。
1.2.5 噬菌体全基因组测序 全基因组测序委托上海欧易生物医学科技有限公司完成。将检测合格的DNA 样品先经Covaris 随机打断成350 bp 的片段,采用TruSeq DNA LT Sample Prep kit 试剂盒进行建库,采用IlluminaHiSeq2000 进行测序。采用Trimmomatic软件进行包括去接头、低质量区域等质量过滤,其中平均每个碱基质量大于20,可用碱基错误概率小于0.001[19]。基因序列组装和拼接用MITObim(https:∕∕github.com∕chrishah∕MITObim)软件[20]。
1.2.6 噬菌体全基因组分析 使用BioEdit 软件[21]分析序列碱基成分;使用在线软件GeneMarks(http:∕∕exon.biology.gatech.edu∕GeneMark∕genemarks.cgi)对编码基因进行预测[22];全基因图谱用在线软件CGView Server V 1.0(http:∕∕stothard.afns.ualberta.ca∕cgview_server∕)绘制[23];获得的基因编码序列与GO(http:∕∕geneontology.org∕)、KEGG(https:∕∕www.kegg.jp∕)、COG(https:∕∕www.ncbi.nlm.nih.gov∕COG∕)和NCBI(https:∕∕www.ncbi.nlm.nih.gov∕)数据库比对进行基因功能注释(E-values<1e-5);使用在 线tRNAscan-SE(v1.3.1)(http:∕∕lowelab.ucsc.edu∕tRNAscan-SE∕)预测tRNA 编码序列[24],其中参数Sequence source 选择bacterial,其他参数默认;用在线软 件Promoter Prediction(http:∕∕www.fruitfly.org∕seq_tools∕promoter.html)和 ARNold: finding terminators(http:∕∕rssf.i2bc.paris-saclay.fr∕toolbox∕arnold∕index.php)预测噬菌体的启动子序列和终止子序列[25-26]。通过NCBI 数据库比对和搜索,下载已公布的噬菌体全基因组序列和相关蛋白序列,比较基因组用在线软件Blastn(https:∕∕blast.ncbi.nlm.nih.gov∕Blast.cgi),比对结果 用Esayfis 2.2.2 软件进行可视化[27];序列多重比对用MAFFT 7.427软件,用PhyloSuite V1.2.1 软件中 的ModelFinder 模块计算最佳模型,用IQ-TREE 模块构建系统发育树,Bootstrap抽样1 000次[28-30]。
1.2.7 数据分析 试验数据采用Excel、DPS 15.10 软件进行处理和统计分析,采用Duncan 氏新复极差法进行差异显著性检验。
2 结果与分析
2.1 噬菌体RPZH6对烟草青枯病的防治效果
噬菌体RPZH6 对烟草青枯病的生防效果(表1)显示,接种后14 d,噬菌体和氢氧化铜处理的病情指数显著低于对照组,噬菌体RPZH6 对烟草青枯病的防治效果为58.83%;接种后21 d,防效为60.98%;接种后35 d,噬菌体RPZH6 的防治效果仍有53.85%,显著高于氢氧化铜处理。
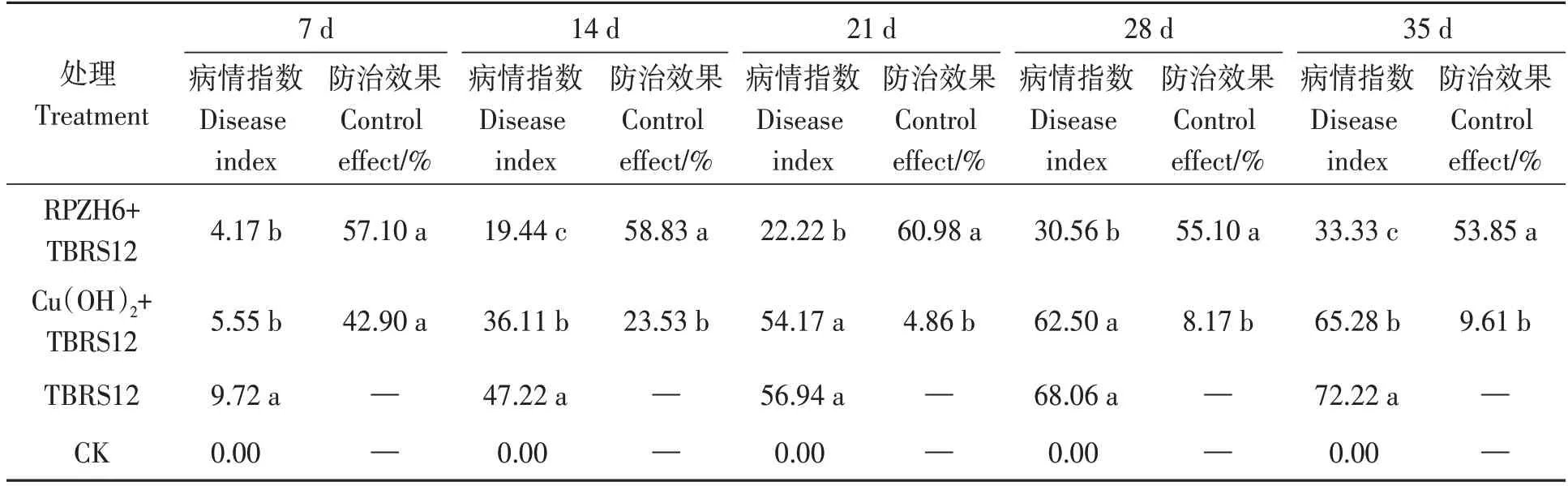
表1 噬菌体RPZH6对烟草青枯病的防治效果Table 1 Control effect of phage RPZH6 on tobacco bacterial wilt
2.2 噬菌体的核酸类型鉴定
分别用DNase Ⅰ、RNase A 及EcoRⅠ酶切噬菌体的核酸,电泳结果如图1,噬菌体RPZH6的核酸能被DNase Ⅰ消化,同时能被限制性内切酶EcoRⅠ切成多个条带,但不被RNase A 降解,说明噬菌体RPZH6的核酸类型为双链DNA(dsDNA)。
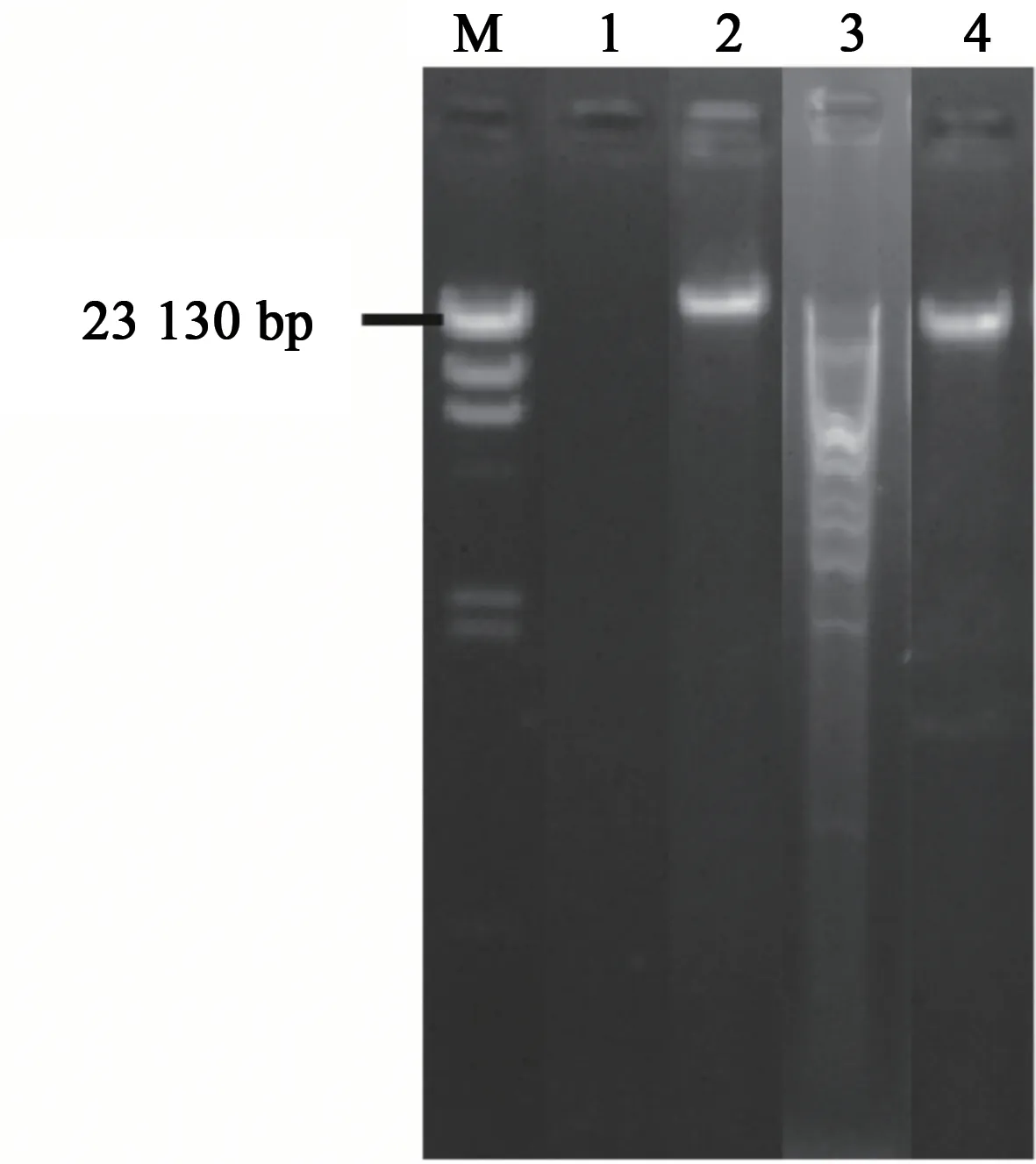
图1 噬菌体RPZH6核酸酶切Fig.1 Enzyme digestion of nuclear acid of phage RPZH6
2.3 噬菌体RPZH6的基因组特性分析
经测序,获得30.16 Mb 原始测序数据reads数,4.52 Gb 原始测序数据量,质控处理后,有效reads数为25.41 Mb,有效数据量为3.81 Gb。经过拼接、组装,噬菌体RPZH6 的基因全长64 657 bp(GenBank 登录号:MT361768),GC 含量64.84%,其中A、C、G、T 含量分别为15.88%、33.15%、31.70%、19.28%。噬菌体RPZH6 预测含有92 个开放阅读框(open reading frame,ORF),1 个tRNA基因(tRNA-Ser-TAG)(图2),30 个启动子序列和18 个终止子序列。预测的开放阅读框序列总长58 694 bp,平均长度638 bp,占全基因组总长90.78%;起始密码子为ATG 的有74 个,GTG 的有12 个,TTG 的有5 个,TAT 的1 个。在92 个开放阅读框中,只有16 个正向排列,占17.4%;其他均为反向排列。
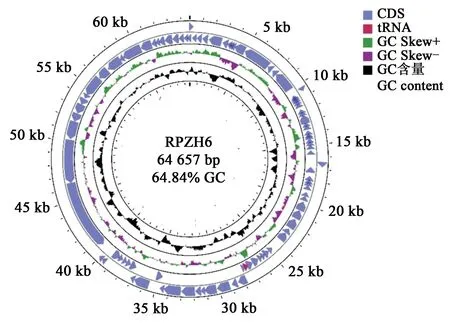
图2 噬菌体RPZH6全基因图谱Fig.2 Complete gene map of phage RPZH6
2.4 基因功能分析
对预测得到的编码基因在GO、KEGG、COG NR 等数据库进行功能注释。结果显示,噬菌体RPZH6 的92 个ORFs 中,有47 个被注释为功能蛋白(表2),42 个被注释为假定蛋白,3 个在数据库中比对不到任何信息。在47 个功能蛋白中,噬菌体结构蛋白有4 个,分别为衣壳蛋白(ORF5)、门脉蛋白(ORF11)、尾纤蛋白(ORF80~81);噬菌体相关功能蛋白有26 个,主要包括病毒粒子相关蛋白(ORF4、74、76、79、82、84、85、88)、复制蛋白(ORF42)、DNA 结合蛋白(ORF50、57、58)、类RecT 蛋白(ORF56)、DarB 类抗抑制蛋白(ORF72、73、90)等;噬菌体相关酶蛋白有10 个,包括末端酶(ORF14、32)、裂解酶(ORF16)、HNH 归巢核酸内切酶(ORF34)、Recb 内切酶(ORF55)、DNA 聚合酶(ORF59)、酪氨酸重组酶(ORF63、64)等;噬菌体转录调节因子有6 个,分别为1 个碳储调节因子(ORF7)和5 个转录调控因子(ORF1、24、52~54)。
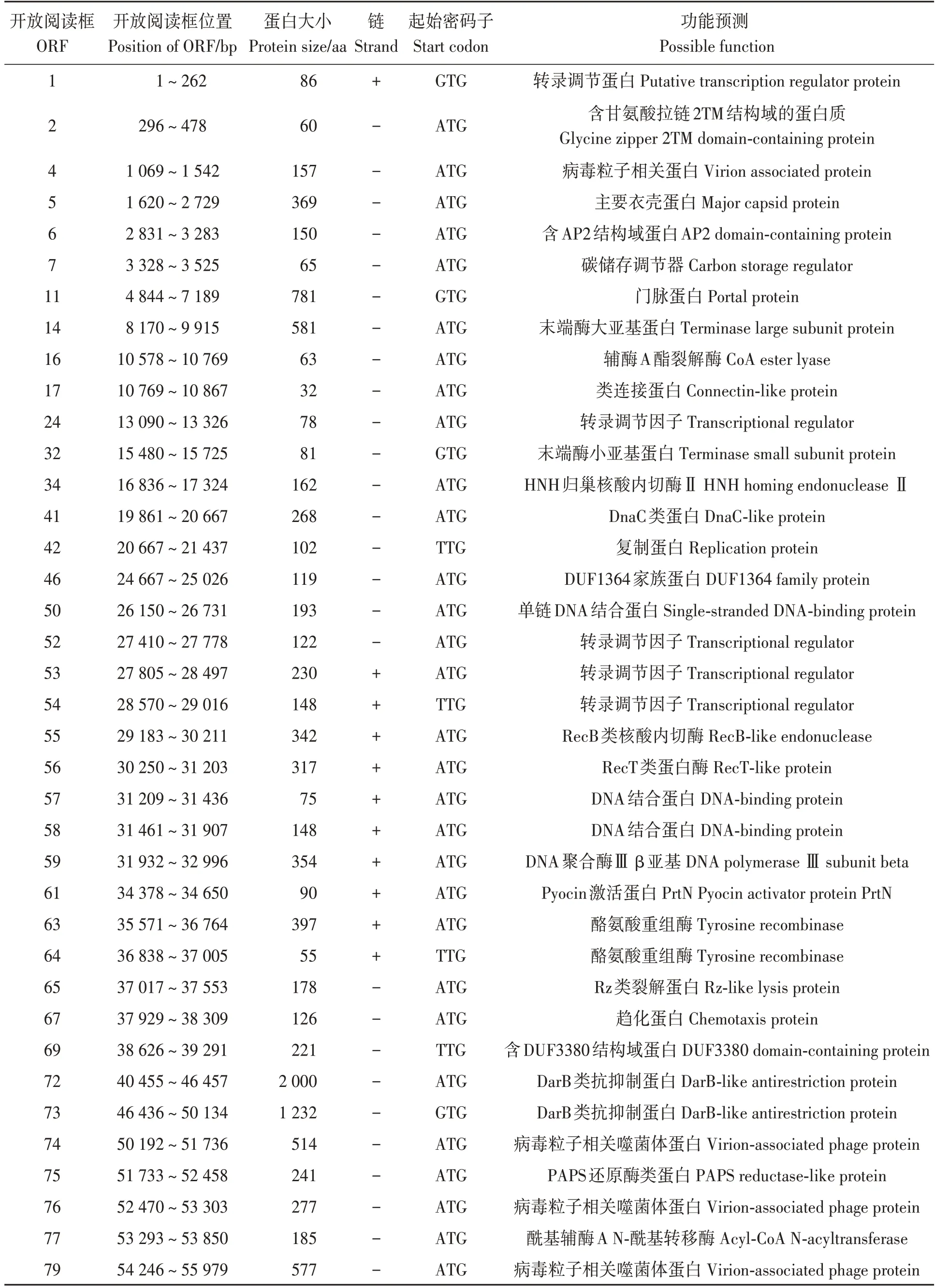
表2 噬菌体RPZH6基因组47个ORF功能预测Table 2 ORF function prediction of the phage RPZH6 genome
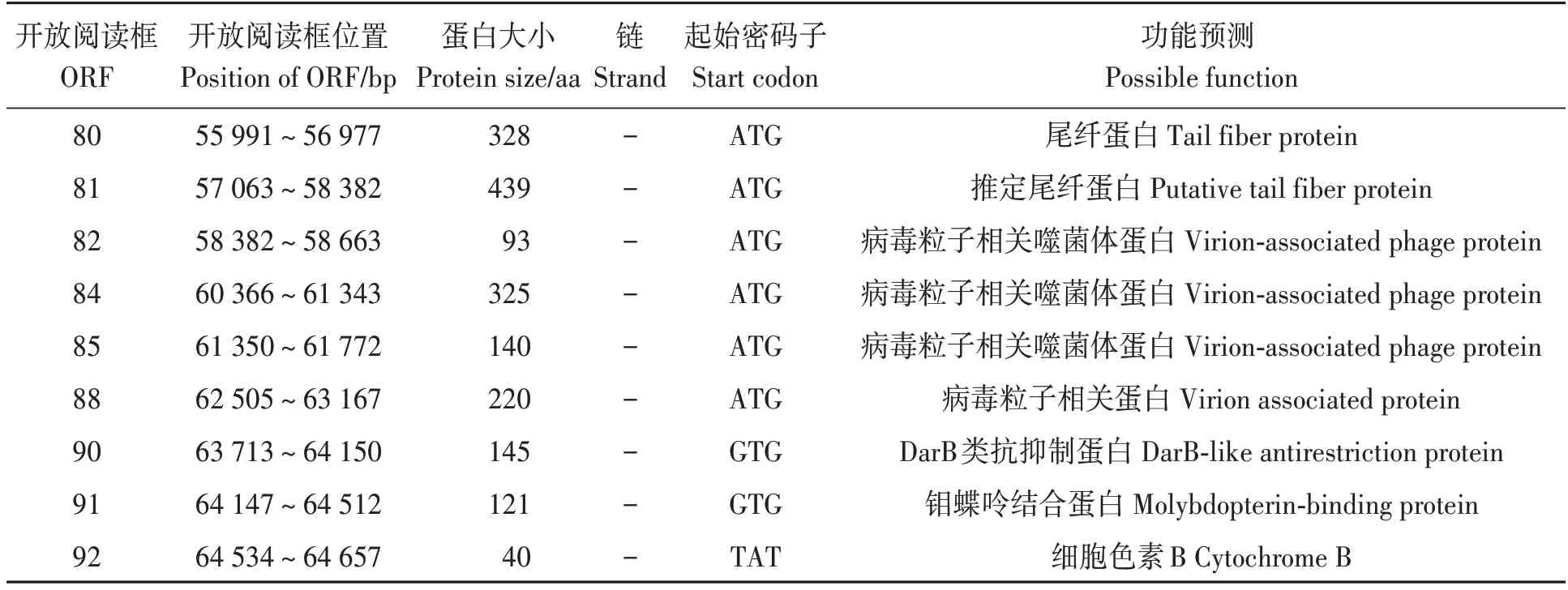
表2 噬菌体RPZH6基因组47个ORF功能预测Table 2 ORF function prediction of the phage RPZH6 genome 续表Continued
2.5 比较基因组及系统发育分析
在NCBI 数据库上BLASTn 比对显示,噬菌体RPZH6 的全基因组与Ralstoniaphage GP4(MH638294,覆盖率76%,一致性95.00%)、Burkholderiavirus Bcep22(AY349011,覆盖率16%,一致性 80.57%)、Burkholderiavirus BcepMigl(JX104231,覆盖率15%,一致性80.21%)、Burkholderiavirus BcepIL02(FJ937737,覆盖率13%,一致性80.79%)和Burkholderiavirus DC1(JN662425,覆盖率13%,一致性81.22%)相似。与其中2 株相似度最高的噬菌体全基因组比较分析结果如图3,噬菌体RPZH6 与GP4 表现相似的基因排列结构,但在部分区域序列(如ORF34~ORF46 之间)存在一些差异;与Bcep22 基因排列结构差异较大,相同功能的基因在基因组中的分布位置不同。

图3 菌体RPZH6与GP4、Bcep22全基因组序列比对Fig.3 Complete genome alignment of phage RPZH6 with GP4 and Bcep22
为进一步明确噬菌体RPZH6的分类地位。基于保守的衣壳蛋白基因(ORF5)和尾纤蛋白基因(ORF80)的氨基酸序列,分别以LG+F+G4(ORF5)和PMB+F+G4(ORF80)为最佳建树模型,采用最大似然法(maximum likelihood,ML)分别构建系统发育树。结果显示,基于衣壳蛋白氨基酸序列构建的系统发育树(图4A),噬菌体RPZH6 与Ralstoniaphage GP4聚成一支,与噬菌体Bcep22、BcepIL02、BcepMigl和DC1聚为同一亚枝;基于尾纤蛋白氨基酸序列构建的系统发育树(图4B),噬菌体RPZH6与Burkholderiavirus DC1 聚为一支,而噬菌体Ralstoniaphage GP4、Burkholderiavirus DC1、Bcep22、BcepIL02 及BcepMigl 均属于短尾噬菌体科、Bcep22属,表明噬菌体RPZH6也属于短尾噬菌体科、Bcep22家族。

图4 基于衣壳蛋白序列和尾纤蛋白序列构建的系统发育树Fig.4 Phylogenetics tree were based on major capsid protein and tail fiber protein
3 讨论
作物青枯病是一种世界分布的细菌性病害,化学防治是控制该类病害的主要手段之一,但防治该类病害的农药种类较少,防效不理想。利用噬菌体防治细菌性病害已有很长的历史,自发现噬菌体以来,人们就尝试应用噬菌体防治植物细菌性病害。由于细菌对抗生素产生抗性并渐增,利用噬菌体防治细菌性病害的技术越来越受重视[6,31]。高苗等[14]从烟草病圃土壤中分离到一株肌尾噬菌体∈RS-1,并研究了其生物学特性;Tanaka等[32]利用噬菌体防治烟草青枯病取得良好的效果;Wei 等[33]研究不同噬菌体混合制剂防治马铃薯青枯病,经噬菌体处理的植株,青枯病发病率降低20%;苏靖芳等[17]从土壤中分离获得1 株短尾噬菌体RS-PII-1,并对其基因组学进行分析。本研究从烟草根际土壤中分离获得一株能在宿主菌苔上产生透明、圆形的噬菌斑,并能使宿主菌液变澄清的烈性青枯菌噬菌体RPZH6,盆栽防效测定结果显示,接种后21 d,对烟草青枯病的防治效果为60.98%;接种后35 d,防效仍有53.85%,其防效显著高于化学药剂。
核酸类型是噬菌体重要的分类依据,根据核酸类型,噬菌体可分为dsDNA 病毒、ssDNA 病毒、dsRNA 病毒和ssRNA 病毒[34]。目前已报道的青枯菌噬菌体主要有2 种:一种为dsDNA 病毒,如长尾噬菌体(Siphoviridae)ΦRS138[9]、短尾噬菌体(Podoviridae)RS-PII-1[17]和phiAP1[35]、肌尾噬菌体(Myoviridae)ΦRSF1 和ΦRSL2[36]等;另一种 为ssDNA 病毒,如丝状噬菌体(Inoviridae)ΦRs551[10]等。本研究获得的噬菌体RPZH6 核酸类型为dsDNA,基因组全长64 657 bp,GC 含量64.84%,含有92 个ORFs,1 个tRNA-Ser-TGA。与其他青枯菌噬菌体相比,噬菌体RPZH6 的GC 含量高于多个已报道的噬菌体,如RS-PII-1 为63.2%[17]、phiAP1为61%[35];Ralstoniaphage GP4为64.01%等[8]。同时,噬菌体RPZH6 的全基因组长度也大于同类噬菌体,RS-PII-1 长42 042 bp,phiAP1 长44 793 bp,Ralstoniaphage GP4 长61 129 bp。另外,在预测的ORF 框中,噬菌体RPZH6 存在3 个未知蛋白,在数据库中比对不到相近的蛋白产物,说明噬菌体在进化过程中存在遗传多样性。基于衣壳蛋白、尾纤蛋白的氨基酸序列构建的系统发育树分析显示,噬菌体RPZH6 与Bcep22-like 家族的短尾噬菌 体 phage GP4、phage Bcep22、phage BcepIL02、phage BcepMigl 和phage DC1 聚成一支。Blastn 比对分析显示,噬菌体RPZH6 与Ralstoniaphage GP4 有较高的同源性,但覆盖率仅为76%,覆盖区的一致性为95%。基于全基因组序列比较分析,噬菌体RPZH6 与Ralstoniaphage GP4 的基因排列结构相似性较高,但在ORF34~ORF46 等区域之间存在一些差异,序列同源性低(图3)。寄主范围上,Ralstoniaphage GP4 主要寄生姜青枯病菌及部分桑青枯病菌[8],而噬菌体RPZH6 的宿主菌为烟草、番茄、辣椒和甘薯青枯病菌(实验室数据)。综上分析,认为噬菌体RPZH6 属于Bcep22 家族成员,是一株新的青枯菌短尾噬菌体。

