草甘膦铵盐诱导谷子雄性不育的转录组分析
郭瑞锋,任月梅*,杨忠,刘贵山,任广兵,张绶,朱文娟
(1.山西农业大学高寒区作物研究所,山西大同 037008;2.五寨县农业农村局,山西忻州 036200)
谷子作为北方种植的主要杂粮作物,不仅具有抗旱、节水、耐贫瘠等特点,还是环境友好型作物。近年来,小米价格不断提升,农业机械化水平越来越高,农民种植谷子的积极性空前高涨。由于高产、优质且适合加工的品种极其有限,需要不断创制出新材料以满足市场需求。而谷子杂种优势利用比较缓慢,目前,谷子杂交种生产还没有三系配套,主要利用两系法及高度雄性不育系和温光敏不育系育种[1]。目前,谷子的不育材料是受核基因控制的核雄性不育材料,在杂交制种时易出现不育株与可育株田间混杂,不易鉴别、杂种不纯等问题[2]。利用温光敏不育系育种,制种成本较高,因此在生产实践上应用还比较窄。常规种的培育通常采用人工去雄、温汤去雄[3]、太阳能杀雄[4]等方法,受环境和人为因素影响较大,存在杂交效率低等问题。化学杀雄为谷子育种提供了新的方法。关于化学杀雄剂方面的研究在小麦、水稻、油菜、糜子等作物上有相关报道[5-8],本课题组进行了谷子化学杀雄剂的筛选[9],但化学试剂诱导谷子雄性不育的机理研究鲜有报道。
转录组是生物体及细胞在特定时空下完整的RNA 转录本,代表了表型与DNA 编码信息之间的重要联系[10]。转录组学是功能基因组学研究的重要组成部分,是在全基因组水平上研究基因功能以及基因结构,揭示基因表达、转录调控规律以及特定生物学过程分子机理的一门学科[11]。随着分子生物学和高通量测序技术的高速发展,转录组测序技术已逐渐成为转录组学研究中不可或缺的重要手段。
本课题组通过多年多点的化学杀雄剂筛选试验得出草甘膦铵盐可作为谷子适宜的化学杀雄剂[9]。基于此,本研究以山西省忻州地区谷子主栽品种为供试材料,用3.75 mg·L-1草甘膦铵盐杀雄后取其穗部,进行转录组测序分析,筛选差异表达基因,并对其进行GO 功能注释和KEGG 代谢通路分析;同时测定有效杀雄植株体内的抗性淀粉、可溶性糖、赤霉素(gibberellin,GA)和生长 素(indole-3-acetic acid,IAA)含量,以期从生理生化和分子水平探索草甘膦铵盐诱导谷子雄性不育的机理,为谷子杂种优势利用奠定理论基础。
1 材料与方法
1.1 试验材料
转录组测序供试材料为山西农业大学高寒区作物研究所审定品种大同27 号,生理指标测定供试材料为大同27号、大同34号和农家种大白谷均由本课题组保存。
1.2 试验地点及材料的处理
试验于2019—2020 年在山西省农业科学院(现山西农业大学)高寒区作物研究所毛皂试验地进行。
于2019 年5月上旬播种,5~6 叶期定苗,日常管理同常规。试验采用完全随机区组设计。处理组采用化学试剂草甘膦铵盐对大同27 号谷穗进行化学杀雄;未喷施药剂的空白处理作为对照。处理组于抽穗始期进行喷药,采用小型喷雾器喷施3.75 mg·L-1草甘膦铵盐溶液,均匀喷湿花序,单穗受药量为9~10 mL。在喷药处理组中又分别设置喷药后套袋自交和喷药后套袋饱和授粉2 种方式。在抽穗后开花前,每个处理选取长势整齐一致的10 穗进行标记,每处理2 次重复。喷药后套袋自交处理记作S1、S2;喷药后套袋饱和授粉处理记作P1、P2;正常生长的未喷药对照记作CK1、CK2。
1.3 生理指标的测定
于谷子成熟期,分别采集未喷药的正常生长植株和喷施草甘膦铵盐后的套袋自交、套袋饱和授粉谷穗各3 个,应用酶联免疫分析试剂盒(上海酶联生物),采用双抗体夹心法分别测定谷穗样品中的抗性淀粉、可溶性糖、赤霉素、生长素的含量[12]。
1.4 转录组测序
1.4.1 RNA 的提取 通过Oligo (dT) 磁珠(百迈格生物)富集总RNA 中带有polyA 结构的mRNA,采用离子打断的方式,将RNA 打断为200~300 bp 片段。以RNA 为模板,用6 碱基随机引物和逆转录酶合成cDNA 第一链,并以第一链cDNA为模板进行第二链cDNA的合成。
1.4.2 文库构建、检测和转录组测序 RNA 进行抽提、纯化后构建文库。建库之后,采用第二代测序技术(next-generation sequencing,NGS)基 于Illumina HiSeq 测序平台进行双末端(paired-end,PE)测序,由上海派森诺基因科技有限公司完成。
1.5 数据分析
1.5.1 参考基因组 使用Tophat 2 软件,以xiaomi基因组 为参考 基因组(http:∕∕sky.sxau.edu.cn∕MDSi.htm),参考Ensembl、GO、KEGG 数据库进行基因组注释。
1.5.2 有参转录组分析 将原始数据过滤后得到的高质量序列(clean data)比对到该物种的参考基因组上。根据比对结果,计算每个基因的表达量[13]。在此基础上,进一步对样品进行表达差异分析[13]和富集分析。基因表达量采用RPKM(reads per kilo bases per million reads)值。采用DESeq 软件对基因表达进行差异分析,将差异表达倍数≥2 且P值<0.05 的基因定为差异表达基因(differentially expressed gene,DEG)。
2 结果与分析
2.1 转录组测序数据评估
对测试数据中包含的一些带接头、低质量的reads进行过滤,并将测得的reads与参考基因组进行比对,结果(表1)表明,高质量序列碱基数达到6 G以上,且高质量序列的占比和高质量序列碱基占比均超过98%。Q20碱基识别准确率在99%以上的碱基占比大于95.96%;Q30 碱基识别准确率在99.9%以上的碱基占比大于90.48%。比对上参考基因组的序列占总数的73.23%以上。由此表明,测序数据质量较好,参考基因组选择较合适。
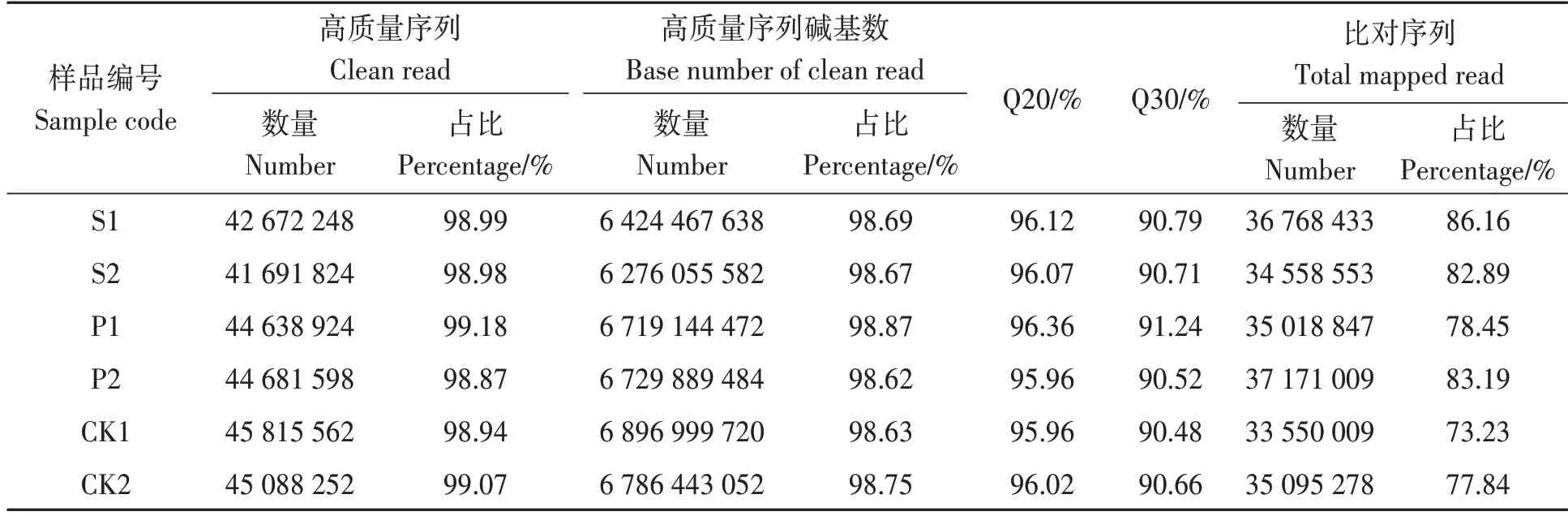
表1 原始数据统计Table 1 Raw data statistics
2.2 差异表达基因筛选
差异表达基因筛选结果如表2 所示。草甘膦铵盐处理后套袋自交组(S1)和未处理对照组(CK1)间的差异表达基因为797 个,其中上调表达基因296 个,占37.14%;下调表达基因501 个,占62.86%。草甘膦铵盐处理后套袋饱和授粉组(P1)和未处理对照组(CK1)间的差异表达基因为3 072个,其中上调表达基因1 513个,占49.25%;下调表达基因1 559 个,占50.75%。草甘膦铵盐处理后套袋自交组(S1)和套袋后饱和授粉组(P1)间的差异表达基因为169 个,其中上调表达基因56 个,占33.14% ;下调表达基因113 个,占66.86%。
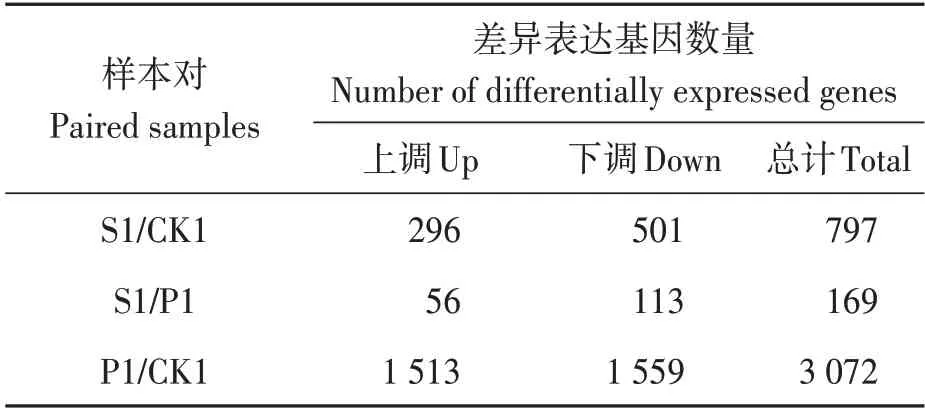
表2 差异表达基因数量Table 2 Number of differentially expressed genes
2.3 差异表达基因的GO分析
S1 处理较对照相比,有645 个差异表达基因获得GO 功能分类,包括405 个下调表达基因和240 个上调表达基因(图1 与表3)。在分子功能分类中,参与水解酶活性的差异表达基因共199 个;作用于糖基键的显著富集基因共37 个,其中下调31 个,上调6 个;水解O 糖基化合物的显著富集基因共34 个,其中下调基因29 个,上调基因5 个;参与氧化还原酶活性的显著差异表达基因共29 个,其中18 个下调表达,11 个上调表达;与铁离子结合的差异表达基因共30 个,其中19 个上调表达,11 个下调表达。在生物过程分类中,参与二糖生物合成过程的差异表达基因为8 个,均为下调表达;与激素代谢过程有关的差异表达基因为13 个,其中11 个下调表达;与激素生物合成过程有关的差异表达基因为4 个,其中2 个下调表达。在细胞组分分类中,主要涉及细胞壁(26 个)、外部封装结构(26 个)、植物型细胞壁(11 个)等。各功能分类中的差异表达基因数量均为下调基因大于上调基因,尤其是生物工程分类中富集到的与二糖生物合成过程、海藻糖生物合成过程、海藻糖代谢、低聚糖生物合成过程有关的差异基因均为下调表达。
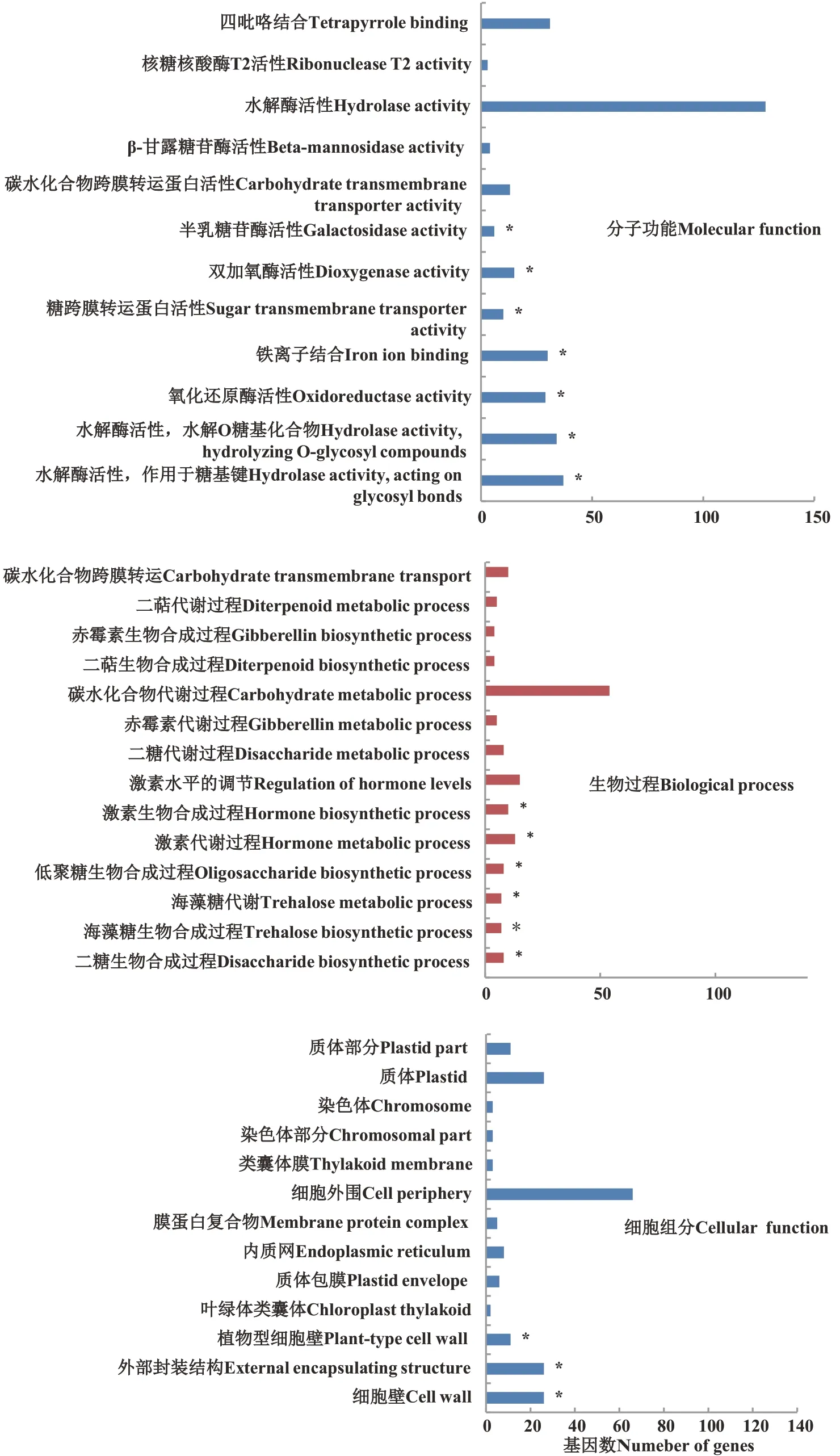
图1 差异表达基因GO富集分析Fig.1 Go enriched analysis of differentially expressed gene
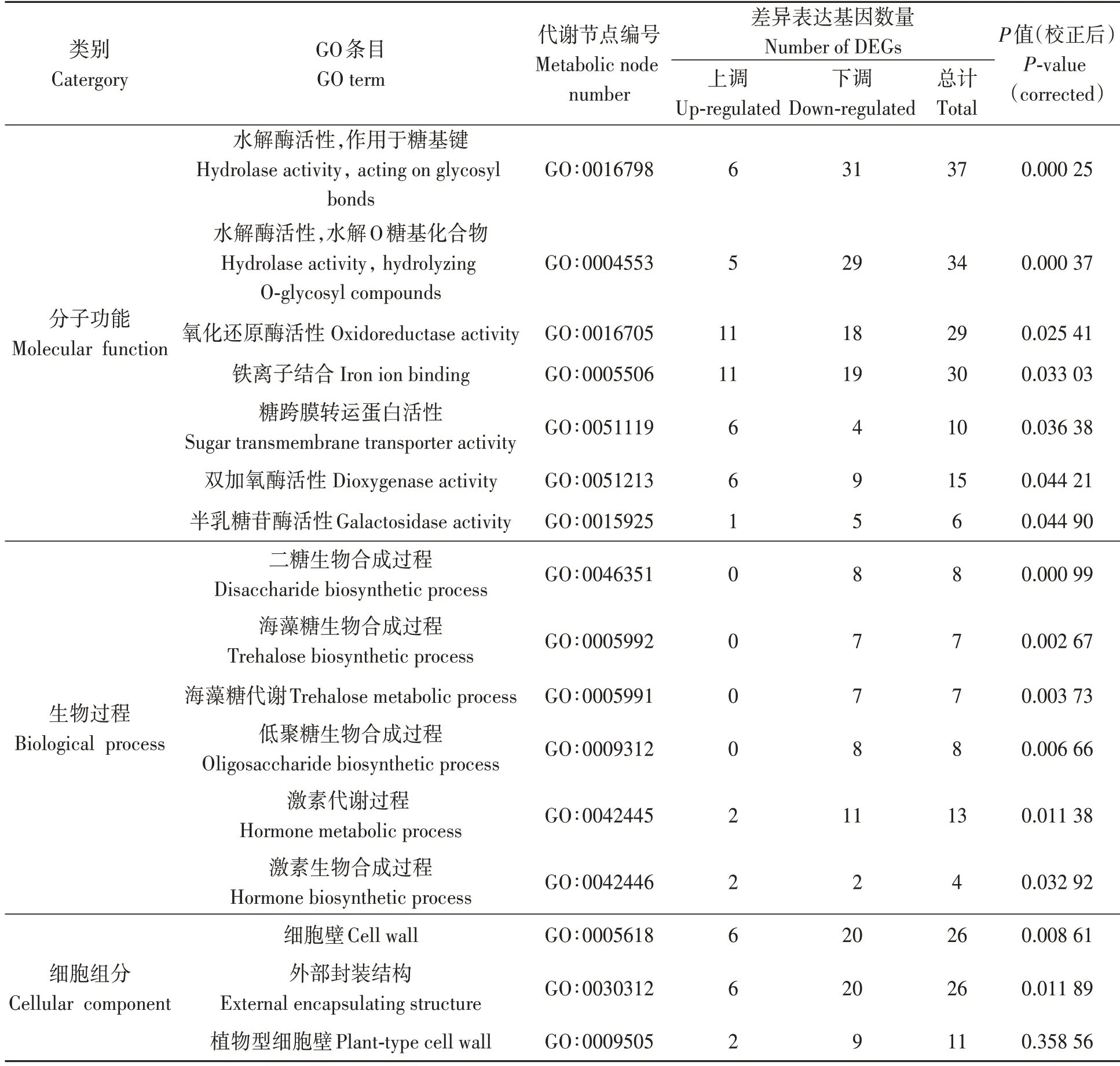
表3 差异表达基因显著富集的GO分类Table 3 GO classification for the significant enrichment of differentially expressed genes
2.4 样品差异表达基因的KEGG分析
通过KEGG 富集分析,共建立了138 条通路,图2列出了P值最小的前20条,差异表达基因数量以点的大小来表示,不同的P值以颜色区分。与未处理对照相比,草甘膦铵盐处理后谷穗差异表达基因中涉及植物激素信号转导(plant hormone signal transduction)的最多,为19 个,其 中,Si3G17190-生长素反应蛋白IAA18、Si2G22440-蛋白质TIFY10c、Si9G15750-转录因子PIF1、Si1G34880-促分裂原激活的蛋白激酶激酶5、Si1G25820-生长素反应蛋白SAUR36的基因上调表达,Si3G37640-转录因子PIF4、Si2G37490-可能的吲哚-3-乙酸-酰胺基合成酶GH3.8、DELLA蛋白(GA)等14个编码基因下调表达;其次是淀粉和蔗糖代谢途径(starch and sucrose metabolism),为16个,其中,Si7G17790-i7 葡萄糖苷酶18、Si9G12460-i9 葡萄糖苷酶7、Si7G19410-i7果糖呋喃糖苷酶1、Si1G18670-1,4-α-葡聚糖支化酶2,叶绿体∕淀粉体、Si3G11180-己糖激酶-7等14个编码基因下调表达。
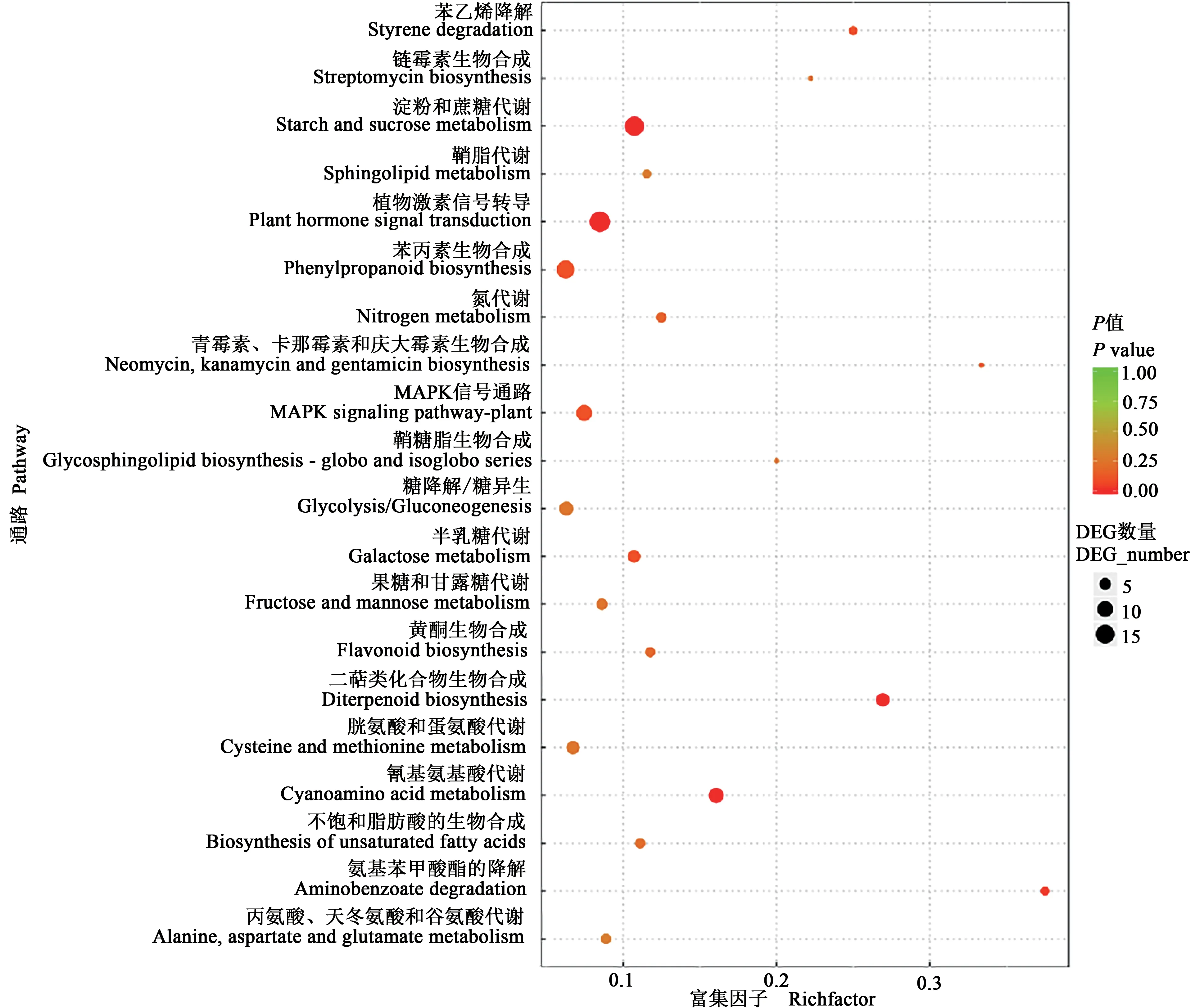
图2 差异表达基因KEGG 富集散点图Fig.2 Scatter plot of differential gene KEGG enrichment
另一方面,二萜生物合成(diterpenoid biosynthesis)(7 个)、淀粉和蔗糖代谢(starch and sucrose metabolism)(16 个)、植物激素信号转 导(plant hormone signal transduction)(19 个)、氰氨基 酸代谢(cyanoamino acid metabolism)(3 个)的P值最小,说明这些通路的富集程度较高。
2.5 草甘膦铵盐处理后谷穗淀粉和可溶性糖含量的变化
由图3 可知,大同27 号、大同34、大白谷在草甘膦铵盐处理后,淀粉含量降低,其中,自交组的淀粉含量平均为42.16 mg·g-1,3 个品种均显著低于对照;草甘膦铵盐处理后可溶性糖含量较对照也有所降低,但差异不显著。这与差异表达基因的KEGG 富集分析结果一致,淀粉和可溶性糖代谢途径相关基因下调表达,可能引起糖代谢的紊乱,影响营养物质向小孢子的运输,从而导致雄性不育。
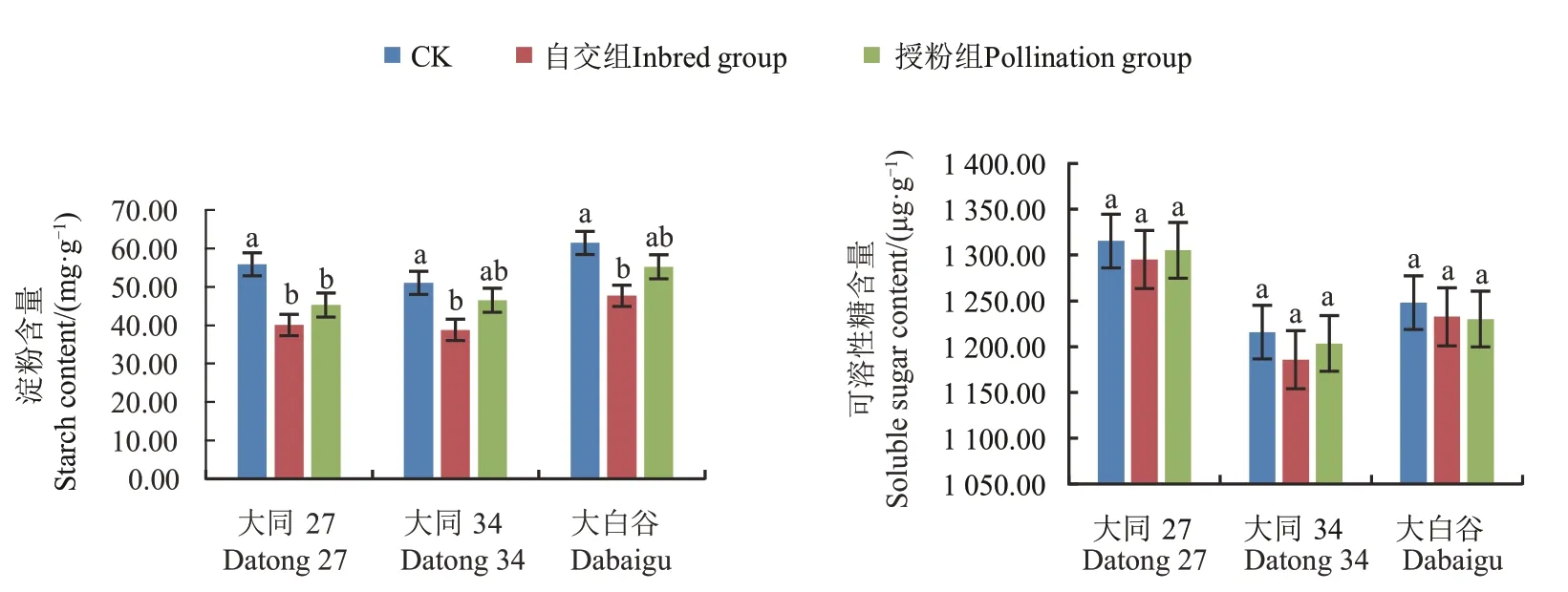
图3 草甘膦铵盐处理后谷穗的淀粉和可溶性糖含量Fig.3 Contents of spike starch and soluble sugar after glyphosate ammonium treatment
2.6 草甘膦铵处理后谷穗中植物激素GA和IAA含量的变化
由图4 可知,在草甘膦铵盐处理后,大同27 号、大同34 和大白谷谷穗中的GA 含量显著降低,其中,自交组平均为495.2 pmol·g-1,授粉组平均为513.7 pmol·g-1。这与差异表达基因的KEGG富集分析结果一致,下游调控育性的基因表达量下调,导致GA 含量降低,使绒毡层异常伸长,花粉壁形成受阻,从而影响花粉育性。
在草甘膦铵盐处理后,除大白谷套袋自交组外,处理组谷穗中IAA 含量较对照显著增加(图4)。其中,3 个品种CK 组的IAA 含量平均为0.063 µmol·g-1,自交组平均为0.099 µmol·g-1,授粉组平均为0.110µmol·g-1。
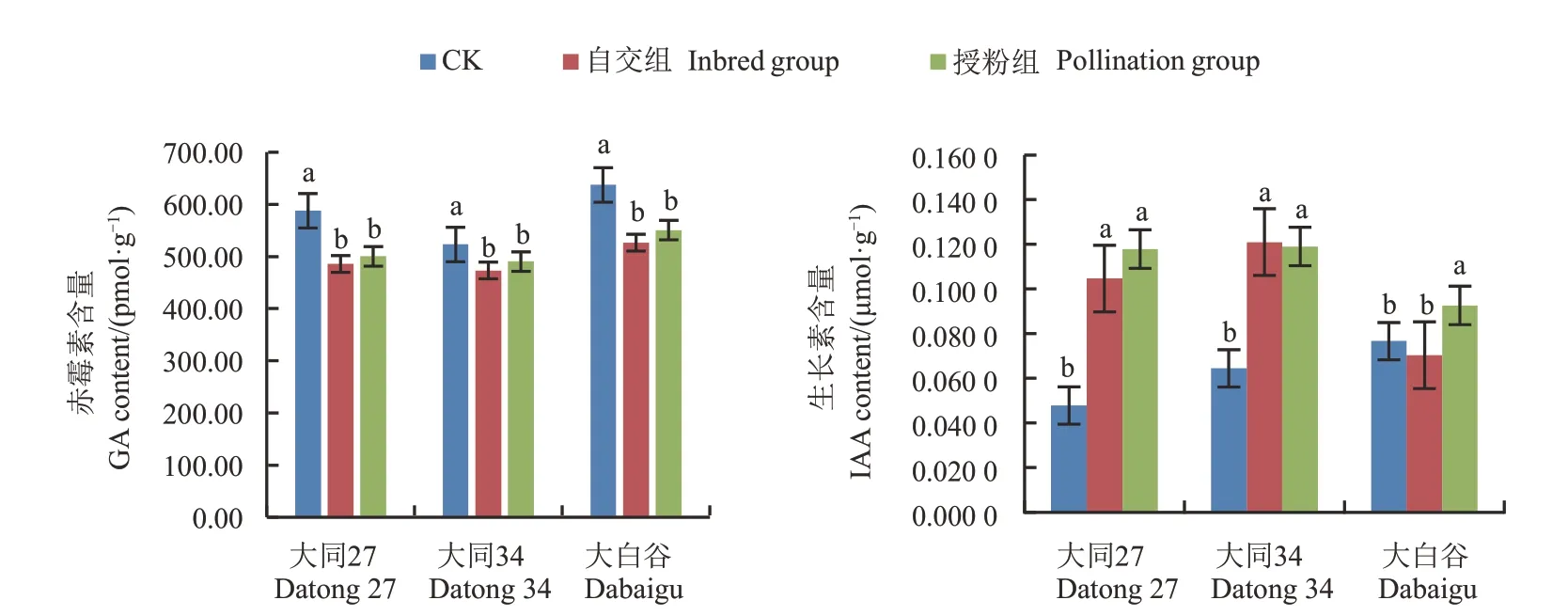
图4 草甘膦铵盐处理后谷穗的GA和IAA含量Fig.4 Contents of GA and IAA in grain ears after glyphosate ammonium salt treatment
3 讨论
本研究通过草甘膦铵盐诱导谷子雄性不育的转录组学分析发现,谷穗对草甘膦铵盐处理的响应基因显著富集于植物激素信号转导通路和淀粉、蔗糖代谢途径,说明草甘膦铵盐诱导谷子雄性不育可能主要是由于差异表达基因对以上2 个生物代谢过程调控引起的。
研究表明,小麦、水稻、棉花等农作物雄性不育与其内源激素的失调密切相关[14-16]。本研究基于KEGG 富集分析发现,涉及植物激素信号转导途径的差异表达基因最多,为19 个,其中Si3G17190-生长素反应蛋白IAA18、Si2G22440-蛋白 质TIFY10c、Si9G15750-转录因 子PIF1、Si1G34880-促分裂原激活的蛋白激酶激酶5、Si1G25820-生长素反应蛋白SAUR36 的编码基因上调表达;Si3G37640-转录因子PIF4、Si2G37490-可能的吲哚-3-乙酸-酰胺基合成酶GH3.8、DELLA蛋白(GA)等14个编码基因下调表达,这些差异表达基因的表达可能导致谷子内源激素平衡失调。
张凯等[17]研究发现,化学杀雄剂2号处理后水稻花药GA3含量显著低于对照。本研究采用草甘膦铵盐处理谷穗后,3 个谷子品种的GA 含量均较对照显著降低。由此推测GA 含量的降低可能是影响花粉育性的因子之一[18],由于DELLA 蛋白(GA)的下调表达,GA含量降低导致绒毡层异常伸长,花粉壁形成受阻,从而影响花粉育性。本研究还发现,草甘膦铵盐处理谷穗后,IAA 的含量较对照显著增加,由此推断IAA 水平的失衡也是引起植物雄性不育的原因之一。丁泽琴[19]研究表明茄子不育系的花药中IAA 含量高于可育系。Horner 等[20]研究表明,IAA 的高水平累积可诱导乙烯代谢,从而导致植物雄性不育。张爱民等[21]研究表明,无论是小麦核质互作雄性不育还是化学杂交剂诱导的小麦雄性不育都与IAA含量有关。
本研究表明,草甘膦铵盐处理谷穗后,涉及淀粉和蔗糖代谢途径的差异表达基因也较多,为16 个,其 中Si7G17790-β -葡萄糖苷酶18、Si9G12460-β-葡萄糖苷酶7、Si7G19410-β-果糖呋喃糖苷酶1、Si1G18670-1,4-α-葡聚糖支化酶2,叶绿体∕淀粉体、Si3G11180-己糖激酶-7 等14 个基因显著下调表达;同时,大同27、大同34 和大白谷3 个品种在草甘膦铵盐处理后套袋自交的谷穗中淀粉和可溶性糖含量较对照显著降低。糖含量的高低可能是决定花粉育性的关键因素[22],在植物小孢子发育早期,花药生长快速、代谢活跃,且是花器官中库强度最高的部位,大量的糖被运输到花药中以支持小孢子的早期发育[23],如果这时遇到非生物胁迫,如化学杀雄剂处理等,花药的淀粉和可溶性糖含量显著降低,花粉粒数量减少,活性降低,从而导致雄性不育,与前人研究结果一致[24]。Li 等[25]用单嘧磺隆钠诱导甘蓝型油菜,发现影响其碳水化合物和脂质代谢,可溶性糖含量降低。郝媛媛[26]通过分析测定BAU-9403 诱导的小麦雄性不育株籽粒的蔗糖、淀粉、可溶性糖含量等指标,发现化学杀雄剂诱导的植株其籽粒对碳水化合物的转化和利用能力较差,且淀粉累积速率也明显低于正常株。GO分析得出,在细胞组分功能分类中,较多的差异表达基因显著富集到细胞壁、外部封装结构、植物型细胞壁等组分结构。推测草甘膦铵盐处理谷穗后可能影响胞外信号分子及糖类等物质从细胞膜到液泡的运输,同时引起激素合成与代谢的改变,从而导致谷穗雄性不育[27]。

